催化湿式氧化技术处理苯并三氮唑生产废水的研究
常建勇,刘 伟
(1.河南省医药学校,河南 开封 475001;2. 河南工业职业技术学院,河南 南阳 473000)
0 引言
随着工业的快速发展和城市的急剧膨胀,高浓度有机废水的排放日益增多,带来了严重的水污染问题。 这类废水一般由造纸、皮革、食品工业及化学工业排出,通常含有高浓度难降解有机污染物以及氨氮化合物、悬浮物等污染物,对环境水体的污染程度大,采用常规的生物或物理化学净化方法处理已难以或无法满足净化处理的技术和经济要求。 因此,如何有效地治理高浓度有机废水,已经成为现阶段国际环境保护技术领域亟待解决的一个难题。
苯并三氮唑是一种重要的精细化工产品, 它的用途很广,主要用于铜和铜合金的缓蚀剂、金属防锈剂、照相防雾剂和有机合成中间体[1]。 还广泛应用于涂料添加剂、合成洗涤剂的防腐剂、抗凝剂、润滑添加剂、合成染料中间体、高分子材料稳定剂、植物生长调节剂、防变色剂、气相缓蚀剂和紫外吸收剂。 近几年,苯并三氮唑的发展非常迅速,但是在生产的同时有大量废水产生,特点为浓度高、成分复杂、化学需氧量高,用传统的方法处理较困难。
催化湿式氧化工艺是一种对高浓度难降解有毒有害废水进行有效高级氧化处理的技术[2-5]。 它是在一定温度、压力下,在催化剂作用下,经空气氧化,使污水中的有机物及氨分别氧化分解成CO2,H20 及N2等无害物质,达到净化目的。 它具有净化效率高、流程简单、占地面积小等特点,而且不产生污泥,同时还可以脱色、除臭及杀菌消毒。 这一技术在20 世纪90 年代初期已经达到了工业化水平。
本研究以浙江某化工企业在生产苯并三氮唑过程中的实际废水为实验对象,以CuO-Co3O4-MnO2/ZrO2-CeO2为催化剂,通过催化湿式氧化技术对苯并三氮唑进行处理,探讨了适宜的反应工艺条件,结果表明采用催化湿式氧化技术,具有较高的CODcr 去除率。
1 实验部分
1.1 实验方法
实验用废水为在生产苯并三氮唑过程中产生的高浓度有机废水。 废水中主要含有邻硝基氯苯、水合肼、乙酸乙酯、苯并三氮唑、亚硝酸钠、正庚醇等有机物。 废水中CODcr为21 520 mg/L 左右,pH 值为5.5。 催化湿式氧化反应在1L高压反应釜中进行, 先加入废水500ml 和适量的催化剂,充入一定压力的氧气并搅拌,升温到反应所需要的温度并保持温度恒定,此时记为反应零点。 每隔一段时间,打开阀门,定量取样分析并测定废CODcr,以CODcr 去除率高低表示催化剂的反应活性。
1.2 分析方法
按照GB-11914-89 的有关规定, 本实验反应COD 的测定采用重铬酸钾法(CODcr);用PHS-10A 型数字酸度计测定进水及出水的pH 值; 采用BET 法测定催化剂比表面积,使用CHEMBET-3000 表面测定仪测定催化剂比表面积。
1.3 催化剂制备
催化剂制备采用浸渍法。 将金属活性组分的硝酸盐溶液按一定比例混合配置成浸渍液,将载体浸渍在浸渍液中,同时加入一定量络合剂。 在恒温水浴中浸渍一定时间后,进行过滤,然后在一定温度下干燥、焙烧,得到复合负载型催化剂。
2 实验结果与讨论
2.1 主活性组分及载体的确定
实验选用CuO 为主活性组分,分别以ZrO2-CeO2、γ-Al2O3为载体,采用浸渍法制备催化剂,在催化剂用量为5g、反应条件T=200℃、Po2=2.0MPa、反应时间t=120min、废水pH=5.5、废水初始CODcr 浓度为21 520mg/L 的条件下进行CWAO 反应。与无催化剂的WAO 反应进行比较,结果如表1 所示。
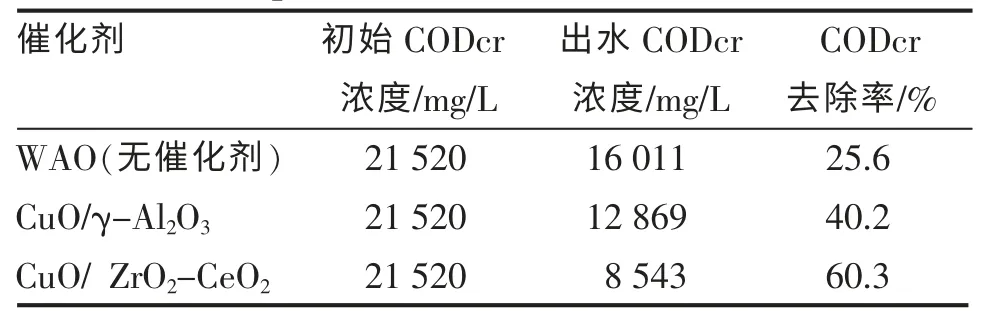
表1 WAO 与CWAO 处理效果的比较Table 1 Comparison of WAO and CWAO treatment
由表1 可以看出,在相同反应条件下,在任何一种载体上,负载活性组分CuO 后废水CODcr 去除率都明显增加,而采用ZrO2-CeO2作为催化剂载体处理效果更佳。因此,实验选用CuO 为催化剂主活性成分, 选用ZrO2-CeO2为催化剂载体,处理高浓度苯并三氮唑生产过程中产生的废水。
2.2 添加第二组分及碱金属助剂对催化剂性能的影响
实验以ZrO2-CeO2作为载体,以CuO 为活性主组分与第二活性组分Co3O4与碱金属助剂MnO2复合,制备催化剂。 在催化剂用量为5g,T=200℃、Po2=2.0MPa、废水pH=5.5、废水初始CODcr 浓度为21 520mg/L 反应条件下,用制备的复合催化剂处理苯并三氮唑生产废水,考察CODcr 去除率随时间变化曲线(如图1 所示)。
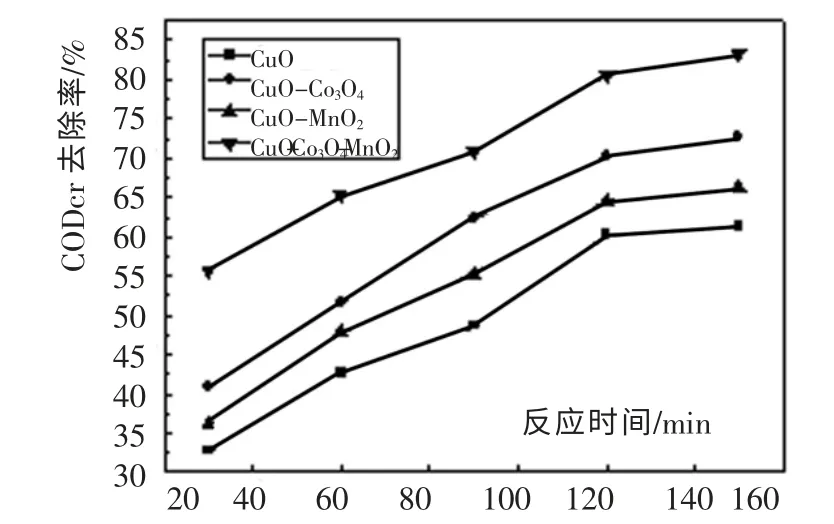
图1 添加Co3O4 和掺入碱金属助剂MnO2 对催化活性的影响曲线图Fig. 1 Influence curve of adding Co3O4 and Alkali metal additive MnO2 to catalytic activity
由图1 可知,反应150min,CuO添加第二活性组分Co3O4后,CODcr 去除率从61.3%提高到72.8%;CuO-Co3O4催化剂加入了MnO2后,CODcr 去除率提高到83.4%。 这表明添加Co3O4和掺入碱金属助剂MnO2,能显著提高催化剂的催化活性。
2.3 焙烧温度对催化剂性能的影响
催化剂的性质除取决于催化剂的组成、含量外,与催化剂的制备方法、工艺条件也密切相关。 在制备条件中,焙烧温度是最主要的因素。 本实验使用5 种不同焙烧温度制备的CuO-Co3O4-MnO2/ZrO2-CeO2催化剂, 在催化剂用量为5g、反应温度T=200℃、氧气分压Po2=2.0 MPa、反应时间为120min、废水pH=5.5、 初始CODcr 浓度为21 520 mg/L 的反应条件下,考察不同焙烧温度对催化剂的比表面积及CODcr 去除率的影响,实验结果如图2 所示。
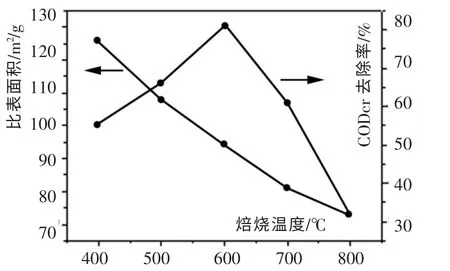
图2 不同焙烧温度对比表面积和CODcr 去除率的影响Fig. 2 Influence of different calcination temperatures to surface area and CODcr removal rate
从图2 可以看出,随着焙烧温度的升高,比表面积一直减少; 而废水CODcr 去除率随温度的升高先迅速增加,在600℃左右达到最大值,此后随着焙烧温度的升高,CODcr 去除率开始下降。 催化剂的焙烧温度对催化剂表面晶粒的大小分布和晶体缺陷[6]等方面都有很大的影响[7]。 高温可能会导致载体和活性组分的烧结或者活性组分晶粒长大,堵塞载体孔道,会造成催化剂的比表面积减少,活性下降。 温度太低,催化剂各组分以及载体间的相互作用力弱,不利于催化剂的稳定,影响反应活性。
因此焙烧温度太高或太低,对催化剂都不利。
催化剂的制备是个综合过程, 所以由实验结果选择600℃为最佳焙烧温度。
2.4 最佳反应工艺条件的确定
2.4.1 催化剂用量对CODcr 去除率的影响
在反应温度T=200℃,Po2=2.0MPa, 反应时间为120min,废水pH 值=5.5, 初始CODcr 浓度为21 520mg/L的反应条件下,考察催化剂CuO-Co3O4-MnO2/ZrO2-CeO2的用量对苯并三氮唑生产废水处理效果的影响,实验结果如图3 所示。
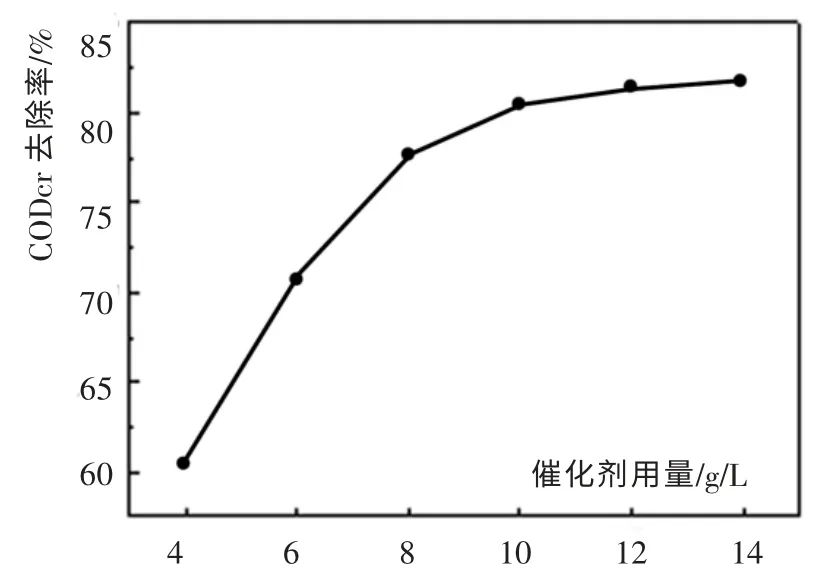
图3 催化剂用量对CODcr 去除率的影响Fig. 3 Influence of catalyst dosage toCODcr removal rate
从图3 可以看出,随着催化剂用量的增加,CODcr去除率升高。 当催化剂用量从4g/L 增加到10g/L时,CODcr 去除率从60.4%上升到80.6%,随后CODcr 去除率增加缓慢。综合考虑催化剂的处理效率及运行费用,实验选用的催化剂用量为10g/L。
2.4.2 反应温度对CODcr 去除率及废水出水pH 值的影响
在催化湿式氧化反应中,提高反应温度是提高CODcr 去除率最有效的途径。 实验在Po2=2.0MPa, 废水pH=5.5 初始CODcr=21 520mg/L 条件下, 在温度为240℃、220℃、200℃和180℃条件下进行催化氧化实验。 CODcr 去除率随时间变化曲线如图4 所示。
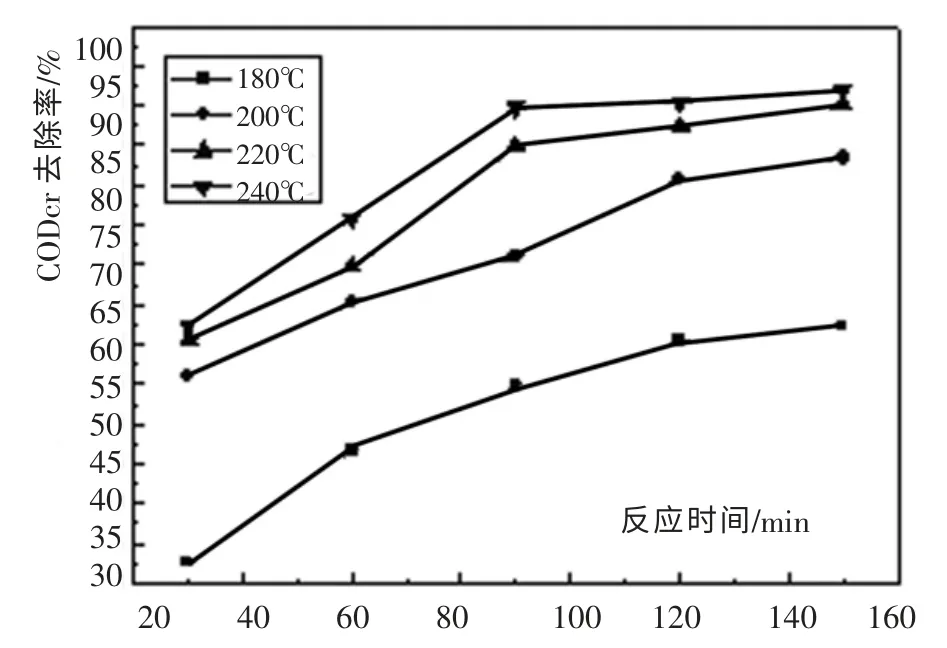
图4 反应温度对CODcr 去除率的影响Fig. 4 Influence of reaction temperature to CODcr removal rate
由图4 可以看出, 随着温度的升高,CODcr 去除率不断提高。这是由于氧在水中的传质系数随温度的升高而增大,同时温度的升高还可以减小水的黏度,并增加氧气向液体中传质的速度[8]。 在温度为180℃时,反应150min,CODcr 去除率只有62.3%;当温度升高到220℃时,CODcr 去除率提高到90.2%。虽然随着温度的升高处理效果会越来越好,但温度过高时必然会产生反应器造价昂贵、工艺流程复杂、安全性能降低,能量消耗过大等问题。 而且温度过高也可能使催化剂结炭,从而降低催化剂的反应活性。因此,综合考虑各方面因素,实验选择的最佳反应温度为220℃。
在催化湿式氧化过程中,物质不断被氧化,并生成新中间产物,使体系pH 值随反应的进行发生变化。 因此,实验同时考察了不同温度条件下催化湿式氧化苯并三氮唑废水过程中出水pH 值的变化情况,实验结果如图5 所示。
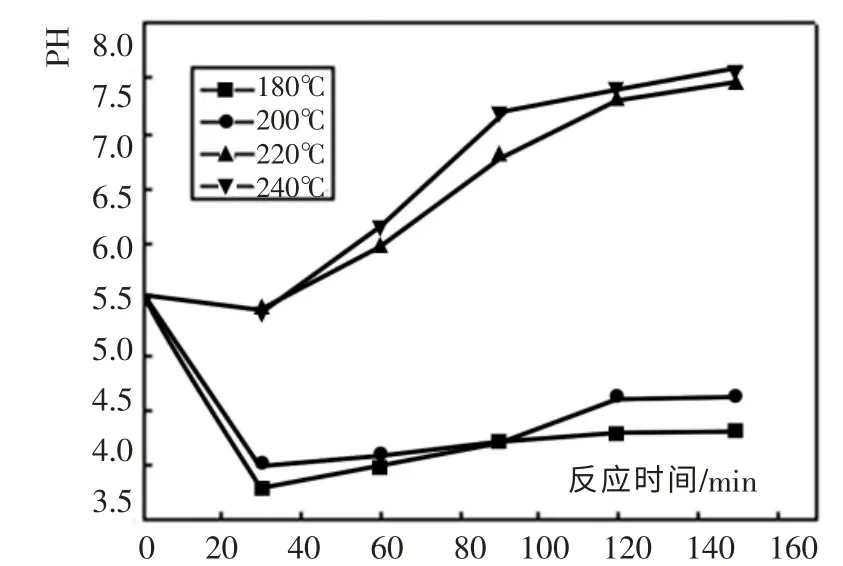
图5 反应温度对出水pH 值的影响Fig. 5 Influence of reaction temperature to out-of-water pH values
从图5 可以看出, 反应温度为180℃和200℃时, 在反应前30min 内,由于中间产物小分子羧酸生成,pH 降低。 之后随中间体的进一步氧化,pH 值又逐渐增加。 而在反应温度为200℃和220℃时,由于温度比较高,生成的羧酸很快就被氧化了,所以反应过程中的pH 值一直保持一定的增加量。可见温度对废水出水pH 值的变化影响很大,催化湿式氧化的反应温度增高,废水中有机物的深度氧化会加强,致使小分子中间产物有机酸被矿化,溶液的酸性降低,废水pH 值升高。由实验结果可知,在温度在220℃下,当反应进行120min 时,废水pH 值接近中性。因此pH 值的变化过程也能反映氧化过程的快慢程度。
2.4.3 氧气分压对CODcr 去除率的影响
在温度为220℃、 初始CODcr 浓度为21 520mg/L,pH=5.5条件下, 在氧气分压分别为1.5MPa,2MPa,2.5MPa,3MPa 作用条件下进行催化湿式氧化实验,氧气分压对催化湿式氧化效果的影响见图6。

图6 氧气分压对CODcr 去除率的影响Fig. 6 Influence of oxygen tension to CODcr removal rate
在催化湿式氧化中,提高氧气分压,主要是为了保证反应体系处于液态下,同时提高水中溶解氧的浓度,加快反应速度。 因此,提高氧气分压,显然对催化湿式氧化是有利的。但相对湿度来说, 氧气分压对CODcr 去除率的影响要小一些。 由图6 可以看出,在氧气分压从1.5MPa 上升到2.5MPa时,反应150min,CODcr 去除率由84.4%提高97.4%,但是,由2.5MPa 提高到3MPa 时,CODcr 去除率几乎没有变化。 可见此时提高氧气分压对于溶解氧浓度的提高没有多大作用,而高压对设备的要求又十分严格。 因此可以认为, 反应在2.5MPa 下进行是比较经济的。
2.4.4 废水初始pH 值对CODcr 去除率的影响
在催化氧化的反应中, 废水的pH 值对催化氧化的效果也有一定的影响。 利用NaOH 和硫酸调节原水的pH 值,在T=220℃、Po2=2.5MPa,初始CODcr浓度为21 520 mg/L,pH 值分别为1.5,5.5(原水)和10.5 条件下,考察了pH 值对催化湿式氧化效果的影响,结果见图7 所示。
从图7 可以看出,随着废水初始pH 值的升高,CODcr 去除率也升高。 在pH 值从1.5 升高到5.5 时, 反应120min,CODcr 去除率从70.3%增加到94.6%。 pH继续升高到10.5时,CODcr 去除率达到98.2%。 原因可能是:在酸性条件下,Cu2+溶出量较大, 催化剂不稳定, 因此本实验选取pH 值为10.5 的初始废水进行反应。
2.5 以间歇反应考察催化剂的稳定性
反复利用催化剂,采用间歇式反应。每次反应条件为:T=220℃,Po2=2.5Mpa,废水PH 值=10.5,反应时间120min,初始CODcr 浓度为21 520mg/L。以此测定各次反应的CODcr 去除率,考察催化剂的稳定性(实验结果如图8 所示)。
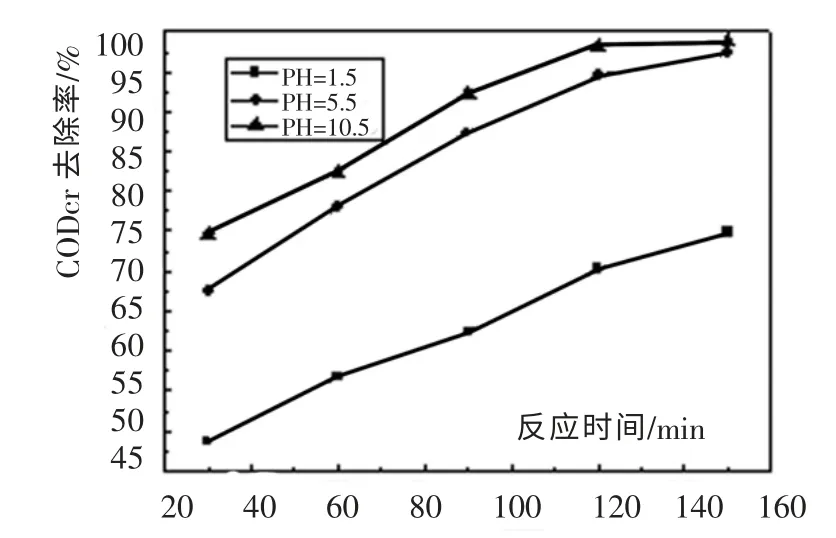
图7 废水初始pH 值对CODcr 去除率的影响Fig. 7 Influence of original waste water pH value to CODcr removal rate
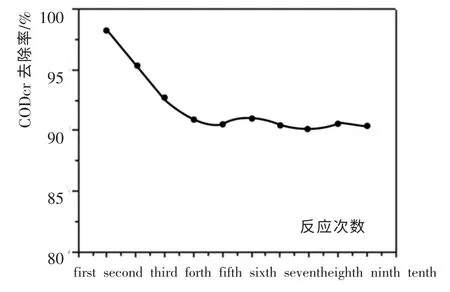
图8 催化剂使用次数与废水CODcr 去除率的关系Fig. 8 Relations of catalyst number of use and waste water CODcr removal rate
从图8 的稳定性实验可以看出, 在第一次反应时,CODcr 去除率达到98.2%。 此后, 随着反应次数的增加,CODcr 去除率逐渐下降,最终维持在90%左右。 表明采用浸渍法制备的CuO-Co3O4-MnO2/ZrO2-CeO2催化剂在处理生产苯并三氮唑过程中产生的实际高浓度废水时,具有较高的催化活性和稳定性。
3 结论
1)以过渡金属氧化物CuO 为主催化剂,通过添加第二活性组分Co3O4和碱金属助剂MnO2,制备了适合处理在生产苯并三氮唑过程中产生的实际高浓度废水的CuO-Co3O4-MnO2/ZrO2-CeO2复合负载型催化剂。
2)以该催化剂处理实际废水,得到最佳的工艺条件为:催化剂用量10g/L、 反应温度T=220℃、 氧气分压Po2=2.5MPa、废水pH=10.5、反应时间在120min 内,CODcr 去除率达到98.2%。
[1] 李润涛,陈恒昌. 苯并三氮唑在有机合成中的应用[J]. 化学试剂,1993,15(4):223-226.
[2] 高晓明,付峰,樊世科,等. 铜系催化剂湿式催化氧化处理炼油废水的研究[J]. 石油炼制与化工,2010,41(5):67-70.
[3] 袁金磊,杨学林,黄永茂. 催化湿式氧化技术处理焦化废水[J]. 水资源保护,2009,25(4),51-54.
[4] 钮娜,董学伟,董晓丽,等. 催化湿式氧化法降解活性艳蓝的研究[J]. 环境科学与技术,2010,33(12):99-101.
[5] Luck F. Wet Air Oxidation:Past,Present and Future[J].Catalysis Today,1999,53(1):81-91.
[6] Zhu Wangpeng,Bin Yuejing,Li Zhonghe, et al.Application of Catalytic Wet Oxidation for the Treatment of H-acid Manufacturing Process Wastewater [J]. Water Research,2002,36(8):1947-1954.
[7] 谭亚军,蒋展鹏,祝万鹏,等. 用于有机污染物湿式氧化铜系催化剂的稳定性研究[J].化工环保,2000,20(8):82-85.
[8] 孙德智,冯玉杰. 环境工程中的高级氧化技术[M]. 北京:化学工业出版社,2002:94-99.

