杜氏盐藻FKBP cDNA的克隆及其在鞭毛解组装中的功能*
许 芳,石 科,李 靓,张楠楠,薛乐勋
郑州大学生物工程系细胞生物学研究室郑州 450001
#通讯作者,男,1944年2月生,教授,博士研究生导师,研究方向:肿瘤标志物与基因工程,E-mail:xuelx@zzu.edu.cn
杜氏盐藻FKBP cDNA的克隆及其在鞭毛解组装中的功能*
许 芳,石 科,李 靓,张楠楠,薛乐勋#
郑州大学生物工程系细胞生物学研究室郑州 450001
#通讯作者,男,1944年2月生,教授,博士研究生导师,研究方向:肿瘤标志物与基因工程,E-mail:xuelx@zzu.edu.cn
杜氏盐藻;FK506结合蛋白;鞭毛
目的:克隆杜氏盐藻FK506结合蛋白(FKBP)的cDNA片段并探讨其与鞭毛微管解组装的联系。方法:提取杜氏盐藻总RNA,根据已知盐藻FKBP cDNA 3’端序列,用5’RACE方法扩增该cDNA的5’端序列,拼接得到全长并对其序列进行分析。秋水仙碱处理对数生长期杜氏盐藻,处理0、20、40、60、80、100、120、140和160 min后采用实时荧光定量PCR检测FKBP mRNA的表达情况。结果:经5’RACE得到681 bp的FKBP cDNA片段,拼接后得到的cDNA全长1 075 bp,序列分析显示其开放阅读框为762 bp,编码253个氨基酸;经BLAST比对,其氨基酸序列具有FKBP家族特有的功能结构域,与莱茵衣藻、团藻、小球藻、大麦及水稻的同源性分别为61%、54%、47%、48%和51%。杜氏盐藻细胞FKBP mRNA表达量在秋水仙碱处理后20~40 min明显升高,而在40~100 min时逐渐下降,但仍高于对照组(F组间=32.580,P<0.001;F时间=5.543,P=0.001;F交互=237.306,P<0.001)。结论:得到了杜氏盐藻的FKBP cDNA全长序列;FKBP参与了杜氏盐藻微管解组装过程,可能参与了细胞通过鞭毛对外界应激反应的应答。
1989年,Siekierka等[1]和Harding等[2]分别宣 布发现一种新的蛋白质,这种蛋白可以和免疫抑制剂他克莫司(FK506)结合,故将其命名为FK506结合蛋白(FK506 binding protein,FKBP)[3]。它们在原核生物与真核生物细胞中广泛存在,是一类高度同源的受体类结合蛋白,具有肽基脯氨酸顺反异构酶(peptidyl-prolyl cis-trans isomerase,PPIase)活性,可以催化多肽或蛋白质底物中的脯氨酸残基N端肽键的构象由顺式转为反式,从而影响其活性、磷酸化状态和蛋白质-蛋白质相互作用、亚细胞定位和稳定性[3]。FK506或雷帕霉素可通过与 FKBP的结合,抑制mTOR信号通路的传导,从而影响细胞蛋白质合成、细胞运动及代谢、细胞凋亡等过程[4]。鞭毛/纤毛是一种由细胞质膜延伸的细胞表面突起,纤毛的异常能影响mTOR信号通路[5-6]。关于FKBP在mTOR中的作用研究很多,而其与鞭毛/纤毛的联系还不清楚。杜氏盐藻以其无细胞壁、有一对等长的鞭毛、生长周期短、培养条件简单等独特的优势可作为研究鞭毛的有力工具[7]。作者在已获得的杜氏盐藻FKBP cDNA 3’端序列的基础上,用5’RACE方法得到杜氏盐藻中的FKBP cDNA序列,并利用实时荧光定量PCR的方法检测秋水仙碱处理后杜氏盐藻细胞FKBP mRNA的表达情况。
1 材料与方法
1.1 材料
1.1.1 藻株、菌株和载体 杜氏盐藻和大肠杆菌DH5α均为该实验室保存,pMD19-T载体购自大连宝生物工程公司(TaKaRa)。
1.1.2 工具酶、主要试剂和仪器 5’-Full RACE
试剂盒,LA Taq DNA聚合酶,EcoRⅠ、HindⅢ 等DNA限制性内切酶及IPTG均购自大连宝生物工程公司;胶回收试剂盒、质粒DNA小量制备试剂盒购自AXYGEN公司,Trizol购自Invitrogen公司,反转录试剂盒购自Fermentas公司,RealMasterMix(SYBR Green)购自天根生化科技(北京)有限公司;PCR特异性引物由上海生工生物工程有限公司合成; HPG400型光照培养箱购自哈尔滨市东联电子技术开发有限公司,紫外分光光度计为Thermo公司产品,7300实时荧光定量PCR仪购自System Applied Biosystems公司。
1.2 杜氏盐藻总RNA的提取 接种杜氏盐藻于UTEX-1644液体培养基,以26℃、光强4 500 Lux、明暗各12 h的条件培养。取对数生长期盐藻细胞,用Trizol法提取总RNA,10 g/L琼脂糖凝胶电泳及紫外分光光度计检测,计算其A(260 nm)/A(280 nm),判断RNA的完整性和纯度。产物保存于-80℃冰箱中。
1.3 杜氏盐藻FKBP cDNA 5’端序列扩增及拼接
根据已知的FKBP 3’端序列,用Primer Premier 5.0设计5’RACE巢式PCR内外侧引物,并用DNAMAN分别检测与5’RACE试剂盒中内外侧引物的互补性,以选用最合适的引物。5’RACE试剂盒自带引物序列,外侧引物:5’-CATGGCTACATGCTGA CAGCCTA-3’,内侧引物:5’-CGCGGATCCACAGC CTACTGATGATCAGTCGATG-3’。设计的FKBP引物序列,外侧引物:5’-GCTTCAAACACCTTGGACAC-3’,内侧引物:5’-CGATTGGAGCCTTAGACAGC-3’。取杜氏盐藻总RNA,按照5’-Full RACE试剂盒说明书反转录成cDNA作为5’RACE模板。巢式PCR扩增FKBP cDNA的5’端序列,PCR产物用10 g/L琼脂糖凝胶检测,回收后与 pMD19-T载体连接(pMD19-T-5’FKBP)并转化至大肠杆菌DH5α,阳性克隆扩大培养,提质粒,EcoRⅠ、HindⅢ双酶切鉴定,随机挑选3个送上海生工生物工程有限公司测序,对比所测得的序列,校正PCR过程中产生的碱基错配,测序结果与已知序列进行拼接。
1.4 秋水仙碱处理后杜氏盐藻细胞FKBP表达情况分析 用Primer Premier 5.0在所得到的FKBP cDNA片段中设计一对特异性引物,并同时设计GAPDH基因特异性引物如下。FKBP上游引物:5’-TAGTTGGCTTAGGCTTGTGG-3’,下游引物:5’-TACCTTGCATTGCAGTTTTC-3’;GAPDH上游引物: 5’-CAAGTTCTCCGCCCGATGTGA-3’,下游引物:5’-GAACACGCCTGTGCCCTCAA-3’。离心收集300 mL处于对数生长期的盐藻细胞,于2个相同的加有20 mL新培养基的50 mL三角瓶中培养,一瓶按照每1 mL藻加入1 μL秋水仙碱(189 mmol/L)的标准向其中加入20 μL秋水仙碱溶液至终浓度为0.189 μmol/L作为实验组,另一瓶未经处理的野生型藻株作为对照组。于处理20、40、60、80、100和120 min时分别取2组盐藻,离心收集后加Trizol,勿混匀,保存于-80℃冰箱,共得到14个样品。将取得的样品分别用Trizol法提取总RNA,反转录成cDNA,进行实时荧光定量PCR,以GAPDH作为内参。在进行实时荧光定量PCR之前,先通过RT-PCR确定PCR最佳反应体系和反应条件,以避免实验过程中有引物二聚体等杂带的产生。荧光PCR体系:cDNA 0.5 μL,上、下游引物各0.5 μL,2.5×RealMaster-Mix/20×SYBR solution 11.25 μL,蒸馏水12.25 μL,共25 μL。荧光PCR程序:95℃4 min;94℃30 s,54℃30 s,72℃30 s,40个循环;95℃15 s,60℃30 s,95℃15 s。反应结束之后根据2-ΔΔCT方法分析得到的数据。每个样品均重复3次。
1.5 统计学处理 运用SPSS 17.0进行数据处理,秋水仙碱处理后2组FKBP mRNA表达水平的比较采用2×6析因设计的方差分析,检验水准α=0.05。
2 结果
2.1 杜氏盐藻总RNA质量鉴定 琼脂糖凝胶电泳显示28S和18S亮度比例约为2∶1,无拖尾现象,说明RNA完整性较好,A(260 nm)/A(280 nm)介于1.8~2.0,无DNA和蛋白质污染,可用于下一步实验。
2.25’RACE结果鉴定 经5’RACE扩增后得到一条约700 bp的条带(图1),胶回收后与pMD19-T载体连接,双酶切鉴定结果见图2。经测序、校正,最终确定得到了一个681 bp的序列。与已知序列拼接后得到的FKBP cDNA全长1 075 bp,其开放阅读框762 bp,编码253个氨基酸,BLAST结果显示,推导得到的FKBP氨基酸序列具有FKBP家族所特有的结构域,且与其他物种的FKBP氨基酸序列特别是藻类的FKBP有较高的同源性,与莱茵衣藻、团藻、小球藻、大麦及水稻的同源性分别为61%、54%、47%、48%和51%。通过DNAMAN软件对该序列分析得到FKBP蛋白的相关信息,其蛋白质的相对分子质量为27 037.08,等电点为8.6。
2.3 秋水仙碱处理后杜氏盐藻细胞FKBP mRNA表达情况分析 秋水仙碱处理0~20 min,杜氏盐藻细胞FKBP mRNA表达水平无变化,只是略高于对照组;20~40 min时升高,40~100 min逐渐降低,但仍高于对照组。见表1。

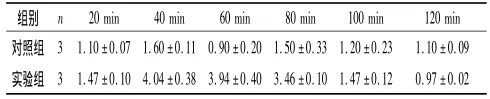
表1 秋水仙碱处理后杜氏盐藻FKBP mRNA的相对表达量
3 讨论
作者利用5’RACE方法扩增得到的杜氏盐藻FKBP cDNA全长1 075 bp,其中开放阅读框762 bp,编码253个氨基酸,DNAMAN软件分析显示,其相对分子质量为27 037.08,等电点为8.6,经BLAST比对,具有FKBP家族特有的结构域且与其他物种尤其是藻类的FKBP有很高的同源性,如莱茵衣藻、团藻、小球藻、大麦及水稻等。所以作者认为得到的确实为杜氏盐藻的FKBP序列。
FKBP蛋白广泛存在于真核及原核生物中,除了参与调节激素信号转导通路,FKBP在植株的生长、种子的萌发、非生物胁迫及其抗逆性中起到重要作用[8]。鞭毛/纤毛是一种由细胞质膜延伸的细胞表面突起,主要由微管组成[9],纤毛蛋白的突变可导致发育缺陷,如多趾畸形、视网膜变性和多囊肾等[5,10-11]。多囊肾疾病中纤毛异常弯曲对于mTOR的下调是必需的,纤毛的缺失上调使肾脏肥大的信号通路而促进了肾囊肿的形成[5-6]。秋水仙碱能阻止微管的形成,使杜氏盐藻鞭毛缩短。作者根据得到的FKBP cDNA设计引物,采用实时荧光定量PCR的方法检测杜氏盐藻细胞在秋水仙碱破坏下FKBP mRNA表达的变化。结果显示,在秋水仙碱作用20~40 min,杜氏盐藻细胞FKBP mRNA表达水平迅速升高,40~100 min时逐渐下降,但仍高于对照组,说明FKBP与鞭毛微管解组装过程有关。FKBP参与了秋水仙素处理后杜氏盐藻微管解组装的过程,可能参与了杜氏盐藻细胞通过鞭毛对外界应激反应的应答,这为进一步研究FKBP的功能提供了依据。
[1]Siekierka JJ,Staruch MJ,Hung SH,et al.FK-506,a potent novel immunosuppressive agent,binds to a cytosolic protein which is distinct from the cyclosporin A-binding protein cyclophilin[J].J Immunol,1989,143(5):1580
[2]Harding MW,Galat A,Uehling DE,et al.A receptor for the immunosuppressant FK506 is a cis-trans peptidyl-prolyl isomerase[J].Nature,1989,341(6244):758
[3]Geisler M,Bailly A.Tête-à-tête:the function of FKBPs in plant development[J].Trends Plant Sci,2007,12(10): 465
[4]陈洪菊,屈艺,母得志.mTOR信号通路的生物学功能[J].生命的化学,2010,30(4):555
[5]Bell PD,Fitzgibbon W,Sas K,et al.Loss of primary cilia upregulates renal hypertrophic signaling and promotes cystogenesis[J].J Am Soc Nephrol,2011,22(5):839
[6]Boehlke C,Kotsis F,Patel V,et al.Primary cilia regulate mTORC1 activity and cell size through Lkb1[J].Nat Cell Biol,2010,12(11):1115
[7]柳丽萍,李杰,王翠,等.杜氏盐藻cDNA文库的构建及KCBP基因的克隆[J].郑州大学学报:医学版,2010,45(6):907
[8]Nigam N,Singh A,Sahi C,et al.SUMO-conjugating enzyme(Sce)and FK506-binding protein(FKBP)encoding rice(Oryza sativa L.)genes:genome-wide analysis,expression studies and evidence for their involvement in abiotic stress response[J].Mol Genet Genomics,2008,279 (4):371
[9]王翠,李杰,柳丽平,等.杜氏盐藻寡糖基转移酶亚基STT3a功能结构域的克隆与表达分析[J].生物工程学报,2010,26(6):760
[10]Boletta A.Emerging evidence of a link between the polycystins and the mTOR pathways[J].Pathogenetics,2009,2(1):6
[11]Cang BK,Hong Y,Dhe-Paganon S,et al.FKBP family proteins:immunophilins with versatile biological functions[J].Neurosignals,2008,16(4):318
Cloning of FKBP cDNA from Dunaliella salina and analysis of its functions in flagellar disassembly
XU Fang,SHI Ke,LI Liang,ZHANG Nannan,XUE LexunLaboratory for Cell Biology,Department of Bioengineering,Zhengzhou University,Zhengzhou 450001
Dunaliella salina;FK506 binding protein;flagella
Aim:To clone the cDNA fragment of FK506 binding protein(FKBP)from Dunaliella salina(D.salina) and to investigate its function in the process of microtubule disassembly in flagella.Methods:The total RNA was extracted from D.salina and the full length of FKBP cDNA was amplified by 5’RACE method according to the known 3’terminal sequence.The expression of FKBP mRNA in D.salina treated with colchicine for 0,20,40,60,80,100,120,140 and 160 min,was detected by real-time fluorescence quantitative PCR.Results:A 681 bp DNA fragment was obtained by 5’RACE.The full length of FKBP cDNA was 1 075 bp long and contained an open reading frame of 762 bp which encodes 253 amino acids.Sequence analysis showed that it had the conserved domain of FKBP family and was homologous with Chlamydomonas reinhardtii(61%),Volvox carteri f.nagariensis(54%),Chlorella variabilis(47%),Hordeum vulgare subsp.Vulgare (48%)and Oryza sativa Indica Group(51%).The expression of FKBP mRNA in D.salina 20~40 min after colchicine treatment significantly increased,and decreased gradually within 40~100 min after colchicine treatment,but still higher than the control(Fgroup=32.580,P<0.001;Ftime=5.543,P=0.001;Finteraction=237.306,P<0.001).Conclusion:The FKBP cDNA sequence of D.salina has been obtained successfully.The expression of FKBP has correlation with the process of microtubule disassembly in D.salina,and it may be involved in the response of the cells to external stress through the flagella.
Q781
*国家自然科学基金资助项目 30700014;科技部国际科技合作基金资助项目 2007DFA01240
(2011-05-17收稿 责任编辑王 曼)