锑电极电位溶出法测定锌、镉、铅
魏小平 梁青梅 李建平
(桂林理工大学 化学与生物工程学院,广西 桂林541004)
1 前言
重金属元素在环境中普遍存在并可长期蓄积,是不可降解的环境污染物,常危害人体健康,建立快速准确的测定方法具有实际意义。电位溶出法由于仪器简单、灵敏度高、选择性好、分析成本低等优点而成为痕量元素尤其是重金属离子测定的推荐方法之一[1-3]。通常电位溶出分析中所使用的电极主要是汞膜电极,汞(包括金属汞和汞离子)有毒,经常使用易污染环境,对操作人员健康有害。因此,许多人正在研究新电极来代替汞膜电极,如贵金属电极[4]、铋膜电极[5-6]、碳糊电极[7]和固体汞合金电极[8]等。
Tesarova等[9-10]在碳糊电极上电解法制备了锑膜碳糊电极,结合方波阳极溶出伏安法测定Cd2+、Pd2+离子。目前,金属锑电极用于测定重金属的研究相对较少[11]。Zn2+、Cd2+、Pd2+离子在锑电极上可得到灵敏的电位溶出峰,并提出锑电极电位溶出法同时测定锌、镉和铅的方法,考察了方法的测定体系和最佳实验条件,并用于水样的测定,具有灵敏、分辨率好、简便快捷等特性。
2 实验部分
2.1 仪器和试剂
CHI660B电化学工作站(上海辰华仪器公司);MP-1型溶出分析仪(山东电讯七厂);三电极系统:锑电极作为工作电极,甘汞电极作为参比电极,铂丝电极作为对电极。
Pb2+、Cd2+、Zn2+标准溶液,按常规方法配制;醋酸-醋酸钠缓冲溶液(pH=5.0);所用试剂均为分析纯,实验用水为二次蒸馏水。
2.2 实验方法
在10mL的比色管中分别加入一定量的Pb2+、Cd2+、Zn2+标准溶液,再加入4mL HAc-NaAc缓冲溶液,用蒸馏水稀释至刻度,摇匀。转移至15mL的小烧杯中,于CHI660B电化学工作站或MP-1型溶出分析仪上选择电位溶出分析法进行测定。实验根据待测离子浓度选择合适的沉积时间,以溶解氧作为氧化剂,于-1.2~-0.3V电位间扫描,记录电位溶出曲线t-E 或dt/dE-E。实验结束后,将电极置于-0.1V洗电极30min,即可用于下次测定。
3 结果与讨论
3.1 锌、镉和铅在锑电极上的电位溶出峰()
在 HAc-NaAcpH=5.0的缓冲液中,加入锌、镉和铅标准溶液后,按实验方法进行实验,选择沉积电位为-1.2V,沉积时间为60s,溶出电流0A。电位溶出曲线及微分电位溶出曲线分别如图1和图2所示。在-1.07、-0.70、-0.52V 处分别出现灵敏的微分电位溶出峰,且三者的溶出电位相差较大,因此,可同时进行锌、镉和铅的测定。
3.2 氧化剂的选择
在氮气除氧后的溶液中分别加高锰酸钾、硝酸、Cr2O72-作氧化剂和溶解氧做氧化剂进行试验,发现Pb2+、Cd2+和Zn2+在以溶解氧作为氧化剂的情况下电位溶出峰最好,而且溶解氧对测定离子的溶出影响最小。
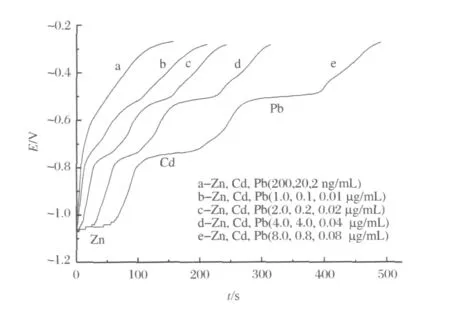
图1 电位溶出曲线Figure 1.Potentiometric stripping curves.
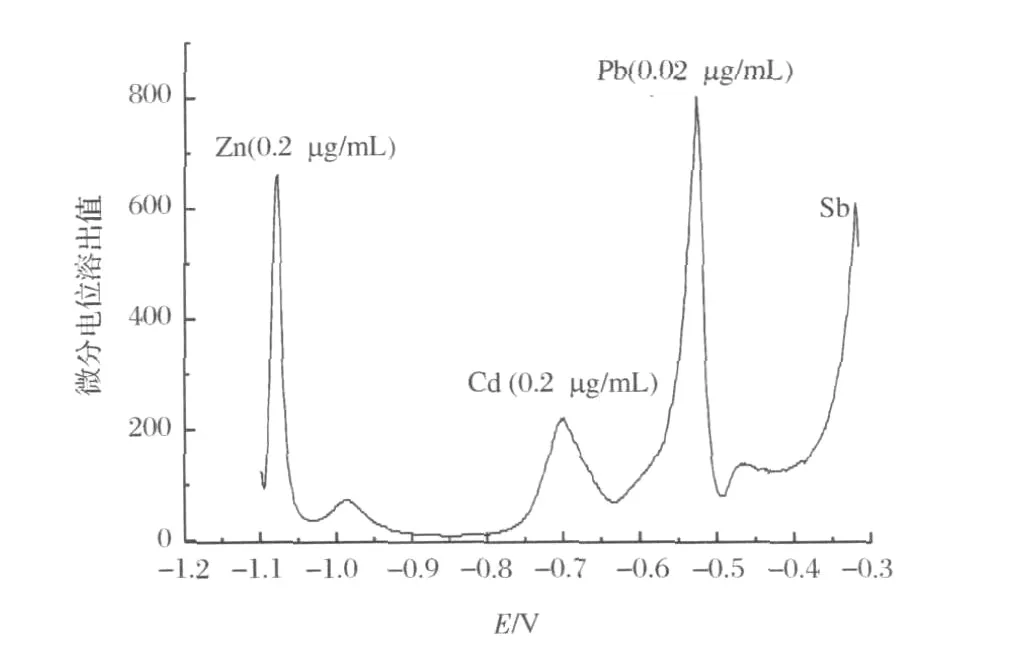
图2 微分电位溶出曲线Figure 2.Differential potentiometric stripping curves.
3.3 底液的选择及优化
Pb2+、Cd2+和Zn2+在 HAc-NaAc(0.2mol/L)和盐酸(0.01mol/L)底液中都能得到灵敏且峰形良好的微分电位溶出峰,考虑到HAc-NaAc缓冲液峰型更好,选择用HAc-NaAc缓冲液做底液,对该缓冲液的pH值影响进行实验。测量结果表明(图3),对于 Zn2+(2.0μg/mL)、Cd2+(0.5μg/mL)、Pb2+(0.02μg/mL),在pH=5.0时 Pb2+、Cd2+和Zn2+溶出最好。因此,选择pH=5.0的HAc-NaAc缓冲溶液。
分别在不同用量的HAc-NaAc情况下,记录峰高。结果表明(图4),对于Zn2+(2.0μg/mL)、Cd2+(0.5μg/mL)、Pb2+(0.02μg/mL),沉积时间60s,在 HAc-NaAc用量为4mL时,Pb2+、Cd2+和Zn2+峰值最大。故选择pH=5.0的HAc-NaAc缓冲溶液用量为4mL。
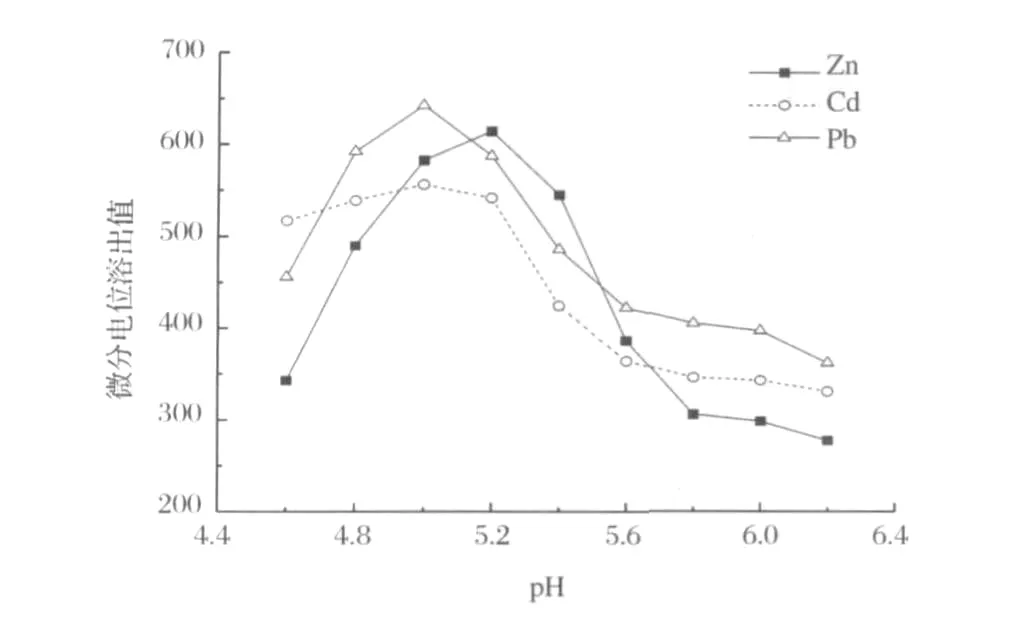
图3 pH值对峰高的影响Figure 3.Effects of solution pH values on peak heights.
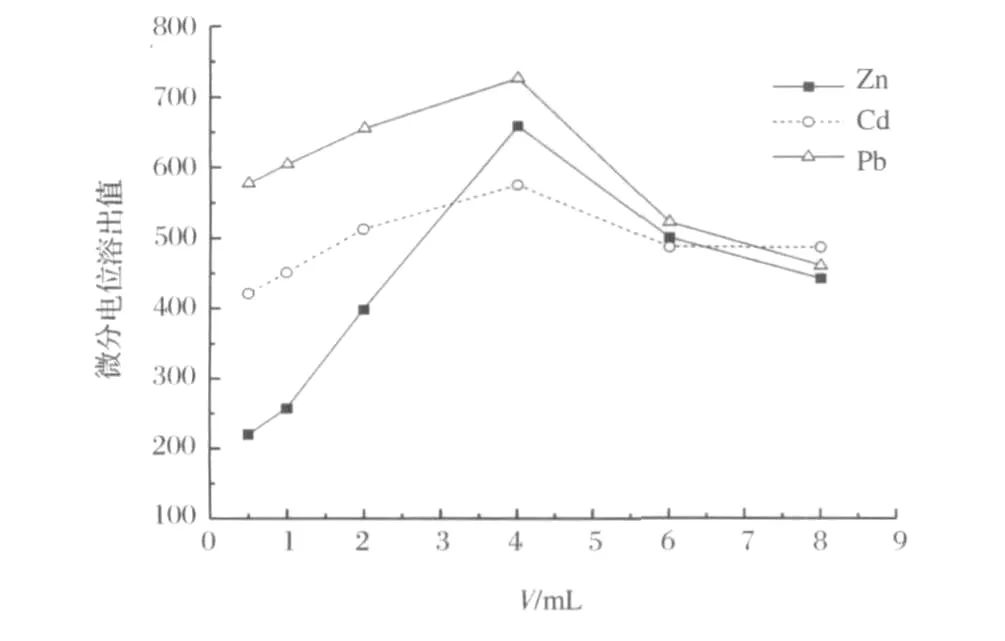
图4 HAc-NaAc用量的影响Figure 4.Effects of the amount of HAc-NaAc buffer on peak heights.
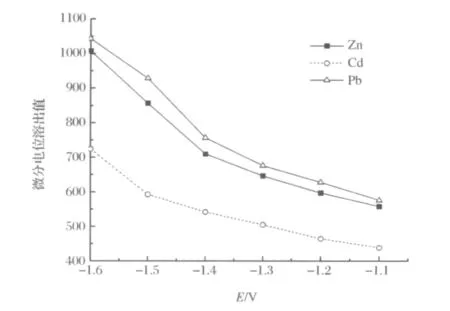
图5 富集电位对铅、镉和锌的影响Figure 5.Effects of the accumulation potential on peak height(dt/dE)for Pb,Cd and Zn.
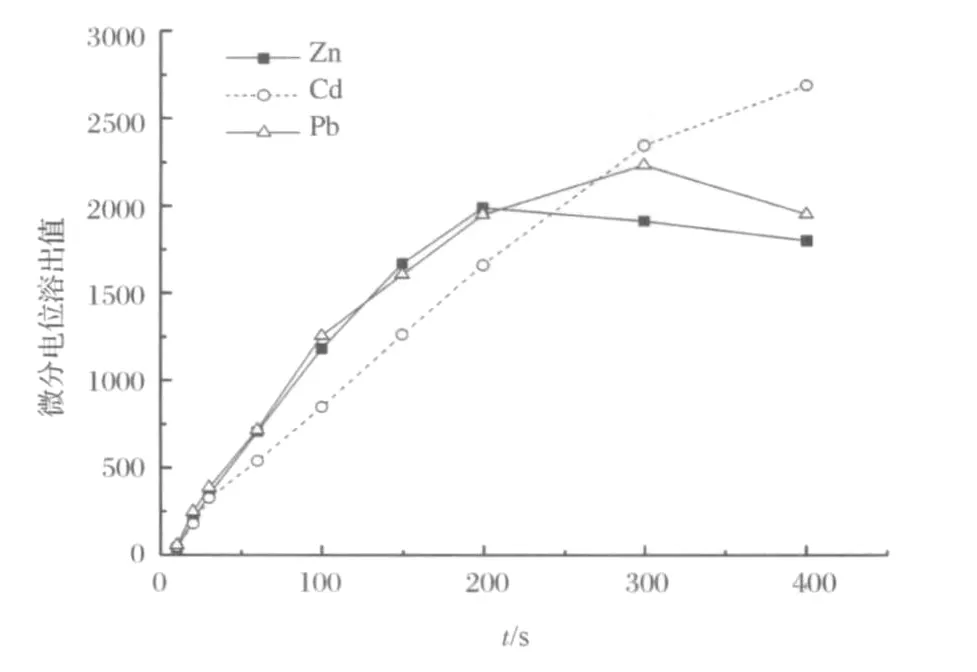
图6 电沉积时间的影响Figure 6.Effects of deposition time on peak heights for Pb,Cd and Zn.
3.4 富集电位的影响
分别在不同富集电位下电沉积富集60s,分别记录Zn2+(2.0μg/mL)、Cd2+(0.5μg/mL)和Pb2+(0.02μg/mL)的微分电位溶出峰高(dt/dE)。结果表明,随着富集电位的负移,溶出峰的峰高逐渐增大(图5),为了避免电位太负导致其它离子同时沉积产生干扰,选择电沉积电位为-1.2V。
3.5 电沉积时间的影响
在快速搅拌下电沉积不同时间,在0~200s内,Zn2+(2.0μg/mL)、Cd2+(0.5μg/mL)和 Pb2+(0.02μg/mL)的微分电位溶出峰高与电沉积时间基本呈线性关系(图6)。实际测定中,应根据待测离子的浓度大小来选择合适的电沉积时间。为方便计算,实验选择电沉积时间为60s。
3.6 工作曲线、检出限
在最佳实验条件下,富集时间为60s时,锌、镉、铅的质量浓度各自在0~16.0、0~1.6、0~0.08μg/mL范围内分别与微分电位溶出峰高呈线性关系,线性方程分别为:dt/dE=299.52CZn-121.96,R2=0.9984;dt/dE=1330.7CCd-14.78,R2=0.9971;dt/dE=36887CPb-14.60,R2=0.9974。电沉积时间为120s时,分别对空白溶液进行11次测定,计算标准偏差S,用3S/K计算出锌、镉和铅检测限分别为:4.0、0.3和0.03μg/L。
3.7 干扰离子的影响
在质量浓度分别为2.0、0.5、0.02μg/mL 的锌、镉、铅溶液中分别加入干扰离子进行测定,给定误差±10%,下列物质存在时对上述3种离子的测定均不干扰(括号内为倍数)。详见表1。
4 分析应用
取5mL的澄清水样于25mL的具塞比色管中,加入 NaOH(0.2mol/L)调节至中性。加入4mL HAc-NaAc缓冲溶液,定容至10mL,摇匀。按实验方法进行测定,结果见表2。
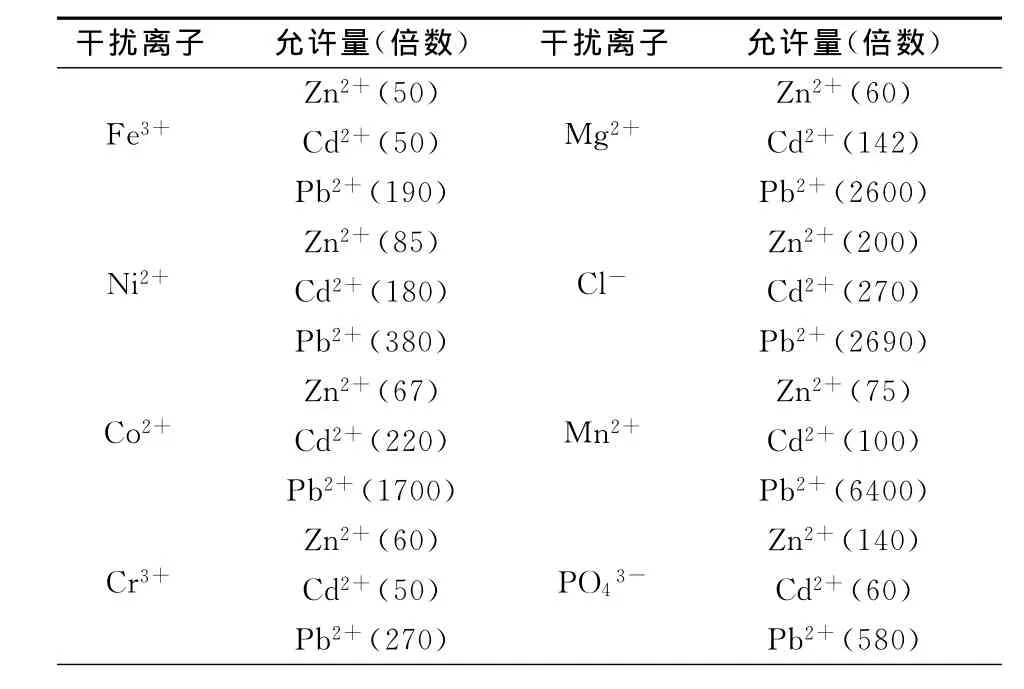
表1 测定铅、镉、锌时干扰离子允许量Table 1 Determination of permitted amount of interference ions on lead,cadmium and zinc determinations
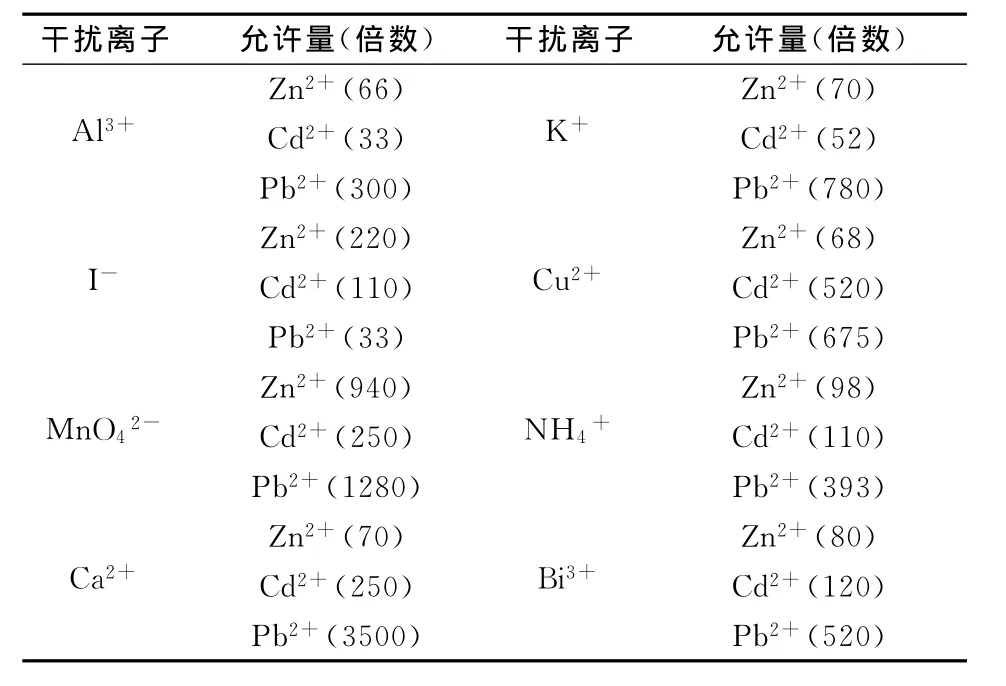
续表1
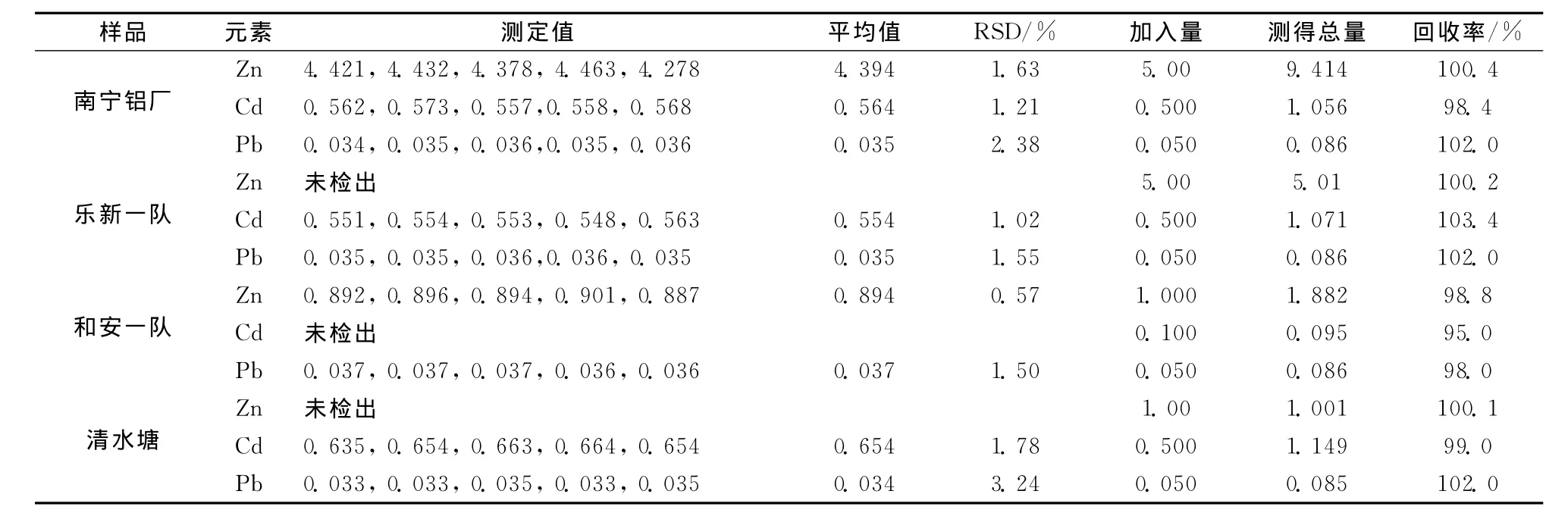
表2 水样分析结果Table 2 Analytical results of the water samples μg/mL
从表2中可见,样品测定值与参考值基本吻合。回收率在95.0%~103.4%之间。因此,方法用于测定环境样品中痕量重金属离子浓度有非常高的实用价值,灵敏、绿色环保,适合推广使用。
5 结语
建立了锑电极电位溶出法同时测定锌、镉和铅的方法。方法灵敏度高、选择性好、仪器简单、简便快捷,可以替代有毒的汞电极。用于环境样品中痕量重金属离子浓度的测定,结果理想。电极绿色环保,适合推广使用。
[1]A Economou.Recent developments in on-line electrochemical stripping analysis-An overview of the last 12 years[J].Anal.Chim.Acta,2010,683(1):38-51.
[2]中华人民共和国卫生部.中华人民共和国卫生行业标准a.WS/T21-1996;b.WS/T33-1996;c.WS/T19-1996[S].北京:中国标准出版社,1996.
[3]邓勃.印迹技术在痕量金属分离和富集中的应用进展[J].中国无机分析化学,2011,1(1):1-6.
[4]Jianping Li,Tuzhi Peng.Response to high acidity and basicity at a platinum electrode by chronopotentialmetry[J].Anal.Chim.Acta,2003,478(2):337-344.
[5]李建平,彭图治,张雪君.铋膜电极电位溶出法测定痕量铅、镉、锌[J].分析化学,2002,30(9):1092-1095.
[6]Wang J.Stripping analysis at bismuth electrodes:a review[J].Electroanalysis,2005,17(15-16):1341-1346.
[7]Gadhari N S,Sanghavi B J,Karna S P,et al.Potentiometric stripping analysis of bismuth based on carbon paste electrode modified with cryptand and multiwalled carbon nanotubes[J].Electrochim.Acta,2010,56(2):627-635.
[8]李建平,陆继勇.固体汞合金电极电位溶出法同时测定痕量锌、镉、铅[J].应用化学,2006,23(9):1006-1009.
[9]Tesarova E,Baldrianova L,Hocevar S B,et al.Anodic stripping voltammetric measurement of trace heavy metals at antimony film carbon paste electrode[J].Electro-chim.Acta,2009,54(5):1506-1510.
[10]Tesarova E,Baldrianova L,Stoces M,et al.Antimony powder-modified carbon paste electrodes for electrochemical stripping determination of trace heavy metals[J].Electrochim.Acta,2011,56(19):6673-6677.
[11]Tesarova E,Vytras K.Potentiometric stripping analysis at antimony film electrodes[J].Electroanalysis,2009,21(9):
1075-1080.

