草莓褐色轮斑病病原鉴定及室内药效研究*
吴金平, 郑芳圆
(1.湖北省农业科学院经济作物研究所,武汉 430064; 2.华中农业大学植物科技学院,武汉 430070)
草莓(Fr agaria ananassa)属浆果类果树,具有较高的经济价值和食用价值。近年来,随着我国农业产业结构的调整,草莓种植业迅速发展,草莓病害也越来越严重,其中最严重的是炭疽病、白粉病和灰霉病这三大病害。但笔者通过对湖北省宜都、沙市等草莓育苗基地调查,发现草莓在新叶时期、或叶片湿度大,或整株淹没灌溉和潮湿多雨期,草莓褐色轮斑 病 (Pho mopsis leaf blight)[1]感 病 田 发 病 率 一般为10%~30%,严重时发病率可达80%~100%;且其侵染叶柄和匍匐茎时,产生紫黑色病斑,椭圆形稍凹陷[2]。草莓褐色轮斑病的发生和危害,极大地影响了草莓的种苗质量。笔者通过对该病菌的形态、生物学特性和病菌的ITS序列分析,确定其种属地位,并筛选了一些有效药剂,为其防治提供理论依据。
1 材料和方法
1.1 供试菌株
用组织分离法[3]从湖北省宜都、沙市等草莓基地草莓叶片、匍匐茎上分离、纯化、保存病菌。
1.2 病原菌形态观察和离体回接鉴定
将病菌菌块先置于马铃薯蔗糖培养基(potato-sugar-agar,PSA)[3]平板中央,28 ℃、黑暗培养3 d后,观察菌落颜色和形态;并用无菌水洗下培养菌落中的分生孢子,在显微镜(XDS-500倒置显微镜)下观察其形态。
选取健康的草莓叶片,用自来水冲洗干净后,用75%乙醇棉球轻擦表面,用保鲜膜包裹叶柄。在无菌操作台上用镊子轻刮叶片表面,使其形成微创伤,然后用无菌打孔器打取5 mm菌饼放在创伤处。以不接病菌的草莓叶片为对照。整个瓷盘底部放置灭菌的报纸,并用无菌水打湿,将处理好的叶片放在瓷盘中,用保鲜膜包裹瓷盘。3次重复,每天观察并记录是否发病。
1.3 菌丝生长的最适温度和pH
将直径为5 mm的菌苔移到PSA平板中央,分别置5、10、15、20、25、28、30、35℃的恒温条件下培养,3 d后测量菌落直径。设pH4~11共9个梯度,接菌块于PSA平板中央。平板置于28℃条件下培养3 d,然后测量菌落直径。3次重复。
1.4 营养成分对菌丝生长的影响
基础培养基采用査彼(Czapek)培养基:硝酸钠2 g、氯化钾0.5 g、硫酸亚铁0.01 g、磷酸氢二钾1.0 g、硫酸镁0.5 g、蔗糖30 g、琼脂17 g。碳源用葡萄糖、D-果糖、乳糖、甘露醇、麦芽糖和可溶性淀粉替代基础培养基中的碳源;氮源用甘氨酸、酵母浸出液、硫酸铵、硝酸钾、蛋白胨、磷酸二氢铵、硝酸铵和L-谷氨酸钠替代基础培养基中的氮源。28℃条件下接菌培养3 d后测量菌落直径。3次重复。
1.5 核糖体基因转录间隔区ITS的PCR扩增和系统发育树构建
将病原菌菌块移至PSA平板上,28℃黑暗条件下培养48~72 h,然后将菌落边缘的菌丝切成2~3 mm的菌落小块,把4~5块菌丝块移至PSA液体培养基,28℃、120 r/min振荡培养3~4 d。将液体培养好的病菌菌丝,在双层尼龙网上过滤,用水洗涤2次,以除去菌丝内的培养液,收集菌丝,将其包好放在硅胶中过夜,吸干水分,用液氮研磨成粉末,参照刘少华等[4]报道的尿素法提取病菌菌丝DNA。病原菌r DNA的ITS区域PCR扩增选用的引物分别为ITS1和ITS4,其碱基序列如下[5]:ITS1(5′-TCCGTAGGTGAACCTGCGG-3′),ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)。PCR 反应体系:10 mmol/L的三磷酸碱基脱氧核苷酸2μL,20 mmol/L的氯化镁2μL,缓冲液2.5μL,加10μmol/L的引物ITS1和ITS4各0.5μL,2 U/μL的Taq酶1μL,模板0.5μL,使用超纯水将反应体系补至25μL。PCR反应条件:95℃预变性3 min;95℃30 s,57℃退火1 min,72℃延伸2 min,循环35次;72℃延伸10 min。PCR产物以1%的琼脂糖凝胶电泳鉴定,检测到600 bp左右的条带,将PCR扩增产物回收,回收片段与克隆载体p GEM-T连接,然后转化至大肠杆菌DH-5α感受态细胞,进行蓝白斑筛选,选取阳性菌落扩大培养后,部分菌液用M13(F/R:GTAAAACGACGGCCAG/CAGGAAACAGCTATGAC)进行PCR扩增,凝胶电泳检测,并将检测后确认含有目的片段的阳性克隆送到华大基因测序公司测序。
将测得的基因序列在Gen Bank(http:∥www.ncbi.nl m.nih.gov/)中进行blast比较,ITS序列同源性较高的登记菌株作为参比菌株。用CLUSTALX 1.8软件对相似的序列进行多序列比对,由MEGA 4.0软件采用邻接法(neighbor-joining)进行系统发育树构建和聚类分析,确定菌株在微生物系统发育学上的地位。
1.6 药剂抑菌试验
供试药剂:80%代森锰锌可湿性粉剂(利民化工有限责任公司);80%炭疽福美可湿性粉剂(成都双益化工有限公司);50%甲基硫菌灵可湿性粉剂(陕西蒲城县美邦农药有限责任公司);70%锰锌·百菌清可湿性粉剂(利民化工有限责任公司);64%恶霜·锰锌可湿性粉剂(先正达(苏州)作物保护有限公司);72%甲霜·锰锌可湿性粉剂(成都市金堂福田农药有限公司);90%链土霉素可湿性粉剂(山东恒利达化学品公司);12%松脂酸铜水乳剂(北京中农博雅科技发展有限公司);50%咪鲜胺乳油(江门市大光明农化有限公司)。各药剂浓度根据厂家说明书的建议调节:代森锰锌、甲基硫菌灵和松脂酸铜稀释1 500倍;锰锌·百菌清、恶霜·锰锌、甲霜·锰锌、链土霉素和咪鲜胺稀释1 000倍;炭疽福美稀释500倍作为标准浓度。
采用菌丝生长速率法[6]测定药剂的抑菌作用,并设清水对照,28℃恒温培养3 d,用十字交叉法测量菌落直径,计算抑菌带宽度。每处理重复4次。
净生长量=菌落直径-菌饼直径,抑菌带宽度=CK净生长量-处理净生长量。
2 结果和分析
2.1 病原菌形态和回接鉴定
病原菌在PSA培养基上生长速度较快,菌落近圆形,乳白色,气生菌丝不发达(图1a)。28℃下培养3 d后在显微镜下观察分生孢子。α型分生孢子,单胞,(5.5~7.0)μm×(2.0~3.5)μm(图1b)。病菌接种后第2天,叶片出现病斑,随后病斑逐渐扩大;第5天,叶片出现典型的病症,病斑近圆形或不规则形,褐色,上有轮纹。
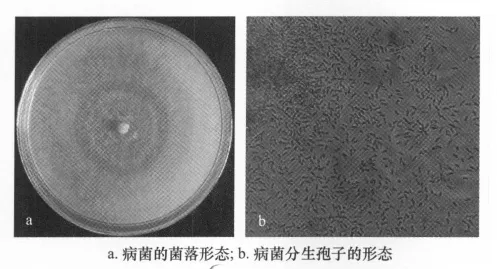
图1 草莓褐色轮斑病病原菌培养形态
2.2 菌丝生长的最适温度和p H
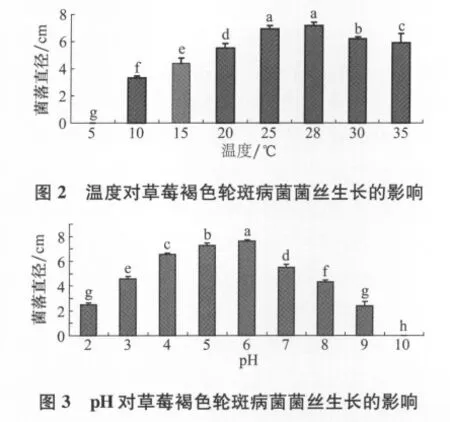
图2表明,菌丝生长的适宜温度范围是25~30℃,最适温度为25~28℃,在25~28℃之间菌落生长无显著差异,3 d后菌落直径达到7.18 c m。图4表明,菌丝生长的适宜p H范围是4~6,最适p H为6,在p H 2和p H 9过酸过碱条件下菌落生长无显著差异。
2.3 营养成分对菌丝生长的影响
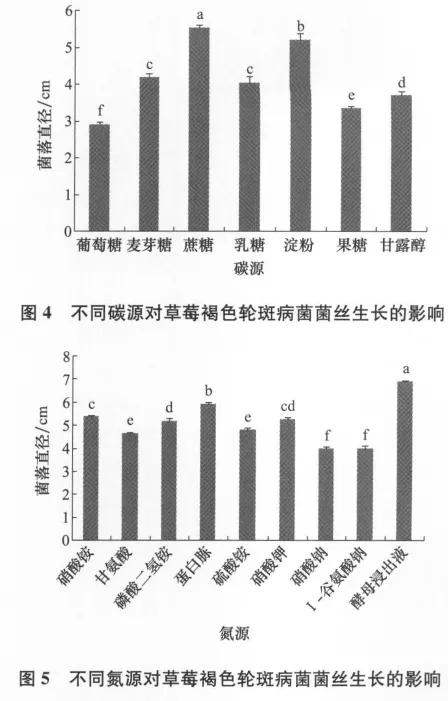
从图4可以看出,病菌对碳源的利用率高低为蔗糖>可溶性淀粉>麦芽糖>乳糖>甘露醇>果糖>葡萄糖,其中麦芽糖和乳糖作为碳源菌落生长无显著差异。从图5可以看出,病菌对氮源的利用率高低为酵母浸出液>蛋白胨>硝酸铵>硝酸钾>磷酸二氢铵>硫酸铵>甘氨酸>硝酸钠>L-谷氨酸钠,其中甘氨酸和硫酸铵、硝酸钠和L-谷氨酸钠菌落生长无显著差异。
2.4 核糖体基因转录间隔区ITS的PCR序列与Gen Bank数据库比较分析
把所得的病菌序列提交至GenBank数据库(GenBank 中 的 序 列 号:HM 854852.1,HM 854851.1,H M 854850.1),利用Blast工具与Gen-Bank数据库中已知微生物的ITS序列进行同源性比对。从图6可看出,分离获得的3个菌株与Sphaeronaemella f ragariae和Phomopsis obscurans聚为一群,但和Sphaeronaemell a f r agariae的遗传图距近一些。
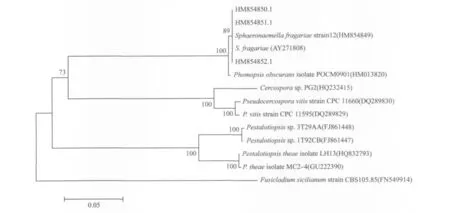
图6 草莓褐色轮斑病菌ITS序列构建的系统发育树
2.5 不同杀菌剂的室内抑菌作用
代森锰锌、锰锌·百菌清、恶霜·锰锌这3种农药对褐色轮斑病没有任何防效。在标准浓度条件下,笔者对几种有效药剂进行了方差分析,从表1结果可以看出整体防效:咪鲜胺>松脂酸铜>甲基硫菌灵>链土霉素>甲霜灵·锰锌>炭疽福美。
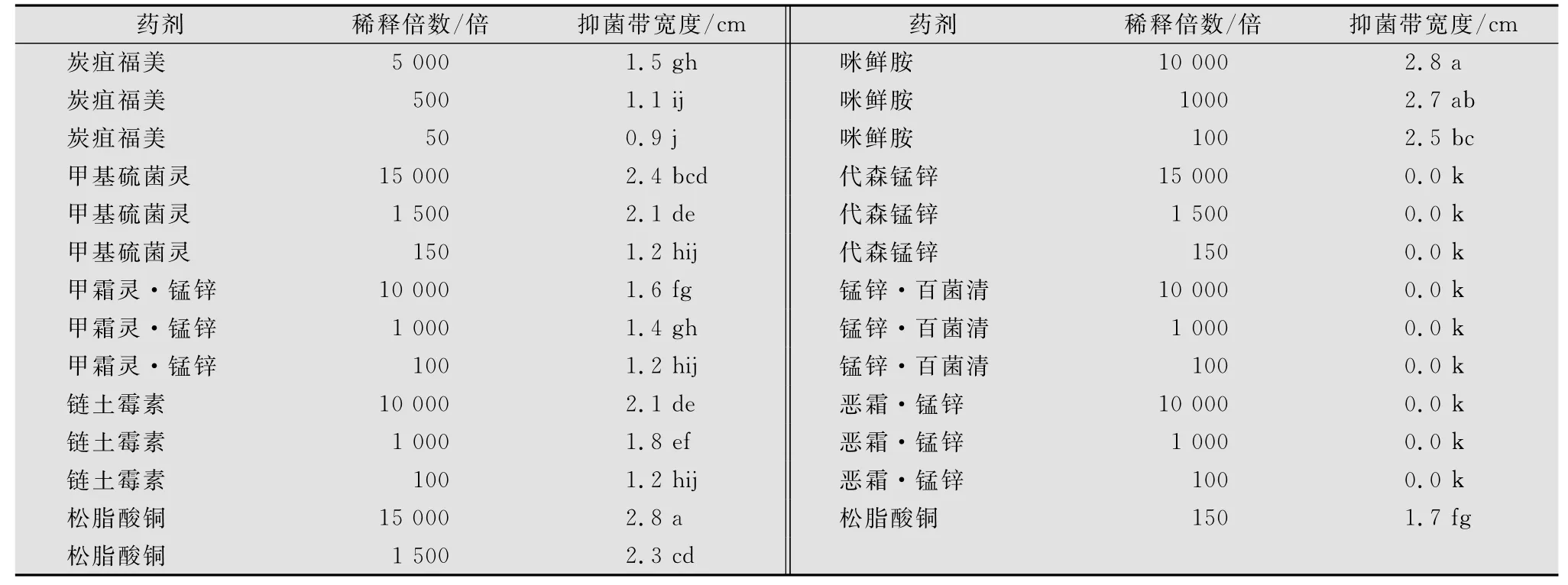
表1 不同杀菌剂对草莓褐色轮斑病的室内抑菌作用1)
3 小结与讨论
目前,国内外还未见用ITS序列研究草莓褐色轮斑病病原的报道。一般都是通过形态学进行鉴定,如Halstead于1893年鉴定为Aposphaeria属[7];1895年,Ellis及 Ever hart将其病原确定为Phoma obscur ans[8];1920年,Anderson重新命名病原为Dendrophoma obscurans[9];1972年,Howard等再次确认该病原菌为 D.obscurans[10];2000年,我国陆家云确定其病原菌为半知菌类、腔孢纲、球壳孢目、球壳孢科、拟茎点霉属的暗拟茎点霉Phomopsis(Dendr ophoma)obscur ans (Ell et EV.)[11];2005年,贾晓辉通过生物学特性鉴定沈阳地区草莓褐色轮斑病的病原为Phomopsis obscur ans(Ell et EV.)[6]。由于病菌的形态受培养环境等因素影响,本研究在结合形态学、生物学特性研究的基础上,首次对该病原菌的ITS进行研究,并将其上传Gen-Bank与其他菌聚类分析,从系统发育树可以看出本研究分离获得的病菌序列与Sphaeronaemell a f r agariae和Phomopsis obscur ans序列属于同一分支。而2000年Ellis[12]等在研究由Phomopsis引起的草莓腐烂病时,在观察分生孢子形态过程中,提出了P.obscur ans与S.f r agariae可能是同一病菌的质疑,2004年 Hausner[13]等利用小亚基核糖体RNA(the nuclear s mall subunit riboso mal RNA)从分子角度论证了P.obscur ans与S.f r agaria e是同一病菌。而本研究通过病菌的ITS序列构建的的系统发育树分析,获得的草莓褐色轮斑病病菌为S.f r agariae,此结果与Hausner等的研究结果一致。
经生物学特性研究表明,该病菌菌丝生长的最适温度为25~28℃,最适p H是6,最适碳源是蔗糖,最适氮源是酵母浸出液。因此,在不影响草莓生长的情况下,通过适当调节环境的温、湿度或者p H,对病情可能起到一定的控制作用。
通过室内药剂试验证明,松脂酸铜和咪鲜胺对病菌菌丝生长有明显抑制作用,而在露地及温室内实际生产中,这两种药剂是否是最有效药剂,还有待于进一步证实。
[1] Michael A E,Mizuho N.Pho mopsis leaf blight and fr uit rot of strawberr y[EB/OL].Ohio State University Extension Fact Sheet HYG-3211-02,2003.http:∥ohioline.osu.edu/hygfact/3000/3211.ht ml.
[2] 相建业,张管曲,谢芳芹,等.草莓病虫害识别与无公害防治[M].北京:中国农业出版社,2007.
[3] 方中达.植物病理研究方法[M].北京:中国农业出版社,1979.
[4] 刘少华,陆金萍,朱瑞良,等.一种快速简便的植物病原真菌基因组DNA 提取方法[J].植物病理学报,2005,35(4):362-365.
[5] 任小杰,梁艳,陆金萍,等.上海地区草莓炭疽病病原鉴定[J].植物病理学报,2008,38(3):325-328.
[6] 贾晓辉,傅俊范,周如军,等.草莓褐色轮斑病病原生物学研究及防治药剂的筛选[J].安徽农业科学,2005,33(10):1849-1850.
[7] Halstesd B D.Disease of t he strawberr y[J].N J Agr Exp Sta Rep,1893,14:327-332.
[8] Ellis J B,Ever hart B M.New species of f ungi fr o m various localities[J].Proceedings of the Academy Natural Science Philadel phia,1895(5):413-441.
[9] Anderson H W.Dendr opho ma leaf blight of strawberr y[J].Agr Exp Sta Bull,1920,229:127-136.
[10]Howard C M.Albregts E E.A strawberry fr uit rot caused by Dendrophoma obscur ans [J].Phytopathology,1972,63:419-421.
[11]陆家云.植物病原真菌学[M].北京:中国农业出版社,2000.
[12]Ellis M A,Nita M,Madden L V.First report of Phomopsis fr uit rot of strawberr y in Ohio[J].Plant Dis,2000,84:199.
[13]Geor g Hausner,Ja mes Reid.The nuclear s mall subunit ribosomal genes of Sphaer onaemell a hel vell ae,Sphaeronaemell a f i micol a,Gabar naudia betae,and Cor nuvesica f alcata:phylogenetic i mplications[J].Can J Bot,2004,82:752-762.

