Cry1Ac杀虫蛋白对甜菜夜蛾飞行能力的影响
江幸福, 陈 建, 罗礼智, 张 蕾
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
转Bt基因作物以其高效表达对害虫有致死作用的杀虫蛋白、提高作物产量以及不污染环境等优点已被越来越多的国家批准种植,种植面积逐年增加[1]。然而,随着转Bt作物种植面积的扩大以及种植时间的延长,一些弊端也逐渐显现出来,最为突出的问题是作物中有杀虫活性的Bt蛋白的表达不稳定以及害虫对Bt杀虫蛋白产生抗性[2-3]。同一植株,不同的生长发育阶段,不同的组织器官中表达的杀虫蛋白水平差异明显[4-6],较低表达水平的杀虫蛋白不能有效地毒杀害虫。同时,随着转Bt作物对害虫选择压的提高以及害虫的不断进化,害虫对Bt杀虫蛋白的抗性也逐渐显现出来[7-10]。为延缓害虫对Bt杀虫蛋白产生抗性,科学家在明确害虫对Bt杀虫蛋白抗性机制的基础上,通过多种方法和手段防止害虫对Bt杀虫蛋白的抗性。包括“高剂量/庇护所策略”、多基因聚合策略以及特异性表达等,以减少产生耐受昆虫种群的环境选择压,抑制耐受性昆虫种群抗性的发展。其中,“高剂量/庇护所策略”能够有效保持一定比例非抗性的等位基因,通过与携带抗性基因的异性交配,稀释抗性基因频率,从而延缓耐受高剂量毒素昆虫的产生。美国、加拿大、西班牙法定种植一定面积的非转Bt作物以及我国小农种植模式提供的天然庇护所均取得了很好的效果[11-13]。然而这种抗性治理策略的前提是要保证取食Bt杀虫蛋白后存活并羽化的成虫有足够的飞行能力,确保其能够成功飞离转Bt作物的“陷阱”而与庇护所作物上的敏感种群交配、繁衍杂合子的敏感种群。如果取食一定剂量Bt杀虫蛋白后羽化的成虫不能成功飞离连片种植的转基因作物田,这种“高剂量/庇护所策略”将不能有效实施。因此,评价不同浓度Bt杀虫蛋白对害虫飞行能力的影响无疑不仅会对这种策略的可行性和有效性提供试验依据,而且对于阐明Bt田中的迁飞性害虫的种群动态、迁飞规律以及其潜在的抗性治理策略均有重要的理论与实际意义。
甜菜夜蛾是一种远距离迁飞害虫[14-16],除为害蔬菜外也对棉花、玉米等造成重大损失[17-21]。随着我国转Bt基因(表达Cry1Ac)棉花大面积种植,在很好地控制了棉花主要靶标害虫的同时,由于大大减少了转Bt基因棉花田中化学杀虫剂使用量,以及甜菜夜蛾对Bt的不敏感性,导致近年来转Bt基因棉花田中甜菜夜蛾有严重发生趋势[20,22-23]。目前,国内有关转Bt基因作物对甜菜夜蛾抗虫性评价主要研究转Bt基因作物或Bt蛋白对其生长发育、存活以及繁殖等参数的影响作用[24-26],而对成虫飞行能力的影响缺乏研究。本文主要研究甜菜夜蛾取食含不同浓度Cry1 Ac蛋白的人工饲料后存活并羽化出的成虫飞行能力的差异,以期为转Bt基因棉花田中甜菜夜蛾种群动态规律及其潜在的“高剂量/庇护所”抗性治理策略提供科学依据。
1 材料与方法
1.1 试验虫源
所用虫源采自北京市郊区大葱田地,经本实验室在室内用人工饲料[27]累代繁殖后,选择发育良好的虫源作为供试材料。
1.2 Cry1Ac杀虫蛋白干粉
Cry1 Ac杀虫蛋白干粉由中国农业科学院植物保护研究所中保科农科技有限公司提供(北京)。分离菌株来源于苏云金杆菌库斯塔克亚种subsp.kurstaki HD-1 菌株的突变 菌株HD-1Ac(产生Cry1Ac蛋白)。纯度在95%以上。蛋白干粉于-70℃超低温冰箱中保存,使用时用蒸馏水溶解。
1.3 幼虫饲养及成虫飞行能力测试
幼虫带毒人工饲料的配制及饲养方法同陈建等[28]的方法。成虫飞行能力测试用虫为取食含不同浓度Cry1 Ac杀虫蛋白人工饲料后存活的幼虫,化蛹、羽化出的1日龄(未取食)雌雄蛾。由于成虫未取食补充营养,所以其飞行能力的差异能反映幼虫期食物的影响作用。测试方法同江幸福等[29]方法。
1.4 数据统计与分析
处理间不同参数经方差统计分析差异显著后,用LSD法进行差异显著性测定。统计软件为SAS 8.0。数据为平均数±标准误。
2 结果与分析
2.1 幼虫取食含不同浓度Cry1Ac杀虫蛋白人工饲料存活并羽化的雌蛾飞行能力
甜菜夜蛾幼虫取食含不同浓度Cry1 Ac蛋白人工饲料后,存活并羽化的1日龄(未取食)雌蛾飞行能力差异显著(图1)。体现在不同幼虫饲料条件下羽化的雌蛾飞行距离(df=4,F=7.22,p<0.000 1)、飞行时间(df=4,F=7.20,p<0.000 1)和飞行速度(df=4,df=4,F=3.88,p=0.0049)均差异显著。取食含较低浓度Cr y1 Ac杀虫蛋白(25μg/g和50μg/g)的人工饲料有促进成虫飞行的倾向,尽管与取食不含Cr y1 Ac蛋白的对照相比,成虫飞行距离、平均飞行速度和飞行时间未达到显著增加的水平。随着人工饲料中Cry1 Ac蛋白浓度的升高,羽化的雌蛾飞行能力显著下降(p<0.05)。
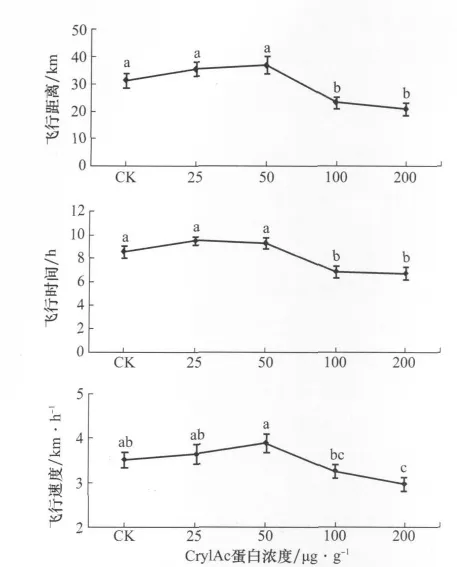
图1 甜菜夜蛾幼虫取食含不同浓度Cry1Ac杀虫蛋白人工饲料羽化的1日龄雌蛾飞行能力
为进一步分析不同浓度Cry1Ac杀虫蛋白对雌蛾飞行能力的影响,参照江幸福等[30]的方法,对不同处理组间的强飞个体进行分析比较。结果表明,取食含25μg/g和50μg/g Cry1 Ac蛋白人工饲料羽化的雌蛾强飞行个体比例较高,飞行距离超过40 k m的个体比例分别达到33.3%和43.3%。而随着人工饲料中Cry1 Ac蛋白浓度的进一步升高,羽化的雌蛾强飞行个体比例显著下降,取食含200μg/g Cr y1 Ac蛋白人工饲料羽化的雌蛾飞行距离超过40 k m的个体仅为10% (图2)。按飞行时间和平均飞行速度划分,也表现出相同的趋势(图2)。这些结果进一步表明,幼虫取食较低浓度的Cr y1 Ac蛋白对雌蛾飞行能力有明显促进作用,而浓度过高则显著抑制成虫的飞行。
2.2 幼虫取食含不同浓度Cry1Ac杀虫蛋白人工饲料存活并羽化的雄蛾飞行能力
甜菜夜蛾幼虫取食含不同浓度Cry1Ac蛋白的人工饲料羽化的1日龄(未取食)雄蛾飞行距离(df=4,F=11.18,p<0.000 1)、飞行时间(df=4,F=13.42,p<0.000 1)和飞行速度(df=4,F=8.04,p<0.000 1)也差异显著。尽管在较低浓度Cr y1 Ac蛋白(25μg/g和50μg/g Cr y1 Ac)的人工饲料饲养下存活并羽化的雄蛾飞行能力与取食无Cry1Ac蛋白的人工饲料相比,其飞行距离、飞行时间和飞行速度均未表现出升高的趋势,但这3种条件下各项飞行参数均无显著差异(p>0.05)。随着人工饲料中Cry1Ac蛋白浓度的进一步升高,雄蛾飞行能力显著下降(p<0.05)。

进一步分析幼虫取食含不同浓度Cry1Ac杀虫蛋白人工饲料存活并羽化的雄蛾强飞个体比例的差异(图4)。结果表明,取食不含Cry1Ac蛋白、含25μg/g和50μg/g Cr y1 Ac蛋白人工饲料羽化的雄蛾强飞行个体比例较高,而随着人工饲料中Cry1Ac蛋白浓度的进一步升高,雄蛾强飞行个体比例显著下降,取食含200μg/g Cry1Ac蛋白人工饲料羽化的雄蛾飞行距离超过40 km的个体仅为10.3%。按飞行时间和平均飞行速度划分,也表现出相同的趋势(图4)。这些结果进一步表明,幼虫取食较低浓度的Cry1Ac蛋白对雄蛾飞行能力无抑制作用,而浓度过高则显著抑制雄蛾的飞行。
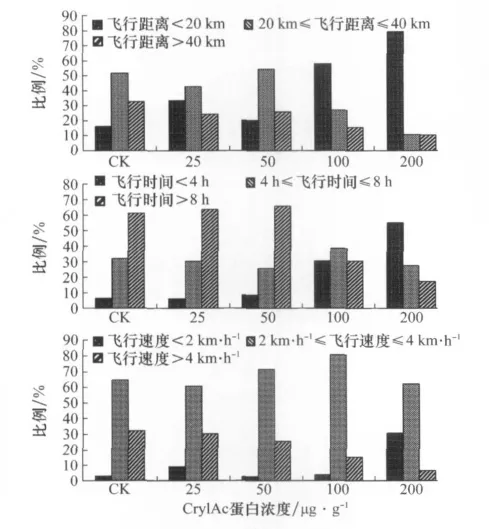
图4 甜菜夜蛾幼虫取食含不同浓度Cry1Ac杀虫蛋白人工饲料羽化的1日龄雄蛾飞行能力频次分布
3 讨论
幼虫食物(寄主植物)的质量与数量通常是影响昆虫生长发育、存活与繁殖等种群参数的重要因素。对于迁飞性昆虫,幼虫食物质量与数量(寄主适合度)的下降通常还是周围栖息地条件恶化的环境指示剂。一定程度的食物质与量的下降有助于诱导成虫迁飞型的分化。如黏虫幼虫在周期性的短时食物缺乏条件下,羽化的成虫有增加迁飞的倾向,但随着幼虫食物条件的进一步恶化,不仅会显著降低种群增长趋势,而且还会显著抑制成虫飞行,从而影响其种群动态。持续饥饿的黏虫,其生长发育、繁殖和飞行等参数均显著下降[31]。与适宜的饲料(人工饲料与甘蓝)相比,取食较不适宜的玉米苗的甜菜夜蛾飞行能力也会显著下降[27]。本文结果表明,甜菜夜蛾幼虫取食含较低Cry1 Ac浓度的人工饲料(25μg/g和50μg/g)不仅没有显著抑制其成虫的飞行能力,相反却有增加迁飞的倾向,表现在强飞行个体比例明显增加,从而为成功逃避转Bt基因作物做好准备,表明一定程度Bt杀虫蛋白的胁迫会显著促进甜菜夜蛾迁飞型的分化。但随着饲料中Cry1Ac浓度的进一步升高,成虫飞行能力显著下降,从而丧失逃避转Bt作物的机会,也会逐渐增加种群的选择压力,引起Bt的抗性风险。
根据甜菜夜蛾在我国的发生危害和迁飞行为规律[32-33],每年进入我国黄淮海地区转Bt棉田危害的甜菜夜蛾通常是在棉花生长的中后期,即棉花开花、现蕾和结铃期。与叶片中高表达的Bt杀虫蛋白相比,棉蕾、棉铃中的表达量相对较低,而甜菜夜蛾对较低浓度Bt蛋白的不敏感性[23]加剧了其对Bt蛋白的抗性风险。另一方面,近年来我国黄淮海地区转Bt基因棉在有效控制棉铃虫(Helicover pa ar miger a)等靶标害虫的同时,并不能有效杀死甜菜夜蛾,而与普通非转Bt基因棉相比,喷施常规化学杀虫剂次数的明显减少等因素引起转Bt基因棉上甜菜夜蛾种群暴发成灾。但至今田间仍未监测到甜菜夜蛾对Bt杀虫蛋白的抗性,尽管室内汰选试验表明,甜菜夜蛾对Bt杀虫蛋白的抗性产生是可能的[34]。取食较低浓度亚致死剂量的Bt杀虫蛋白导致甜菜夜蛾成虫迁飞倾向的增加,从而成功飞离Bt作物并与庇护所作物上的敏感种群杂交,稀释抗性基因频率是甜菜夜蛾在田间不易形成Bt抗性的重要因素之一。因此,建议在转Bt作物生态安全性评价研究中,除评价目标杀虫蛋白对害虫的生长发育、存活和生殖等影响外,还应增加对取食亚致死剂量Bt杀虫蛋白后存活并羽化的迁飞性昆虫飞行能力的评价内容,从而为全面分析转Bt基因作物对迁飞性害虫种群动态规律的影响以及抗性治理策略提供科学依据。
[1] Ja mes C.Brief 41:Global stat us of co mmercialized biotech/GM cr ops:2009[R].ISAAA Brief No.41.ISAAA:It haca,NY,2009.
[2] Tabashnik B E.Evolution of resistance to Bacill us thuringiensis[J].Annu Rev Entomol,1994,39:47-49.
[3] Tabashnik B E,Carriere Y,Dennehy T J,et al.Insect resist-ance to transgenic Bt crops:lessons from the laboratory and field[J].J Econ Ento mol,2003,96:1031-1038.
[4] Olsen K M,Daly J C,Holt H E,et al.Season-long variation in expression of Cry1 Ac gene and efficacy of Bacill us thuringiensis toxin in transgenic cotton against Helicover pa ar miger a(Lepidoptera:Noctuidae)[J].J Econ Entomol,2005,98(3):1007-1017.
[5] 张小四,李松岗,许崇任,等.转Bt棉不同生长期及不同器官杀虫蛋白表达量的免疫学方法测定[J].北京大学学报(自然科学版),2000,36(4):477-484.
[6] 孙伟,曹玉洪.转Bt基因抗虫棉Bt毒蛋白表达量的时空变化[J].安徽农业科学,2005,33(2):202-203.
[7] Tabashnik B E,Gassmann A J,Cro wder D W,et al.Insect resistance t o Bt cr ops:Evidence versus t heory[J].Nat Biotechnol,2008,26:199-202.
[8] Luttrell R G,Ali I,Allen K C.et al.Resistance to Bt in Arkansas populations of cotton boll wor m[C]∥Richter D A.Proceedings of the 2004 Belt wide Cotton Conferences,San Antonio,TX,January 5-9,2004:1373-1383.
[9] Matten S R,Head G P,Quemada H D.How gover n mental regulation can help or hinder t he integration of Bt cr ops into IPM programs[M]∥Romeis J,Shelton A M,Kennedy G G,ed.Integration of Insect-Resistant Genetically Modified Crops wit hin IPM Progra ms(New Yor k:Springer),2008:27-39.
[10]Tabashnik B E,Gassmann A J,Crowder D W,et al.Fieldevolved resistance to Bt toxins[J].Nat Biotechnol,2008,26:1074-1076.
[11]Tabashnik B E.Delaying insect resistance to transgenic crops[J].Proc Natl Acad Sci USA,2008,105(49):19029-19030.
[12]Glau m P R,Ives A R,Andow D A.Conta mination and management of resistance evolution to high-dose transgenic insecticidal crops[J/OL].Theor Ecol,2011,doi 10.1007/s12080-010-0109-6.
[13]Wu K M,Lu Y H,Feng H Q,et al.Suppression of cotton boll wor m in multiple crops in China in areas with Bt toxin-containing cotton[J].Science,2008,321:1676-1678.
[14]Mikkola K.The inter pretation of long-range migration of Spodopter a exigua [J].J Ani m Ecol,1970,39:593-598.
[15]Mitchell E R.Migration by Spodopter a exigua and S.f r ugiper da[M]∥Rabb R L,Kennedy J S,eds.Movement of Highly Mobile Insects:Concepts and Met hodology in Research.Nort h Carolina State University,Raleigh,NC,1979:386-393.
[16]Ki mura S.Immigration of t he beet ar my wor m,Spodopter a exigua (Hübner),to northern coastal area of Akita prefecture,1990,in relation to at mospheric conditions[J].Annu Rep Soc Plant Prot Nort h Japan,1991,42:148-151.
[17]Feng H Q,Wu K M,Cheng D F,et al.Radar observation of t he autu mn migration of t he beet ar my wor m,Spodopter a exigua,and ot her mot hs in nort her n China[J].Bull Ent o mol Res,2003,93:115-124.
[18]江幸福.甜菜夜蛾在我国的发生为害及防治概况[J].农资科技,1998(6):8-10.
[19]江幸福,罗礼智.甜菜夜蛾暴发原因及防治对策[J].植物保护,1999,25(3):32-34.
[20]王万群,晋汉凤,李尚义.抗虫棉遭遇甜菜夜蛾严重危害的初步观察[J].中国棉花,2002,29(10):27-28.
[21]Wu G,Harris M K,Guo J Y,et al.Response of multiple generations of beet ar my wor m,Spodopter a exigua (Hübner),feeding on transgenic Bt cotton[J].J Appl Ento mol,2008,132:1-11.
[22]夏敬源,崔金杰,常蕊芹.转基因抗虫棉对甜菜夜蛾的抗性研究[J].中国棉花,2000,27(9):11-12.
[23]蒋冬花,邓日强,庞义,等.对夜蛾科幼虫高毒力的苏云金芽孢杆菌菌株及其晶体蛋白特性[J].中国生物防治,1997,13(2):82-85.
[24]薛明,董杰,张成省.取食转Bt基因棉等植物对甜菜夜蛾生长发育和药剂敏感性的影响[J].植物保护学报,2002,29(1):13-18.
[25]王振营,王冬妍,何康来,等.转Bt基因玉米对甜菜夜蛾幼虫存活和发育的影响[J].昆虫学报,2005,48(2):214-220.
[26]张小丽,陈萍,陈翠芳,等.转Bt基因抗虫棉对甜菜夜蛾实验种群增长的影响[J].植物保护学报,2007,34(4):391-395.
[27]江幸福,罗礼智,胡毅.幼虫食物对甜菜夜蛾生长发育、繁殖及飞行的影响[J].昆虫学报,1999,42(3):270-275.
[28]陈建,江幸福,罗礼智,等.甜菜夜蛾低龄幼虫取食Cry1 Ac毒素对生长发育及成虫繁殖的影响[J].昆虫学报,2010,53(3):1119-1126.
[29]Jiang X F,Luo L Z,Sappingt on T W.Relationship of flight and repr oduction in beet ar my wor m,Spodopter a exigua(Lepidoptera:Noctuidae),a migrant lacking the oogenesis-flight syndrome[J].J Insect Physiol,2010,56(10):1631-1637.
[30]江幸福,罗礼智,胡毅.成虫期营养对甜菜夜蛾生殖和飞行的影响[J].植物保护学报,2000,27(4):327-332.
[31]曹雅忠,罗礼智,郭军.粘虫生殖和飞翔与幼虫期营养的关系[J].昆虫学报,1996,35(1):105-108.
[32]江幸福,罗礼智.甜菜夜蛾越冬与迁飞规律研究进展与发展趋势[J].长江蔬菜,2010(18):36-37.
[33]江幸福,罗礼智.我国甜菜夜蛾发生危害特点及治理措施[J].长江蔬菜,2010(18):93-95.
[34]Luttrell R G,Wan L,Knighten K.Variation in susceptibility of noctuid(Lepidoptera)larvae attacking cotton and soybean to purified endotoxin protein and commercial f or mulations of Bacill us thuringiensis[J].J Econ Ento mol,1999,92:21-32.

