共振光猝灭法测定食盐中硒*
李咏梅,李人宇,陈蕾,王新宇,赵盛平
1(淮海工学院化学工程学院,江苏连云港,222005) 2(连云港师范高等专科学校,江苏连云港,222006)
共振光猝灭法测定食盐中硒*
李咏梅1,李人宇2,陈蕾1,王新宇1,赵盛平1
1(淮海工学院化学工程学院,江苏连云港,222005) 2(连云港师范高等专科学校,江苏连云港,222006)
基于聚乙烯醇存在的条件下,在pH 10.6的Na2B4O7-NaOH缓冲溶液中,钼酸铵与溴代十六烷基吡啶生成离子缔合物而产生强而稳定的共振光散射,1-(2-吡啶偶氮)-2-萘酚促进此离子缔合物离解,导致共振光猝灭,硒(Ⅳ)能加剧共振光猝灭,据此建立了共振光猝灭法测定硒的新方法。通过单因素试验和L16(45)正交试验对反应体系进行优化,确定了适宜反应条件。最大共振光猝灭波长位于375 nm,共振光强度猝灭值与硒(Ⅳ)浓度在0.8~4.8 μg/L内线性关系良好。方法用于测定硒强化营养盐和健康平衡盐中硒,结果与荧光法一致,相对标准偏差为 1.07% ~1.61%(n=5),回收率为 99.5% ~101.5%。
共振光猝灭法,硒,钼酸铵,溴代十六烷基吡啶,1-(2-吡啶偶氮)-2-萘酚,聚乙烯醇,食盐
硒是人体所必需的微量元素之一,具有抗氧化、促进免疫、调控基因表达、缓解有毒元素(如汞、铅、镉、砷)的毒性等生理功能,缺硒会导致克山病、大骨节病、癌症、心血管疾病、糖尿病、白内障、爱滋病等疾病。但硒摄入过量也会产生硒中毒[1-2]。食盐加硒是补硒的有效措施,即在制盐过程中加入适量亚硒酸钠。为了满足人体全面营养的需要,有的硒盐中还添加了钾、镁、锌、碘等其他营养成分,这些营养成分往往会影响硒含量的测定。因此,准确测定食盐中的硒对于科学合理地补硒具有重要的指导意义。
目前已报道测定硒的方法有分光光度法[3]、荧光光谱法[4]、共振光散射法[5]、原子吸收光谱法[6]、电化学法[7]等。共振光散射法自20世纪90年代创立以来,因其操作简便、测定灵敏度高而广泛应用于生物大分子测定[8]及药物分析[9]等,但在食品分析领域应用极少。本文建立了硒(Ⅳ)-钼酸铵-溴代十六烷基吡啶-1-(2-吡啶偶氮)-2-萘酚体系共振光猝灭法测定食盐中硒,结果满意。
1 材料与方法
1.1 试验材料与试剂
硒强化营养盐和健康平衡盐,由江苏省井神盐业有限公司生产。硒(Ⅳ)标准储备溶液(国家标准物质研究中心,编号 GBW(E)080215):100 μg/mL,于冰箱4℃保存。使用时稀释成0.1 μg/mL标准溶液;pH 10.6 Na2B4O7-NaOH 缓冲溶液:将 50 mL 0.025 mol/L Na2B4O7和 23.3 mL 0.1 mol/L NaOH混合,用水稀释至100 mL并摇匀,经酸度计校正;100 g/L钼酸铵溶液;0.2 g/L溴化十六烷基吡啶(CPB)溶液;2 g/L聚乙烯醇(PVA)溶液;2.0×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚(PAN)溶液。以上试剂均为分析纯,实验用水为去离子水。
1.2 试验仪器与设备
RF-5301PC荧光分光光度计,日本岛津;CS-501型超级恒温槽,重庆银河试验仪器有限公司;BS-210S型电子天平,北京赛多利斯天平有限公司;pHS-3C型酸度计,上海精密科学仪器有限公司。
1.3 试验方法
1.3.1 测定方法
在25 mL比色管中,依次加入Na2B4O7-NaOH缓冲溶液,硒(Ⅳ)标准溶液(或样品溶液),钼酸铵溶液,溴化十六烷基吡啶溶液,聚乙烯醇溶液和1-(2-吡啶偶氮)-2-萘酚溶液,加水至刻度,混匀,静置。反应完全后取适量溶液于石英比色皿中,置于荧光分光光度计上,在激发光和发射光狭缝宽度均为3 nm,低灵敏度,λex=λem的条件下,于最大共振光猝灭波长处测量溶液的共振散射光强度IRLS。以不加硒(Ⅳ)的溶液为试剂空白,测量其共振散射光强度,计算共振光强度猝灭值ΔIRLS=-IRLS。
1.3.2 单因素试验设计
选取影响反应的主要因素缓冲溶液pH值及用量、钼酸铵用量、溴化十六烷基吡啶用量、聚乙烯醇用量、1-(2-吡啶偶氮)-2-萘酚用量、反应温度和反应时间为考察因素,以ΔIRLS值为考察指标,分别进行单因
素试验,优化出适宜的反应条件。
1.3.2.1 缓冲溶液pH值的选择
按照1.3.1 方法,取0.1 μg 硒(Ⅳ)标准溶液,在100 g/L钼酸铵1.5 mL,0.2 g/L溴化十六烷基吡啶1.5 mL,2 g/L 聚乙烯醇 2.0 mL,2.0 ×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚 1.5 mL,反应温度 30 ℃,反应时间20 min的条件下,设计1.5 mL Na2B4O7-NaOH缓冲溶液的 pH 值为 9.2、9.4、9.6、9.8、10.0、10.2、10.4、10.6、10.8 进行试验,测定其 ΔIRLS值。
1.3.2.2 缓冲溶液用量的选择
按照1.3.1 方法,取0.1 μg 硒(Ⅳ)标准溶液,在100 g/L钼酸铵1.5 mL,0.2 g/L溴化十六烷基吡啶1.5 mL,2 g/L 聚乙烯醇 2.0 mL,2.0 ×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚 1.5 mL,反应温度 30 ℃,反应时间20 min的条件下,设计适宜pH值的缓冲溶液用量为 0.5、0.8、1.0、1.2、1.5、1.8、2.0、2.5、3.0、4.0 mL进行试验,测定其ΔIRLS值。
1.3.2.3 钼酸铵用量的选择
按照1.3.1 方法,取0.1 μg 硒(Ⅳ)标准溶液,在pH 10.6 的 Na2B4O7-NaOH 缓冲溶液1.0 mL,0.2 g/L溴化十六烷基吡啶1.5 mL,2 g/L聚乙烯醇2.0 mL,2.0 ×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚 1.5 mL,反应温度30℃,反应时间20 min的条件下,设计100 g/L 钼酸铵溶液的用量为 1.0、1.5、1.8、2.0、2.5、3.0、4.0 mL 进行试验,测定其 ΔIRLS值。
1.3.2.4 溴化十六烷基吡啶用量的选择
按照1.3.1 方法,取0.1 μg 硒(Ⅳ)标准溶液,在pH 10.6 的 Na2B4O7-NaOH 缓冲溶液1.0 mL,100 g/L钼酸铵 1.8 mL,2 g/L 聚乙烯醇 2.0 mL,2.0 ×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚 1.5 mL,反应温度 30℃,反应时间20 min的条件下,设计0.2 g/L溴化十六烷基吡啶溶液的用量为 0.5、1.0、1.2、1.4、1.5、2.0、2.5、3.0 mL 进行试验,测定其 ΔIRLS值。
1.3.2.5 聚乙烯醇用量的选择
按照1.3.1 方法,取0.1 μg 硒(Ⅳ)标准溶液,在pH 10.6 的 Na2B4O7-NaOH 缓冲溶液1.0 mL,100 g/L钼酸铵1.8 mL,0.2 g/L 溴化十六烷基吡啶 1.5 mL,2.0 ×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚 1.5 mL,反应温度30℃,反应时间20 min的条件下,设计2 g/L聚乙烯醇溶液的用量为 0.5、1.0、1.2、1.5、2.0、2.5、3.0 mL进行试验,测定其ΔIRLS值。
1.3.2.6 1-(2-吡啶偶氮)-2-萘酚用量的选择
按照1.3.1 方法,取0.1 μg 硒(Ⅳ)标准溶液,在pH 10.6 的Na2B4O7-NaOH 缓冲溶液1.0 mL,100 g/L钼酸铵1.8 mL,0.2 g/L 溴化十六烷基吡啶1.5 mL,2 g/L聚乙烯醇1.5 mL,反应温度30℃,反应时间20 min的条件下,设计 2.0×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚溶液的用量为 0.5、1.0、1.2、1.5、2.0、2.5、3.0、3.5、4.0 mL 进行试验,测定其 ΔIRLS值。
1.3.2.7 反应温度的选择
按照1.3.1 方法,取0.1 μg 硒(Ⅳ)标准溶液,在pH 10.6 的Na2B4O7-NaOH 缓冲溶液1.0 mL,100 g/L钼酸铵1.8 mL,0.2 g/L 溴化十六烷基吡啶1.5 mL,2 g/L 聚乙烯醇1.5 mL,2.0 ×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚溶液2.0 mL,反应时间20 min的条件下,设计反应温度为 10、20、25、30、35、40、50、60、70 ℃进行试验,测定其ΔIRLS值。
1.3.2.8 反应时间的选择
按照1.3.1 方法,取0.1 μg 硒(Ⅳ)标准溶液,在pH 10.6 的Na2B4O7-NaOH 缓冲溶液1.0 mL,100 g/L钼酸铵1.8 mL,0.2 g/L 溴化十六烷基吡啶1.5 mL,2 g/L 聚乙烯醇1.5 mL,2.0 ×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚溶液2.0 mL,反应温度30℃的条件下,设计反应时间为 5、8、10、15、20、30、40、50、60、70、80、90、100、110 min 进行试验,测定其 ΔIRLS值。
1.3.3 正交试验设计
在单因素试验基础上选取钼酸铵用量、溴化十六烷基吡啶用量、1-(2-吡啶偶氮)-2-萘酚用量、反应温度为考察因素,以ΔIRLS值为考察指标,进行L16(45)正交试验,确定最优反应条件。试验的因素水平见表1。
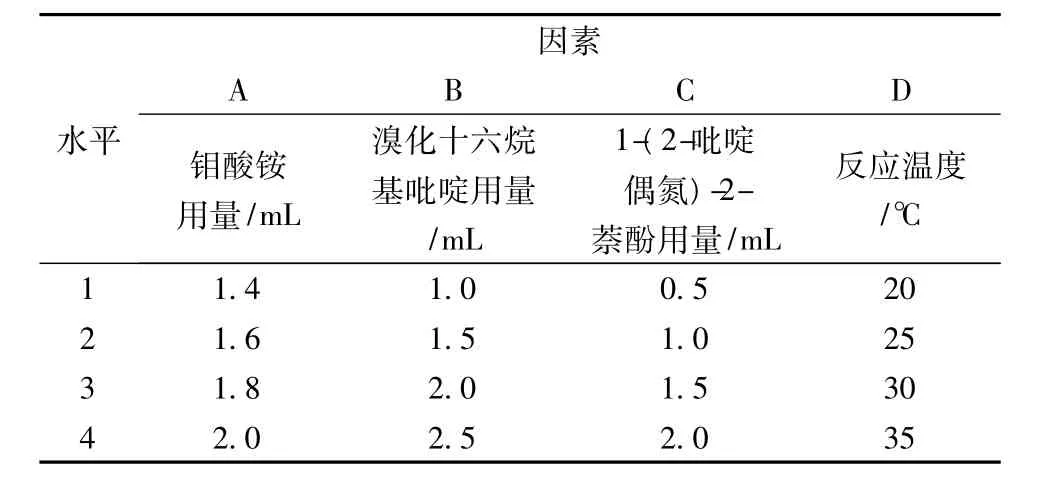
表1 L16(45)正交试验因素水平表
1.3.4 标准曲线的绘制
在一组25 mL比色管中,分别准确加入0.1 μg/mL 硒(Ⅳ) 标准溶液 0.20、0.40、0.60、0.80、1.00、1.20 mL,按照 1.3.1 方法在最优条件下反应,测定其ΔIRLS值,绘制标准曲线。
1.3.5 样品中硒含量的测定
分别准确称取硒强化营养盐、健康平衡盐样品1.000 g于小烧杯中,用适量水溶解,定容于50 mL容量瓶中。吸取1.00 mL上述试液于25 mL比色管中,按照1.3.1方法在最优条件下反应,测定其ΔIRLS值,代入标准曲线回归方程计算出样品中硒含量。
取盐样1.000 g 5 份,分别加入2 μg硒(Ⅳ)标准溶液,再按上述方法操作,测定其ΔIRLS值,计算平均回收率。
2 结果与讨论
2.1 共振散射光谱
按照1.3.1方法在 λex-λem=Δλ =0条件下同步扫描获得共振散射光谱,如图1所示。在pH 10.6的Na2B4O7-NaOH缓冲溶液中,当钼酸铵与聚乙烯醇或1-(2-吡啶偶氮)-2-萘酚共存或者单独存在时,其共振散射光强度均接近零,且基本重合(曲线1~曲线3);当钼酸铵与溴化十六烷基吡啶反应生成离子缔合物,共振散射光强度显著增大,最大共振光散射峰位于375 nm(曲线4);聚乙烯醇存在下,上述混合液中加入1-(2-吡啶偶氮)-2-萘酚,可促进此离子缔合物离解,导致共振光猝灭(曲线5);再加入硒(Ⅳ)能加剧共振光猝灭,且375 nm处共振散射光猝灭程度最大(曲线6)。故选择λex=λem=375 nm为测定波长。
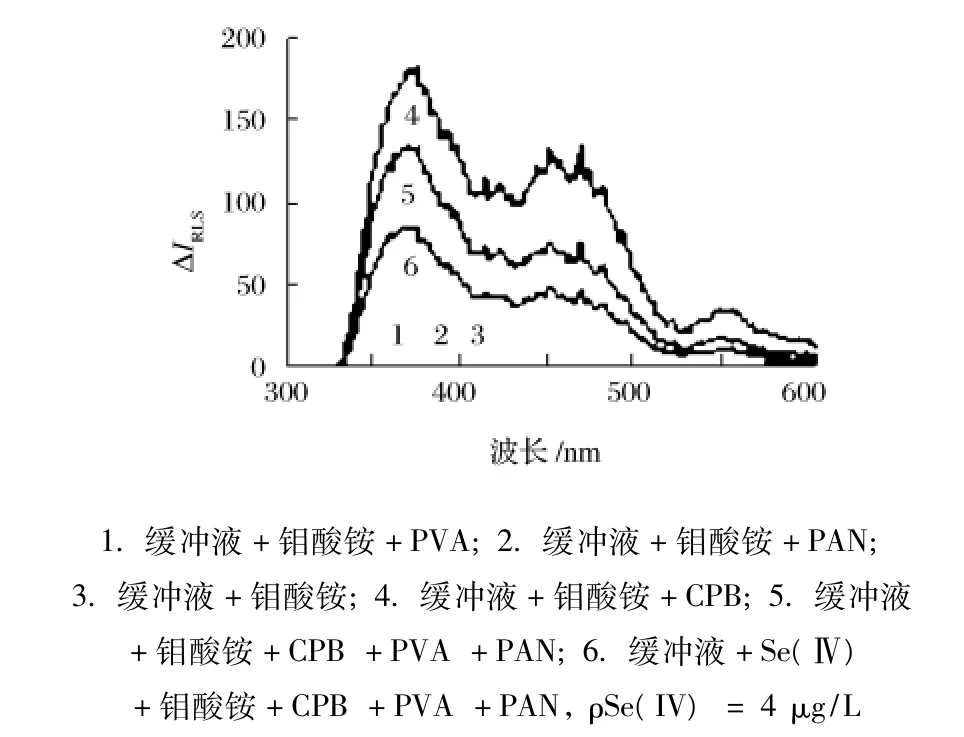
图1 共振散射光谱
2.2 单因素试验结果
2.2.1 pH 值的影响
由图2可知,在pH 10.6的 Na2B4O7-NaOH缓冲溶液中反应,ΔIRLS值最大。由图3可知,缓冲溶液用量在0.8 ~1.5 mL 范围内,ΔIRLS值最大。选用 1.0 mL pH 10.6缓冲溶液。
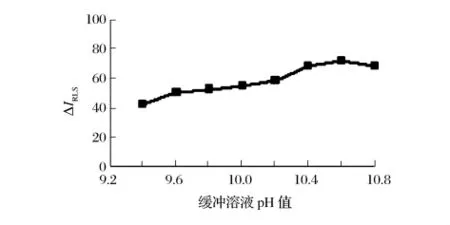
图2 缓冲溶液pH值的影响
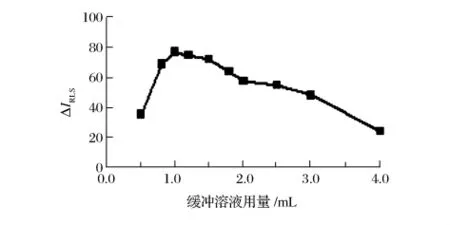
图3 缓冲溶液用量的影响
2.2.2 钼酸铵用量的影响
由图4可知,当100 g/L钼酸铵溶液用量在1.5~2.0 mL 内,ΔIRLS值最大。选用 1.8 mL 钼酸铵溶液。

图4 钼酸铵用量的影响
2.2.3 溴化十六烷基吡啶用量的影响
由图5可知,当0.2 g/L CPB溶液用量为1.5~2.0 mL 时,ΔIRLS值最大。选用1.5 mL CPB 溶液。
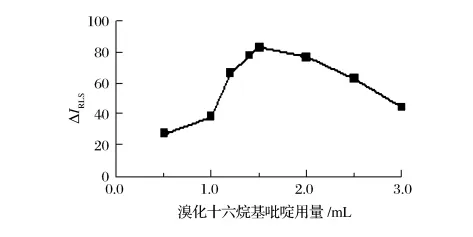
图5 溴化十六烷基吡啶用量的影响
2.2.4 聚乙烯醇用量的影响
由图6可知,当2 g/L聚乙烯醇溶液用量在1.0~2.5 mL 内,ΔIRLS值最大。选用1.5 mL 聚乙烯醇溶液。

图6 聚乙烯醇用量的影响
2.2.5 1-(2-吡啶偶氮)-2-萘酚用量的影响
由图7可知,当 2.0×10-5mol/L 1-(2-吡啶偶氮)-2-萘酚溶液用量在 1.5 ~2.5 mL 范围内,ΔIRLS值最大。选用2.0 mL 1-(2-吡啶偶氮)-2-萘酚溶液。
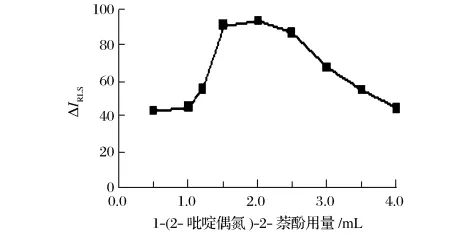
图7 1-(2-吡啶偶氮)-2-萘酚用量的影响
2.2.6 反应温度的影响
由图8可知,当反应温度为30℃时,ΔIRLS值最大。当反应温度高于40℃时,ΔIRLS值迅速减小,且反应温度高于60℃,体系变得不稳定。选择30℃为反应温度。
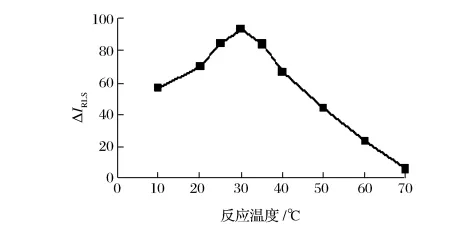
图8 反应温度的影响
2.2.7 反应时间与稳定性
由图9可知,反应开始后,ΔIRLS值迅速增大。当反应20 min时,ΔIRLS达到最大,并保持90 min基本不变(相对误差<-5%)。选择反应时间为20 min。
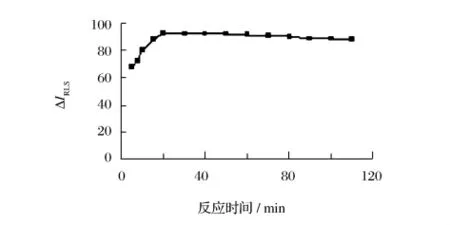
图9 反应时间的影响
2.3 正交试验结果
正交试验结果及其极差分析见表2。采用SPSS16.0软件对正交试验结果进行方差分析,见表3。因篇幅所限仅列出标准溶液ΔIRLS值的极差分析和方差分析。
由表2可知,共振光猝灭法测定硒的最优水平组合为A2B2C3D1,即钼酸铵用量为1.8 mL、溴化十六烷基吡啶用量为1.5 mL、1-(2-吡啶偶氮)-2-萘酚用量为2.0 mL、反应温度为30℃。由表2极差分析和表3方差分析可知,各因素对结果的影响次序为B>C>D>A,其中因素B、C和D影响显著,因素A影响不显著。
综合上述单因素试验和正交试验结果,共振光猝灭法测定硒的最佳反应条件为:在25 mL比色管中,依次加入1.0 mL pH 10.6的Na2B4O7-NaOH缓冲溶液,一定量样品溶液,1.8 mL 100 g/L钼酸铵溶液,1.5 mL 0.2 g/L 溴化十六烷基吡啶溶液,1.5 mL 2 g/L 聚乙烯醇溶液和 2.0 mL 2.0 ×10-5mol/L1-(2-吡啶偶氮)-2-萘酚溶液,用水稀释至刻度并摇匀,控温于30℃反应20 min。用荧光分光光度计,在最大共振光猝灭波长375 nm处测定硒含量。
2.4 标准曲线与检出限
由图10可知,在最佳反应条件下,线性范围为0.8 ~ 4.8 μg/L,标 准 曲 线 回 归 方 程 为 ΔIRLS=20.822ρ(μg/L)+9.591 7,相关系数 r=0.999 2。测定11份试剂空白溶液的散射光强度,求得标准偏差s=0.465,按照式DL=3 s/k(k:斜率)计算出方法检出限为 0.067 μg/L。
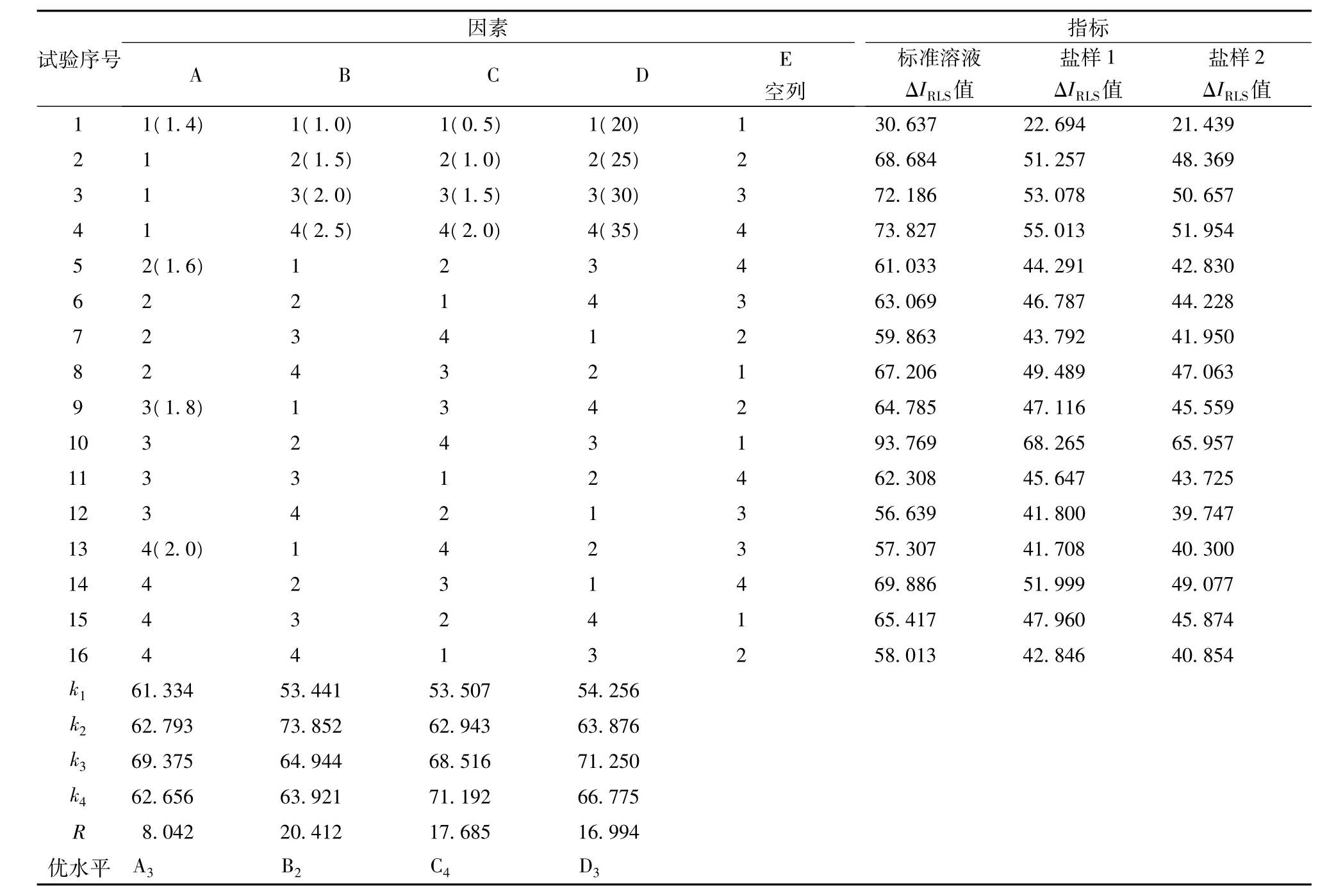
表2 正交试验结果及极差分析
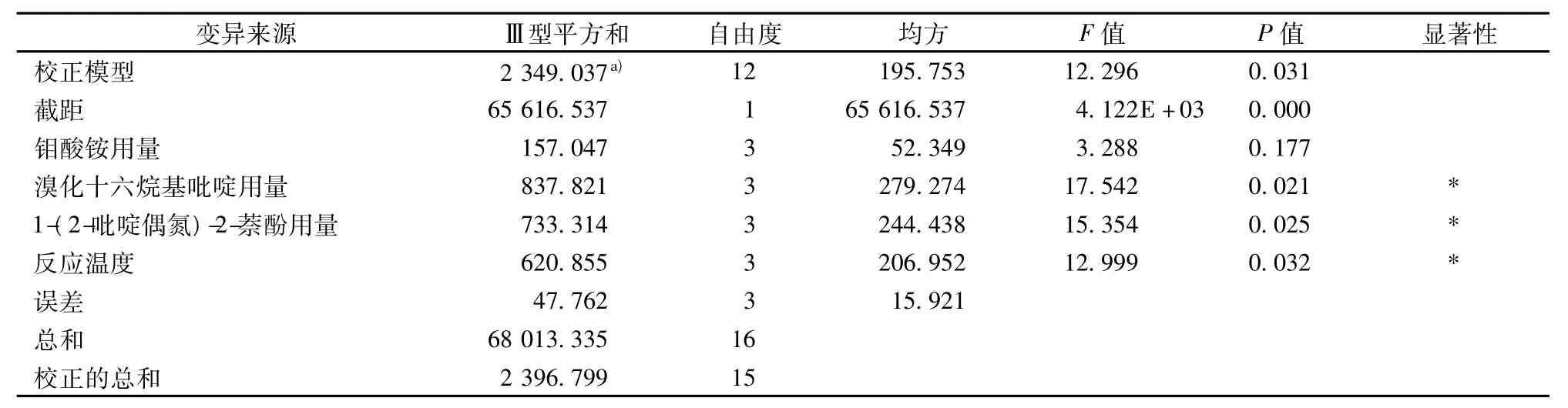
表3 正交试验的方差分析
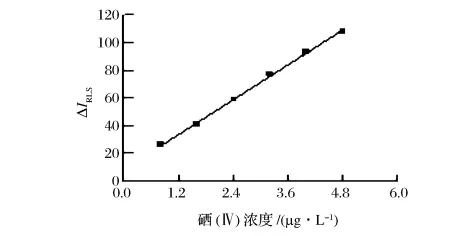
图10 标准曲线
2.5 共存物质的影响
在最佳反应条件下,对25 mL溶液中0.1 μg硒(Ⅳ)进行测定,相对误差≤ ±5%内,常见共存物质的允许倍量为 Cl-、K+(2.5 ×105),Na+(1.5 ×105),EDTA(1.0 × 104),Ca2+、Mg2+、Al3+(5 000),Br-(3 000),Zn2+、Co2+、Fe3+、Cd2+、Hg2+、HCO3-、HSO3-、I(Ⅴ)、过硫酸根、硫脲(1 000),Cu2+、Pb2+、SO42-(100)。结果表明,方法有良好的选择性。对于盐样,无需掩蔽可直接测定。对于Cu2+、Pb2+等金属离子含量过高的样品,可加入适量EDTA溶液掩蔽。
2.6 样品测定结果

表4 样品中硒含量测定结果(n=5)
由表4可知,共振光猝灭法测定硒含量的结果与荧光法的测定结果一致,且 RSD为 1.07% ~1.61%,表明该方法准确可靠,重现性好。

表5 回收率测定结果(n=5)
由表5可知,平均回收率为99.5% ~101.5%,表明该方法测定结果准确。
3 结论
本文通过单因素试验和L16(45)正交试验对反应体系进行优化,确定了最佳反应条件,建立了共振光猝灭法测定硒强化营养盐和健康平衡盐中硒。方法准确、灵敏、选择性好,条件易于控制,分析成本低,对环境友好,有推广应用价值。
[1] Johanssona L,Gafvelinb G,Arnér E S J.Selenocysteine in proteins-properties and biotechnological use[J].Biochimica et Biophysica Acta,2005,1 726(1):1-13.
[2] Reida M E,Strattonb M S,Lillicoc A J,et al.A report of high-dose selenium supplementation:response and toxicities[J].Journal of Trace Elements in Medicine and Biology,2004,18(1):69-74.
[3] Moskvin L N,Bulatov A V,Rudenko E A,et al.Photometric Determination of Trace Selenium in Aqueous Media[J].Journal of Analytical Chemistry,2006,61(1):25-27.
[4] Pedro J,Andrade F,Magni D,et al.On-line submicellar enhanced fluorometric determination of Se(Ⅳ)with 2,3-diaminonaphthalene[J].Analytica Chimica Acta,2004,516(1/2):229-236.
[5] 白燕,李维嘉,吴雅琴,等.共振瑞利散射法测定微量硒[J].分析实验室,2005,24(8):8-11.
[6] Sounderajan S,Kumar G K,Udas A C.Cloud point extraction and electrothermal atomic absorption spectrometry of Se(Ⅳ)-3,3 '-diaminobenzidine for the estimation of trace amounts of Se(Ⅳ)and Se(Ⅵ)in environmental water samples and total selenium in animal blood and fish tissue samples[J].Journal of Hazardous Materials,2010,175(1-3):666-672.
[7]Zvonimir S,Jaroslavaš varc-Gaji c',Nikola M,et al.Development of a chronopotentiometric stripping method for the determination of selenium in mixed diets[J].Food Chemistry,2005,92(4):771-776.
[8] 李原芳,黄承志,胡小莉.共振光散射技术的原理及其在生化研究和分析中的应用[J].分析化学,1998,26(12):1 508-1 515.
[9] 冯素玲,潘自红,樊 静.曙红B共振光散射法测定微量的盐酸异丙嗪[J].应用化学,2008,25(12):1 444-1 447.
[10] 张桂香.分子荧光光度法测定加硒盐中微量硒[J].盐业与化工,2007,36(3):16-19.
Determination of Selenium in Salt by Resonance Light Quenching
Li Yongmei1,Li Renyu2,Chen Lei1,Wang xin-yu1,Zhao Sheng-ping1
1(School of Chemical Engineering,Huaihai Institute of Technology,Lianyungang 222005,China)2(Lianyungang Teachers College,Lianyungang 222006,China)
A new resonance light quenching method for the determination of selenium has been established.In presence of polyvinyl alcohol,ammonium molybdate can react with cetylpyridimium bromide to form an ion-association complex in Na2B4O7-NaOH buffer solution at pH 10.6,which can produce strong and stable resonance light scattering.The chemical 1-(2-pyridylazo)-2-naphthol can promote the disassociation of the ion-association complex to cause the resonance light quenching.In addition,selenium can accelerate the quenching.Through single factor experiments and orthogonal designed experiments L16(45),the optimum reaction conditions were determined.Good linear relationship between resonance light quenching intensity and Se(Ⅳ)concentration occurs in the content range of 0.8 ~4.8 μg/L with the maximum resonance light quenching wavelength at 375 nm.The method has been applied in the determination of selenium in selenium fortified salt and healthy balanced salt.The results showed well consisted with those obtained by fluorescence method.The relative standard deviation was 1.07% ~1.61%(n=5),and the average recovery was 99.5% ~101.5%.
resonance light quenching,selenium,ammonium molybdate,cetylpyridimium bromide,1-(2-pyridylazo)-2-naphthol,polyvinyl alcohol,salt
硕士,高级实验师。
*连云港市社会发展项目
2011-06-07,改回日期:2011-10-25

