从苋菜中提取氢过氧化物裂解酶工艺*
熊杰,刘庆庆,孔祥珍,张彩猛,华欲飞
(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
从苋菜中提取氢过氧化物裂解酶工艺*
熊杰,刘庆庆,孔祥珍,张彩猛,华欲飞
(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
在高等植物中,氢过氧化物裂解酶(hydroperoxide lyase,HPL)可将脂肪氧合酶氧化多不饱和脂肪酸产生的氢过氧化物催化裂解,生成的己醛、己烯醛等芳香性物质具有果蔬的新鲜气味,是食品行业和日化工业中的重要芳香风味添加剂。实验以苋菜为研究对象,在单因素[pH、半胱氨酸浓度、匀浆转速、聚乙烯吡咯烷酮(PVP)浓度]实验基础上,运用4因素3水平的正交实验,对HPL的提取工艺进行了优化,即在12 000 r/min,以pH 8.0的含有1 mmol/L半胱氨酸和0.3%质量浓度的PVP为缓冲液提取HPL,得到的HPL具有很高的酶活。并探索了抽真空对HPL提取的影响,在抽真空完全除去氧的情况下提取HPL,酶活得到显著提高。
氢过氧化物裂解酶(HPL),苋菜,总酶活,真空
氢过氧化物裂解酶(HPL)是植物脂质氧化途径中重要的酶。它是植物产生清香风味成分基本途径(LOX/HPL)中的关键性酶之一,在天然风味的合成中有重要作用。
1973年,Tressl[1]等在香蕉中首次发现一种可以将脂肪酸氢过氧化物裂解的酶,并将其命名为醛酶。随后,Vick等在西瓜幼苗中也发现了它的存在,并进行了分离纯化,后将其命名为氢过氧化物裂解酶[2]。氢过氧化物裂解酶广泛分布于绿叶植物中,苋菜中13-HPL含量最高[3]。HPL是生产天然挥发性风味物质C6醛类的关键酶类,然而也是此技术工业化的瓶颈。如何通过生物化学方法提高酶的活力、提取率、稳定性以及如何在反应过程中通过合适的添加剂稳定酶在反应过程中的性能,以获得C6醛类合成量和转化率的大规模提高是进一步推进此技术商业应用的突破口。本文主要以苋菜为研究对象,探究了pH值、半胱氨酸、匀浆转速、聚乙烯吡咯烷酮(PVP)浓度以及抽真空除去氧气对氢过氧化物裂解酶总酶活的影响,得到一条提取氢过氧化物裂解酶的新工艺。
1 实验材料与方法
1.1 实验材料
苋菜,购于华润万家超市。二硫苏糖醇(DTT)、大豆脂肪氧合酶typeⅠ-B(LOX)、亚油酸、亚麻酸、己醛、己烯醛均购于Sigma公司。其他试剂为分析纯。
CRZIGII型离心机,日本日立;UV2450型分光光度计,日本岛津;组织捣碎机,美国Waring公司;Delta 320s型pH计,梅特勒-托利多公司。
1.2 实验方法
1.2.1 亚油酸氢过氧化物和亚麻酸氢过氧化物的制备
100 mg亚麻酸或亚油酸溶于2 mL无水乙醇中,后转移至预先通氧气至饱和的100 mL 0.2 mol/L pH 9.0的硼酸盐缓冲液中,随后加入3 mg溶入少量的硼酸盐缓冲液的LOX。快速搅拌均匀后在冰浴和持续通氧条件下反应1.5 h,随后用6 mol/L HCl调节反应液至pH3.0以下结束反应。用等体积无水乙醚萃取反应液2次后合并有机相,加入无水MgSO4干燥,过滤后在30℃下旋转蒸发除去乙醚,残留部分为亚麻酸氢过氧化物(13-HPOT)或亚油酸氢过氧化物(13-HPOD),将其溶于一定量乙醇,充氮后分装于 -20℃下密封保存[4]。
1.2.2 氢过氧化物裂解酶粗酶的提取
取265g去掉根、茎,并切成小片的苋菜,与pH合适的800 mL含有一定浓度聚乙烯吡咯烷酮K-30和0.1 mmol/L的Tris-HCl缓冲液共同均浆(分6次,每次10s,间隔5s)。均浆液经4层纱布过滤,滤液在4℃下9 000 r/min离心30 min。弃上清液取沉淀悬浮于50 mL含1 mmol/L DTT和0.5%(v/v)Triton X-100的pH 6.8的0.02 mol/L的磷酸盐缓冲液中,称取质量为m,在层析柜(4℃)中搅拌30 min,在4℃下保存,供测酶活使用(由于不同批次购买的苋菜有差异,确保实验的准确性,所以每组单因素实验都是在同一批次的苋菜中进行)[3]。
1.2.3 氢过氧化物裂解酶酶活的测定
取5 mL,质量为M的酶溶解液,加入到20 mL含1 mmol/L DTT和0.5%(v/v)Triton X-100的pH 6.8的0.02 mol/L的磷酸盐缓冲液中,并在层析柜(4℃)中搅拌10 min。然后取5 μL稀释好的酶液和10 μL 的 13-HPOT 底 物 与 pH 6.0 的 2 985 μL 0.02mol/L磷酸盐(sodium phosphate,PBS)缓冲液混合,在波长234 nm下测定其吸光值在1 min内的线性下降值A。空白为5 μL酶液和pH 6.0的2 995 μL 0.02 mol/L磷酸盐缓冲液混合。酶活力单位定义为:每分钟每裂解1 μmoL的13-HPOT所需的酶量(ε=25000 M-1cm-1)[5]。
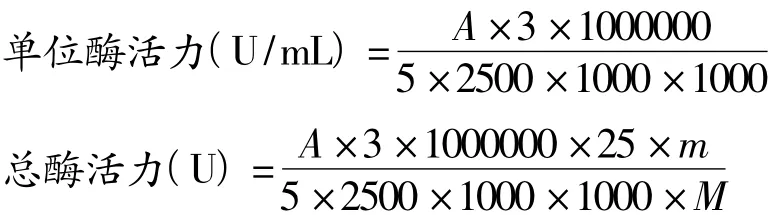
1.3 数据分析
所有数据至少重复3次,取平均值。
2 结果与讨论
2.1 pH对HPL提取的影响
为了得到HPL的最佳提取pH,在pH6~9进行了研究,其中半胱氨酸的浓度为0,匀浆转速为18000 r/min,PVP的浓度为0.5%,结果如图1所示。
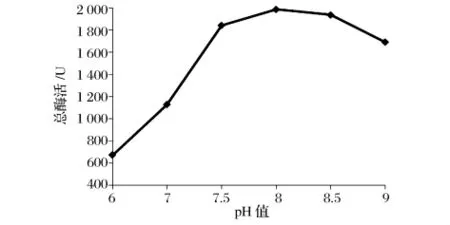
图1 pH对HPL总酶活的影响
由图1可知,随着pH的增大,HPL总酶活先增大后减小,pH 8.0时,HPL的总酶活达到最大值。实验中发现,在pH变化时,酶溶解液的颜色也在发生变化,特别是当pH变低时,酶液的颜色由深绿色变成黄绿色。这可能是在酸性条件下叶绿体中的嘌呤环上的Mg2+被H+所代替,造成了HPL粗酶液颜色和活力的下降[6]。在pH较高的情况下,由于偏离HPL酶的最适pH过大,对HPL的酶活产生不利的影响,导致总酶活下降。故选择8.0为提取的pH值。
2.2 半胱氨酸对HPL提取的影响
根据基因比对,HPL应属于细胞色素P450(cytochromeP450,CYP450)家族的一个新成员CYP74,根据同源性又可分为CYP74B和CYP74C两种。和其他CYP450酶一样,HPL在C末端有4个保守区域,其中保守区D含有和血红素相连的半胱氨酸[7]。Noordermeer[8]等对重组青椒HPL中高度保守的半胱氨酸的C422进行点突变后发现重组蛋白不含血红素铁,溶解性和酶活性都降低,说明半胱氨酸和蛋白活性中心的血红素高度相关。因此在提取HPL过程中,加入一定浓度的半胱氨酸,对HPL本身起保护作用,我们对半胱氨酸的最适浓度进行了探究,其中pH为8.0,匀浆转速为 18000 r/min,PVP的浓度为0.5%,结果如图2所示。

图2 半胱氨酸浓度对HPL总酶活的影响
由图2可知,低浓度的半胱氨酸对HPL酶活的提升没有帮助,当达到1 mmol/L之后,对酶活提升有利。当半胱氨酸的浓度继续升高,HPL的酶活会下降。因此,选择1 mmol/L为半胱氨酸的最佳浓度。
2.3 匀浆转速对HPL提取的影响
HPL通常位于植物的叶绿体或者线粒体膜上[9-10],有研究者推测 HPL作为一种外膜蛋白,分子表面有很多小片段疏水表面残基有助于和细胞膜形成紧密的连接[11]。因此在提取HPL时,需要将植物细胞充分破碎,使酶释放出来。实验采用美国Waring公司的组织捣碎机,对其转速进行探究,其中pH为8.0,半胱氨酸浓度为1 mmol/L,PVP的浓度为0.5%,结果如图3所示。
由图3可知,随着转速的增加,HPL的总酶活逐渐降低。研究表明,在温度超过35℃后,HPL的酶活开始明显的下降。在匀浆的过程中,由于高速搅拌会产生热量,使酶提取液的温度升高,导致酶部分失去活力,最终总酶活降低;另一方面,高速搅拌引起的剪切力产生疏水性气液交界面,导致界面上的酶蛋白空间结构被破坏,这些分子的大量疏水性氨基酸残基暴
,, ,性失活[12]。综合以上结果分析,选择12000 r/min为最佳的匀浆转速。
2.4 PVP对HPL提取的影响
在植物细胞中,含有一定量的酚酸,由于细胞的破碎这些酚酸会释放出来,对HPL的提取产生不利的影响[13]。因此在提取过程中,加入一定浓度的PVP减小这种不利的影响,其中pH为8.0,半胱氨酸浓度为1 mmol/L,匀浆转速为12000 r/min,结果如图4所示。
由图4可得,随着PVP浓度的增加,HPL总酶活先增加,当其浓度达到0.3%时,HPL总酶活达到最大值,PVP浓度继续增加,HPL的酶活会逐渐降低。在低浓度下,PVP可以很有效的与原料中酚类结合保护酶活性,由于PVP溶液呈酸性,当浓度过高后,会影响缓冲液的pH,对HPL的酶活产生不利的影响,因此并不是PVP的浓度越高越好。综合考虑,选择0.3%为最佳的PVP浓度。
2.5 正交试验优化HPL提取的工艺
在单因素的实验基础上,采用4因素3水平的正交实验,以HPL总酶活为指标,对HPL的提取工艺进行优化。正交实验设计及结果如表1所示。
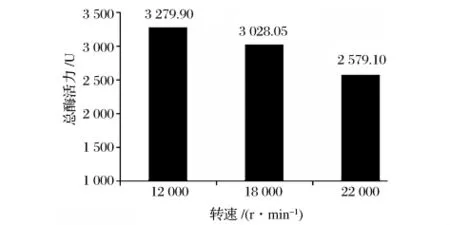
图3 转速对HPL总酶活的影响
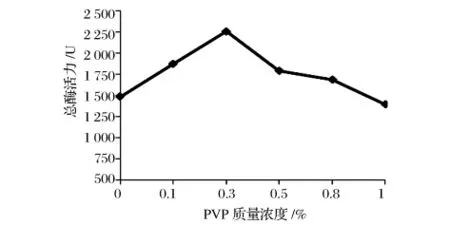
图4 PVP浓度对HPL总酶活的影响

表1 HPL提取工艺优化的正交实验设计及结果
由表1中R的大小可知,pH对HPL的总酶活影响最大,其次分别为PVP浓度、转速、半胱氨酸浓度,即各因素的影响大小顺序为:A>D>C>B,从表中的均值大小可以看出,提取工艺的最优组合为A2B2C1D2,而实验值大小可得出的最优组合为A2B3C1D2为,两者结果不一致,因此需要做验证实验来验证。
取3份同一批次的苋菜,以最优组合A2B2C1D2做验证实验,结果提取的HPL总酶活为2687U,高于表中的最优组合A2B3C1D2的实验结果。因此确定HPL提取的最优组合为 A2B2C1D2,即 pH为8.0,半胱氨酸浓度为1 mmol/L,转速为12000 r/min,PVP质量浓度为0.3%。
2.6 匀浆抽真空对HPL提取的影响
酶分子中所含的Met,Cys,Trp及Tyr等,与各种活泼氧具有很高的反应性,极易被氧化。HPL分子中含有相当数量的氨基酸残基,在氧分子或其他氧化剂作用下,半胱氨酸残基的巯基易被氧化[12]。因此,在实验过程中采用抽真空的方法,来提高HPL的酶活,其中pH为8.0,半胱氨酸浓度为1 mmol/L,匀浆转速为12000 r/min,PVP浓度为0.3%,结果如图5所示。
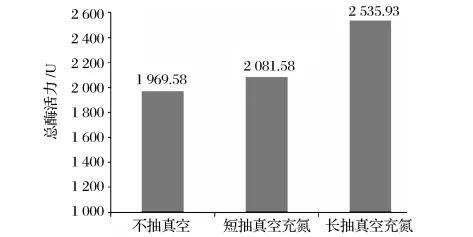
图5 匀浆抽真空对HPL总酶活的影响
由图5可知,匀浆过程中,短时间抽真空后充氮与不抽真空相比,HPL的总酶活有一定的提高,提高的幅度不是很大;长时间的抽真空充氮后HPL的酶活有明显的提高,幅度达到30%。当抽真空的时间增加到2.5h后,不仅空气中没有氧气,植物细胞中的氧气也被除去,整个体系基本是无氧的,在匀浆过程中可以避免HPL与氧气接触而被氧化。通过这一实验结果能够说明,在HPL提取的过程中,氧气会使HPL氧化失活,导致HPL的总酶活降低,在提取HPL过程中,除去氧气后,能明显提高HPL的总酶活。
3 结论
以苋菜为研究对象,得到一条高效提取HPL酶的工艺流程:在12 000 r/min的转速下,以pH 8.0的含有1 mmol/L半胱氨酸和0.3%PVP为缓冲液提取HPL,得到的HPL酶具有很高的酶活。此外,在提取HPL的过程中,氧气会使HPL氧化失活,导致HPL的总酶活降低,提取过程完全除去氧气后,能明显提高HPL的总酶活。
[1] Tressl R,Drawert F.Biogenesis of banana volatiles[J].J Agric Food Chem,1973,21(4):560-565.
[2] Vick B A,Zimmerman D C.Lipoxygenase and hydroperoxide lyase in germinating watermelon seedlings[J].Plant Physiol,1976,57(5):780-788.
[3] 龙祯等,氢过氧化物酶的筛选和纯化[J].食品与发酵工业,2011,37(2):17 -20.
[4] Muller,Chambesy,Antoine Gautier,et al.Process for the enzymatic preparation of alip hatic alcohols and aldehydes from linoleic acid,linolenic acid,or a natural precursor[P].US patent,1995(11):5,464,761.
[5] Vick B A.A spectrophotometric assay for hydroperoxide lyase[J].Lipids,1991,26(4):315 –320.
[6] Gunawan M A and Barringer H A.Green color degradation of blanched broccoli(Brassica Oleracea)due to acid andmicrobial growth[J].Journal of Food Processing and Presearavation,2007,24(3):253–263.
[7] Matsui K,Ujita C,Fujimoto S-H,et al.Fatty acid 9-and 13-hydroperoxide lyases from cucumber[J].FEBS Lett,2000,481(2):183-188.
[8] Noordermeer M A,Veldink G A,Vliegenthart J F G.Spectroscopic studies on the active site of hydroperoxide lyase;the influence of detergents on its conformation[J].FEBS Letters,2001,489(2/3):229-232.
[9] Sekiya J,Tanigawa S,Kajiwara T,et al.Fatty acid hydroperoxide lyase in tobacco cells cultured in vitro[J].Phytochemistry,1984,23(11):2 439-2 443.
[10] Williams M,Salas J J,Sanchez J et al.Lipoxygenase pathway in olive callus cultures(Olea europaea)[J].Phytochemistry,2000,53(1):13-19.
[11] Noordermeer M A,van-Dijken A J H,Smeekens S C M,et al.Characterization of three cloned and expressed 13hydroperoxide lyase isoenzymes from alfalfa with‐unusual N-terminal sequences and different enzyme kinetics[J].‐ Eur J Biochem,2000,267(9):2473-2482.
[12] 施巧琴.酶工程[M]北京:科学出版社,2005:400-412.
[13] Husson F,Bompas D,Kermasha S,et al.Biogeneration of 1-octen-3-ol by lipoxygenase and hydroperoxide lyase activities of Agaricus bisporus[J].Process Biochem,2001,37(2):177-182.
Extraction Technology of Hydroperoxide Lyase from Amaranth tricolor
Xiong Jie,Liu Qing-qing,Kong Xiang-zhen,Zhang cai-meng,Hua Yu-fei
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
In higher plant,hydroperoxide lyase(HPL)catalyzed the cleavage of hydroperoxide,which converted from linoleic or linolenc acid by LOX,to give C6 volatile aldehyes together with ω – oxoacids.These volatile aldehydes are important contributors to the distinctive scent of fresh fruits and vegetables,C6 aldehydes are an important flavor additive in food industry and chemical industry.Based on the single-factor tests,combination of the extraction parameters was optimized by using four-factor-three-level orthogonal test.The optimum conditions were determined as follows:speed 12 000r/min,pH=8.0,contained 1mmol/L cysteine and 0.3%(m/v)PVP as a buffer.Under that condition,the total enzyme activity of HPL was high.We also explored the effect of the vacuum the extraction of HPL and found that if the HPL was extracted under the condition of complete oxygen removal,its total enzyme activity would be significantly improved.
Hydroperoxide lyase,Amaranth tricolor,total enzyme activity,vacuum
在读硕士(华欲飞教授为通讯作者)。
*国家863计划基金(2008AA10Z305);中央高校基本科研业务费专项资金资助(JUSRP10919)。
2011-09-01,改回日期:2011-10-14

