豆渣菌糠浅盘发酵制备微小毛霉凝乳酶的研究
郑恒光 陈君琛 汤葆莎 张炎灼
豆渣菌糠浅盘发酵制备微小毛霉凝乳酶的研究
郑恒光 陈君琛 汤葆莎 张炎灼
(福建农业科学院农业工程技术研究所,福州 350003)
为考察将豆渣和金针菇菌糠这两种废弃资源应用于微小毛霉凝乳酶固态浅盘发酵的效果,以医用托盘作为发酵容器,以干燥后的豆渣菌糠1∶1(质量比)混合物为培养基,以固液比1∶1(质量比)加水润湿培养基,121℃灭菌冷却后接种微小毛霉进行发酵。发酵72 h时,加水提取酶,将酶液进行浓缩、盐析、透析以及冷冻干燥后获得凝乳酶粉末。结果显示,以豆渣和菌糠混合物为发酵培养基时,其单位发酵面积最大产酶量可达到1 860 SU/cm2,略高于对照麦麸1 618 SU/cm2的发酵水平,这表明豆渣和菌糠混合物能够替代麦麸用于微小毛霉凝乳酶的固体浅盘发酵。此外,酶提取液经初步分离纯化,可获得凝乳活力为7 497 SU/mg、水解酶活为0.22 Ucas/mg、纯度大于50%的凝乳酶粉末制剂。
豆渣 菌糠 凝乳酶 微小毛霉 固态浅盘发酵
豆渣废弃资源的综合利用是粮油加工行业的研究热点之一。已有不少研究表明,豆渣在发酵领域有可能得到应用,这其中包括柠檬酸发酵[1]、酶制剂发酵[2]、抗生素发酵[3]、壳聚糖发酵[4]等。另一方面,凝乳酶是制作奶酪和凝乳型干酪素等牛奶深加工产品必不可少的生化制剂,是世界大宗工业酶制剂,其传统来源是吃奶的小牛皱胃第四胃,现已大量被微生物凝乳酶替代。本研究利用微小毛霉(Mucor pusillus)将豆渣资源转化为凝乳酶制剂,可为豆渣资源的利用提供新思路。
工厂化栽培金针菇的栽培料主要由木屑、麦麸、棉籽壳等成分组成,一般只出1潮菇,栽培结束后,尽管纤维素、半纤维素和木质素被大量利用,但仍含有蛋白质等营养物质。本研究前期的三角瓶固体发酵凝乳酶试验表明,在豆渣培养基中掺入一定数量的金针菇菌糠不仅可以阻止豆渣结团,而且还能提高发酵酶活[5]。为了更加贴近生产实际,本文将在前期使用三角瓶进行固体发酵的研究基础上,改用医用托盘模拟规模化固体浅盘发酵工艺,优化参数,初步分离纯化凝乳酶。
1 材料与方法
1.1 材料
豆渣:制作豆腐后的残渣,60℃烘干后低温-20℃保存,其主要成分见表1。
金针菇菌糠:福州尖峰食用菌厂,60℃烘干后室温保存,其主要成分见表1。
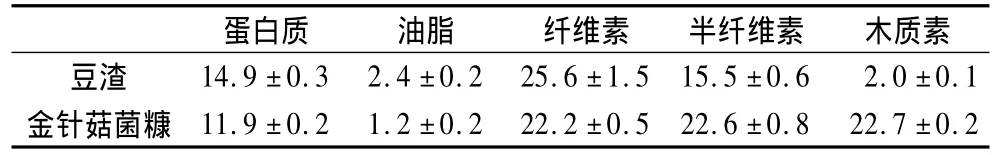
表1 发酵原料的化学成分分析(干基,%)
供试微小毛霉(Mucor pusillus)菌种:中国普通微生物菌种保藏管理中心,菌种编号为3.3445。
麦麸:福州市粮食市场;考马斯亮蓝G-250、R-250染料:美国Sigma公司进口分装;酪蛋白:自制;其他试剂均为分析纯。
1.2 主要设备
YX280B电热手提高压蒸汽消毒器:上海三申医疗器械有限公司;LHS-150SC恒温恒湿箱:上海一恒科技有限公司;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;GL10MD高速冷冻离心机:湘仪离心机仪器有限公司;R205型旋转蒸发器:上海申生科技有限公司。
1.3 方法
1.3.1 化学成分分析方法
粗蛋白(凯氏定氮法):GB/T 5009.5—2003;粗脂肪(索氏抽提法):GB/T 5009.6—2003;粗纤维含量:GB/T 5009.10—2003;灰分:GB/T 5009.4—2003。
1.3.2 培养基配制
①PDA平板培养基。马铃薯 200 g,葡萄糖20 g,琼脂20 g,水1 000 mL,pH 自然。②对照麦麸发酵培养基。将麦麸和水以固液比1∶1(质量比)均匀混合,平摊在医用托盘上,加盖后包裹4层纱布,121℃灭菌20 min,冷却备用。③发酵试验组培养基配制。将干燥后的豆渣和干金针菇菌糠以1∶1(质量比)比例混合,再以固液比1∶1(质量比)加水混合,平摊在医用托盘上,加盖后包裹4层纱布,121℃灭菌20 min,冷却备用。
1.3.3 接种及培养方法
①无菌条件下将少量无菌水加入到菌种试管斜面,用接种铲刮出孢子,涂布于PDA平板,将平板置于28℃恒温箱内培养6 d。②无菌条件下往长满孢子的PDA平板加入10 mL无菌水,用接种铲将孢子刮入水中,于显微镜下检测孢子浓度,用无菌水将孢子悬浮液浓度稀释到大约106个/mL,以2%体积将孢子悬浮液接种于上述盛装于医用托盘的灭菌培养基中,无菌操作将医用托盘内的培养料用接种铲扒松,盖上医用托盘的盖子,外层包裹4层纱布,放入恒温恒湿培养箱中,在35℃,相对湿度85%环境下静止培养3 d。
1.3.4 酶提取
发酵结束后,从医用托盘中取出培养基,以1∶10(体积比)加水,用组织捣碎机将加水后的培养基捣碎,放置0~4℃冰箱过夜,过滤提取液,检测酶活力。
1.3.5 凝乳酶活检测[6]
用0.01 mol/L的氯化钙液配制10%脱脂奶粉液,此溶液配制后在室温放置40 min以上使用,当天使用有效,不宜冰箱放置。取5 mL 10%的脱脂奶粉液在35℃保温10 min,加0.5 mL适当稀释的酶液(35℃保温),立即摇匀,开始计时(凝乳时间控制在40~90 s),并把试管倾斜45°以上。沿试管周旋转,观察壁上出现小颗粒为终点,记录凝乳时间。依据Soxhlet酶活定义(SU),SU=2 400/T ×5/0.5×D。式中:T为凝乳时间/s;D为稀释倍数。
每g发酵培养基所产生的酶活力(SU/g)=SU×V/g。式中:V为提取液体积,g为所用固体发酵培养基的克数。
1.3.6 单位发酵面积产酶量
计算公式为:单位发酵面积产酶量(SU/cm2)=医用托盘单位面积装料量(g/cm2)×每克发酵培养基所产生的酶活力(SU/g)
1.3.7 水解酶活检测[7]
使用pH 6.5磷酸缓冲液配制1 g/100 mL的酪蛋白溶液,取1.1 mL溶液加入4 mL离心管内,再加入0.1 mL酶液,放入45℃水浴锅中保温2 min后加入1.8 mL质量浓度为5 g/100 mL的三氯乙酸溶液终止反应,将离心管7 000×g离心20 min,取上清液测定280 nm吸光度,将1 min内吸光度OD280nm=1所需酶量定义为1个单位水解酶活力,计算公式为:1 Ucas=OD280nm/2 min。
1.3.8 酶液中的蛋白质含量测定[8]
使用考马斯亮蓝G-250染料对酶液染色,以牛血清白蛋白(BSA)作为标准品,检测595 nm吸光度,计算蛋白含量。
1.3.9 凝乳酶盐析曲线测定
取2 mL酶溶液加到4 mL离心管内,加一定量的(NH4)2SO4或0℃乙醇使蛋白质沉淀,7 000×g离心5 min后弃去上清液,往每支离心管中加入2 mL去离子水使用离心沉淀的蛋白质重新溶解,检测溶液酶活。以(NH4)2SO4或乙醇加入量为横坐标,以酶活为纵坐标做图,即为凝乳酶盐析曲线。
1.3.10 凝胶电泳检测凝乳酶纯度[8]
采用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)对蛋白质进行量化,分离胶质量分数为10%,染色剂为考马斯亮蓝R-250。
1.3.11 数学统计方法
试验数据均为2次平行试验的算术平均值。
2 结果与分析
2.1 豆渣菌糠固体浅盘发酵工艺对产酶量的影响
豆渣菌渣1∶1(质量比)混合固体浅盘发酵的单因素试验表明,最适发酵温度为35℃、发酵天数为3 d、接种浓度≥106个/mL、接种量5%(体积比),这些参数和前期三角瓶发酵结果[5]基本一致(数据略)。进一步试验还发现,固体浅盘发酵的装料厚度对单位发酵面积产酶量具有较大的影响(图1)。在低装料量时(如:0.05 g/cm2时),单位面积产酶量高低次序为:对照麦麸>对照豆渣>豆渣+菌糠;而在高装料量时(如:0.2 g/cm2时),单位面积产酶量高低次序则变成:豆渣+菌糠>对照麦麸>对照麦麸。其中,豆渣+菌糠组在装料量为0.217 g/cm2时,最高单位发酵面积的产酶活力为1 860 SU/cm2,高于对照麦麸在装料量为0.29 g/cm2时的1 618 SU/cm2的发酵水平。
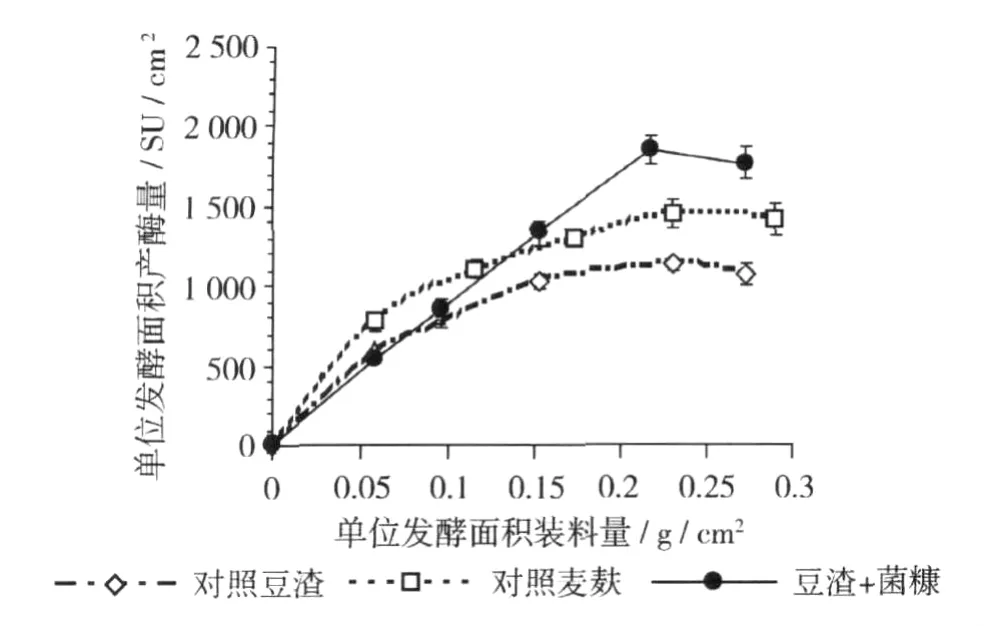
图1 浅盘发酵装料厚度对单位发酵面积产酶量的影响
众所周知,麦麸在发酵工业中具有广泛的应用,而豆渣在发酵中的应用多数仅停留在研究层面上。豆渣含有大量的纤维,吸水性很强,容易结团不利于发酵过程中通风散热。麦麸也含有一定量的纤维,但吸水性不如豆渣强,此外麦麸还含有10%的淀粉,因此,灭菌后的麦麸同样存在结团的问题。豆渣中加入金针菇菌糠后,菌糠内的大量木屑、麦麸和棉籽壳等不仅可以对豆渣培养基起到疏松的作用,而且其含有的营养物质也能被微小毛霉利用,其单位面积产酶量超过了对照麦麸。这使得豆渣和菌糠这两种废弃资源都得到了较好的利用。
2.2 提取液浓缩工艺对凝乳酶活力的影响
采用旋转蒸发器浓缩酶提取液,浓缩至原体积的1/20需要耗时3~4 h。浓缩温度越高越有利于水分蒸发,但过高的温度会导致酶失活。由表2可见,在55℃下浓缩时,凝乳酶失去大部分酶活力,选择52℃以下浓缩比较合适,该结果和参考文献报道的微小毛霉凝乳酶变性温度为55℃一致[9]。如使用膜过滤设备,可先采用微滤膜除去酶液中的孢子和杂质,再用超滤膜截留浓缩,最后用旋转蒸发器或薄膜蒸发器对黏稠液进行进一步浓缩,这样不仅可以加快浓缩速度,降低能耗,还可以缩短凝乳酶在旋转蒸发时受热时间,减少酶活力损失。

表2 旋转蒸发温度对凝乳酶活力的影响
2.3 凝乳酶分离纯化方法研究
微小毛霉具有较强的营养物质利用能力,它可利用豆渣和菌糠中的纤维素为发酵碳源,但其发酵产物成分复杂,含有可溶性多糖、纤维素酶、蛋白水解酶、脂肪酶等多种成分。其中,蛋白水解酶会分解乳蛋白产生苦味肽,使奶酪带有苦味。此外,发酵产物中还可能含有危害健康的成分。因此,粗酶液的分离纯化步骤显得十分必要。
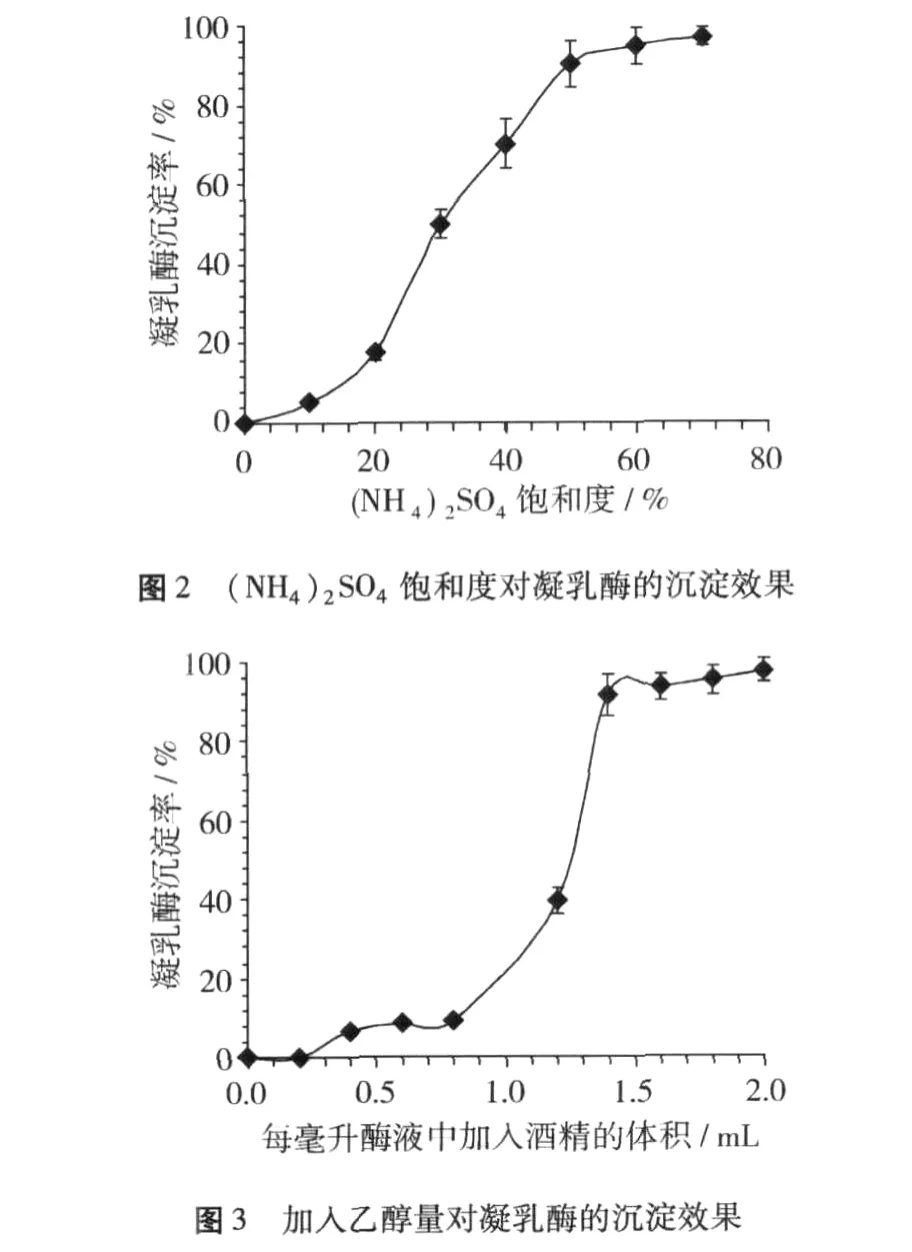
(NH4)2SO4和乙醇分级盐析是初步纯化蛋白质的常用方法。依据(NH4)2SO4沉淀效果(图2),将酶浓缩液预冷到0℃,加入(NH4)2SO4固体,使酶液饱和度达到20%,5 000 r/min—10 min—0℃离心后收集上清液,再加入(NH4)2SO4固体使溶液饱和度由20%上升至70%,5 000 r/min—10 min—0℃离心后收集沉淀即为凝乳酶纯化样品。对于乙醇沉淀,根据其沉淀效果(图3),先加入0.8体积预冷到0℃的95%乙醇,5 000 r/min—10 min—0℃离心后弃去沉淀,然后再向上清液中加入0.6倍体积的0℃、95%乙醇,5 000 r/min—10 min—0℃离心后收集沉淀,采用0℃去离子水重新溶解沉淀,透析、冷冻干燥后成为凝乳酶粉末。试验发现,酶提取液(NH4)2SO4沉淀除去了大量的可溶性多糖,再经过乙醇沉淀除去了大量深色物质,同时乙醇沉淀还使发酵和菌糠带来的异味几乎完全脱除。
从表3可见,经过两步沉淀后,凝乳酶得率为61.2%,凝乳酶比活由1 250 SU/mg提高到4 297 SU/mg,提高了3.4 倍,而水解活力从0.934 Ucas/mg下降到0.22 Ucas/mg。由参考文献[10]可知,纯微小毛霉凝乳酶的酶活力为8 800 SU/mg,据此可推算出本试验制备的凝乳酶纯度为48.8%,该数值和电泳分析结果基本一致(图4)。从图4中还可以看出,粗酶提取液中凝乳酶占总蛋白质的比例还不到20%(泳道2),而纯化后凝乳酶的纯度得到大幅度提高,达到50%以上(泳道4)。豆渣中的蛋白质7S及11S等组分基本没有出现在酶提取液中,这说明豆渣中的蛋白质几乎被微小毛霉高效转化利用。菌糠中可溶性蛋白质较少,电泳图谱中几乎检测不到蛋白质(泳道3)。
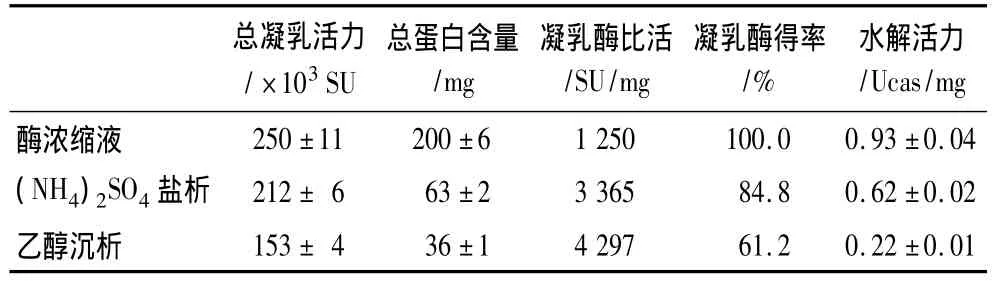
表3 微小毛霉凝乳酶的纯化结果
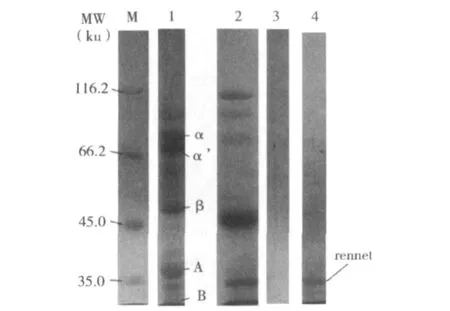
图4 豆渣、粗酶提取液、菌糠以及凝乳酶纯化样品的电泳图
3 结论
湿豆渣容易结团,因而不能直接用于固体浅盘发酵。豆渣中若以1∶1(质量比)比例掺入金针菇菌糠,则其浅盘发酵性能得到明显改善,最高单位面积产酶量可达到1 860 SU/cm2,超过对照麦麸1 618 SU/cm2的发酵水平。凝乳酶提取液浓缩后再经过(NH4)2SO4和乙醇两步骤分级沉淀,纯度提高了3.4倍,达到48.8%,凝乳活力也提高到4 297 SU/mg,水解酶活力则由0.93 Ucas/mg降至 0.22 Ucas/mg,并且还去除了大量可溶性多糖和其他杂质,使凝乳酶的气味和食品安全性得到了提高,显示了豆渣和菌糠资源在发酵转化凝乳酶方面具有应用前景。
[1]Khare SK,Jha K,Gandhi AP.Citric acid production from okara(soy- residue)by solid- state fermentation[J].Bioresour Technol,1995a,54:323-325
[2]朱萍,严萍,周河治.根霉Ycl发酵豆渣产纤溶酶的研究[J].安徽农业科学,2009,37(32):15971-15973
[3]Akihiro Ohno,Takashi Ano,Makoto Shoda.Use of Soybean Curd Residue,Okara,for the Solid State Substrate in the Production of a Lipopeptide Antibiotic,Iturin A,by Bacillus subtilis NB22[J].Process Biochemistry,1996,31(8):801- 806
[4]W Suntornsuk a,P Pochanavanich a,L Suntornsuk.Fungal chitosan production on food processing by- products[J].Process Biochemistry,2002,37:727-729
[5]郑恒光,汤葆莎,张炎灼,等.豆渣及金针菇菌渣混合发酵制备凝乳酶的研究[J].现代食品科技,2010,26(12):1345-1348
[6]Chwen- Jen Shieha,Lan- Anh Phan Thib,Ing- Lung Shih.Milk-clotting enzymes produced by culture of Bacillus subtilis natto[J].Biochemical Engineering Journal,2009,43:85-91
[7]Mariela A Bruno,Cristian M Lazza,Mar1'a E Errasti,et al.Milk clotting and proteolytic activity of an enzyme preparation from Bromelia hieronymi fruits[J].Food Science and Tech-nology,2010,43:695-701
[8]汪家政,樊明.蛋白质技术手册[M].北京:科学出版社,2000
[9]矫庆华,钱世钧,孟广震.微小毛霉凝乳酶的生物合成和性质的研究[J].微生物学报,1992,32(1):30-35
[10]GA Somkuti,FJBabel.Purification and Properties of Mucor pusillus Acid Protease[J].Journal of bacteriology,1968,4:1407-1414.
Study on Shallow Tray Fermentation for Fine Mucor Pusillus and Rennin with Bean Dregs and Germ Bran
Zheng Hengguang Chen Junchen Tang Baosha Zhang Yanzhuo
(Research Institute of Agri- e ngineering Tech-nology,Fujian Academy of Agricultural Sciences,Fuzhou 350003)
In order to investigate the effect of the solid-state shallow tray fermination for fine mucor pusillus and rennin with bean dregs and Flammulina velutiper(Fr.)sing germ bran,a medical tray was used as a fermentation container,and the dried mixture of bead dregs and germ bran[1∶1(w∶w)]was used as a culture medium,which was wetted with water(the ratio between the solid and liquid was 1∶1,namely w∶w).Then prepared culture medium was sterilized by virtue of a high temperature hitting 121℃ After the sterilization and cold-down,the prepared culture medium was inoculated with strains of fine Mucor pusillus for a 72-hour fermentation.Then water was added and enzyme was extracted and rennet powder was prepared after steps of concentration,salting out,dialysis and freeze drying.The result showed that the highest enzyme yield of each unit area reached 1 860 SU/cm2when the mixture of bean dregs and germ bran were used as culture medium.This yield value is a litter higher than that of the wheat bran group(1 618 SU/cm2),which indicated that the mixture of beandregs and germ bran was promising as the wheat bran substitute in shallow tray fermentation of fine Mucor and rennet.In addition,after preliminary separation and purification,a rennet powder which had a milk- clotting activity of 7 497 SU/mg,hydrolase activity of 0.22 Ucas/mg and purity over 50%was obtained.
bean dregs,germ bran,rennin,fine Mucor pusillus,solid-state shallow tray fermentation
TS214.2
A
1003-0174(2011)12-0088-05
福建省公益类科研院所专项(2010R1017-1),福建农科院“食品科学”创新团队建设基金(STIF-Y05)
2010-03-14
郑恒光,男,1970年出生,助理研究员,粮食、油脂及植物蛋白工程
陈君琛,男,1959年出生,研究员,植物保护

