干热和湿热工艺对大豆转基因成分及调控元件影响的比较研究
王 林 韩 飞 李爱科 韩 伟 刘建学
干热和湿热工艺对大豆转基因成分及调控元件影响的比较研究
王 林1,2韩 飞1李爱科1韩 伟1刘建学2
(国家粮食局科学研究院1,北京 100037)
(河南科技大学食品学院2,洛阳 471003)
以转基因大豆为试验材料,运用定性PCR的方法研究了干热和湿热两种制粒加工工艺对转基因大豆内源基因Lectin、外源基因Cp4 epsps以及启动子和终止子的影响。结果发现大豆经过130℃干热处理3 min或100℃湿热处理15 min后,内源基因降解到407 bp以下;经过120℃加热9 min或100℃湿热处理15 min后,外源基因降解到408 bp以下;干热处理对启动子的片段长度并没有影响,而当加工条件达到130℃干热9 min时,终止子125 bp的片段开始会产生降解;当100℃、3 min湿热处理后启动子和终止子都会产生降解。结果表明,不同干热和湿热制粒工艺对大豆转基因成分及调控元件的降解均有不同程度的影响。
加工工艺 基因 启动子 终止子 PCR技术
随着转基因技术的飞速发展,近年来转基因产品开发研究不断深入,越来越多的转基因农产品商品化,相应的转基因农产品市场占有率也明显增加。转基因大豆及其制品日益增多,己经直接或间接地影响到人们的生活。也正因如此,转基因大豆及其制品对人体健康及生态环境的影响引起人们的广泛关注。大豆加工过程中DNA的量及降解程度都因其加工工艺不同而不同,全面了解大豆加工过程中内外源基因及调控元件的降解变化规律对规范大豆生产工艺、提高其相关产品的管理力度具有重要的现实意义。
本研究参考主要原料大豆转基因品系和外源基因种类,以大豆凝集素基因(Lectin)为内标基因[1-2],设计了不同引物来检测其外源基因Cp4 epsps、启动子CaMv35s和终止子Nos,从核酸定性分析水平上,利用PCR技术研究干热和湿热的制粒加工工艺对大豆中内外源基因、启动子及终止子片段长度的影响,建立定性PCR检测转基因大豆的特异性检测方法。
1 材料与方法
1.1 材料与试剂
转基因大豆:河北三河汇福粮油有限公司;液氮:北京城信顺兴气体原料销售有限公司;苯酚:上海源景化学品有限公司;氯仿、乙醇(分析纯):北京化工厂;TE缓冲液:上海索莱宝生物科技有限公司;Taq酶、DNA Marker:大连宝生物工程有限公司;Goldenview核酸染料:北京天恩泽基因科技有限公司;琼脂糖:北京拜尔迪生物公司。
1.2 仪器与设备
PL403-IC电子天平:梅特勒-托利多仪器有限公司;DK-8D电热恒温水槽、DGG-9140AD电热恒温鼓风干燥箱:上海森信实验仪器有限公司;温育机(ThermoStat plus)、PCR 扩增仪(Mastercycler 5333)、离心机(5424)、混匀器(Thermomixer comfort):德国艾本德公司;DYY-8C电泳仪:北京六一化工厂。
1.3 试验方法
1.3.1 引物的设计
针对Lectin基因设计了3对引物序列,扩增片段大小分别为 1 060 bp、836 bp、407 bp,针对 Cp4 epsps基因设计了3对引物序列,扩增片段大小分别为1 512 bp、408 bp、190 bp,针对启动子 CaMV35 s和终止子各设计了一对引物序列,扩增片段大小分别为165 bp和125 bp。
1.3.2 样品的制备与处理
大豆的干热加工处理:取一定量的转基因大豆粉,放入离心管中,设置8个温度梯度,分别为60、70、80、90、100、110、120、130 ℃,进行干热处理,处理时间分别为3、6、9 min。大豆的湿热加工处理:将大豆置于高压灭菌锅内70、80、90、100 ℃各放置3、9、15 min。
1.3.3 大豆DNA的提取
称取100 mg试样在液氮中充分研磨成粉状至1.5 mL离心管中,加入1 mL、65℃预热的CTAB抽提缓冲液,充分均匀混合后置恒温箱中65℃温育30 min,其间充分颠倒混匀2~3次。12 000 r/min室温下离心10 min,取上清液至新的离心管中,用等体积苯酚/氯仿溶液(1∶1)抽提,充分混匀。12 000 r/min离心10 min,取上清液后再用等体积的氯仿抽提一次。12 000 r/min离心10 min。转移上清于0.6倍体积经-20℃预冷的异丙醇中,并在-20℃下静置30 min,12 000 r/min离心20 min以沉淀 DNA。弃上清,加入1 mL-20℃预冷的70%乙醇清洗沉淀物,短时间离心后弃乙醇,重复洗涤过程一次。在吸水纸巾上风干,直至乙醇挥发殆尽。干燥后加入100μL TE缓冲液,-20℃保存备用。
1.3.4 PCR 的扩增
PCR反应体系:5μL PCR反应缓冲液,2 mmol Mg2+,1.25U Taq 酶,dATP、dCTP、dGTP、dTTP 各0.2 mmol/L,0.4 μmol/L 引物,一定量的模板 DNA,灭菌超纯水补齐至50μL。
Lectin基因PCR反应条件:95℃预变性5 min,95 ℃变性 30 s,62.1 ℃ (60.8、58.1℃)退火 90 s(60、60 s),72 ℃延伸90 s(60、60 s),40 cycles,72 ℃延伸5 min。
Cp4 epsps基因 PCR反应条件:95℃预变性5 min,95 ℃变性 30 s,60.3 ℃(57、60 ℃)退火 90 s(60、60 s),72 ℃ 延伸 90 s,40 cycles,72 ℃ 延伸5 min。
CaMv基因PCR反应条件:95℃预变性5 min,95 ℃变性 30 s,54.5 ℃ 退火 60 s,72 ℃ 延伸 90 s,40 cycles,72 ℃延伸 5 min。
Nos基因PCR反应条件:95℃预变性5 min,95 ℃变性30 s,45.5 ℃ 退火 60 s,72 ℃ 延伸 90 s,40 cycles,72 ℃延伸 5 min。
1.3.5 PCR 产物检测
引物 Lec3/Lec3.、引物 Cp2/Cp2.、引物 Cp3/Cp3.、引物 CaMv1/CaMv1.、引物 CaMv2/CaMv2.、引 物 CaMv3/CaMv3.、引 物 Nos1/Nos1.、Nos2/Nos2.在2.0%的琼脂糖凝上 100 V恒压,电泳35 min。
引物 Lec1/Lec1.、引物 Lec2/Lec2.、引物 Cp1/Cp1.、引物 EPSPS1/EPSPS1.、在 1.0% 琼脂糖凝胶上100 V恒压,电泳35 min。完毕后置凝胶成像仪中记录结果。
2 结果与分析
2.1 干热处理对大豆内源基因的影响
2.1.1 干热处理对内源基因Lectin的影响
图1至图3所示为不同的干热处理条件(温度梯度分别为 60、70、80、90、100、110、120、130 ℃ 各进行干热处理,处理时间分别为3、6、9 min)下,内源基因Lectin 1 060 bp、Lectin 836 bp和Lectin 407 bp片段的降解情况。
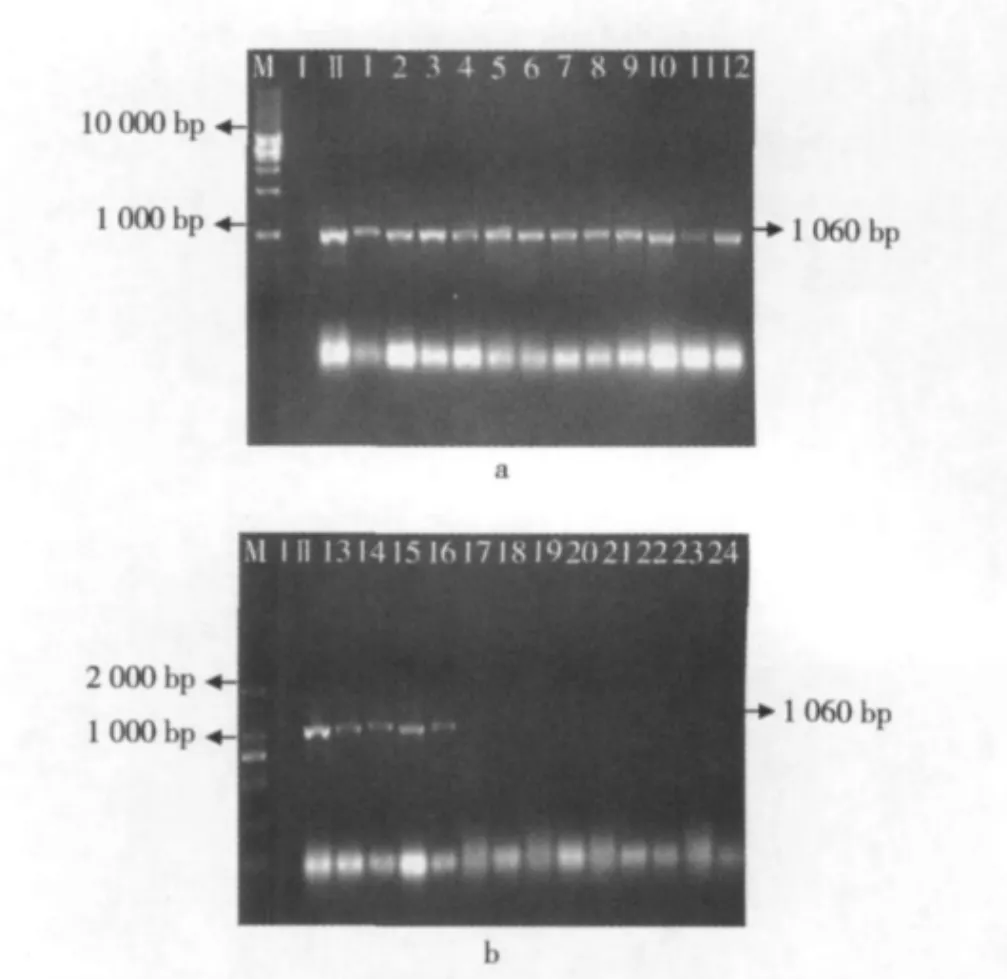
图1 大豆经过干热处理后Lectin 1 060 bp片段的PCR扩增电泳图
由图1a可以看出,在1~16的干热条件下Lectin 1 060 bp片段没有产生降解;而在17~24(图1b)中,内源基因Lectin 1 060 bp片段已检测不出。
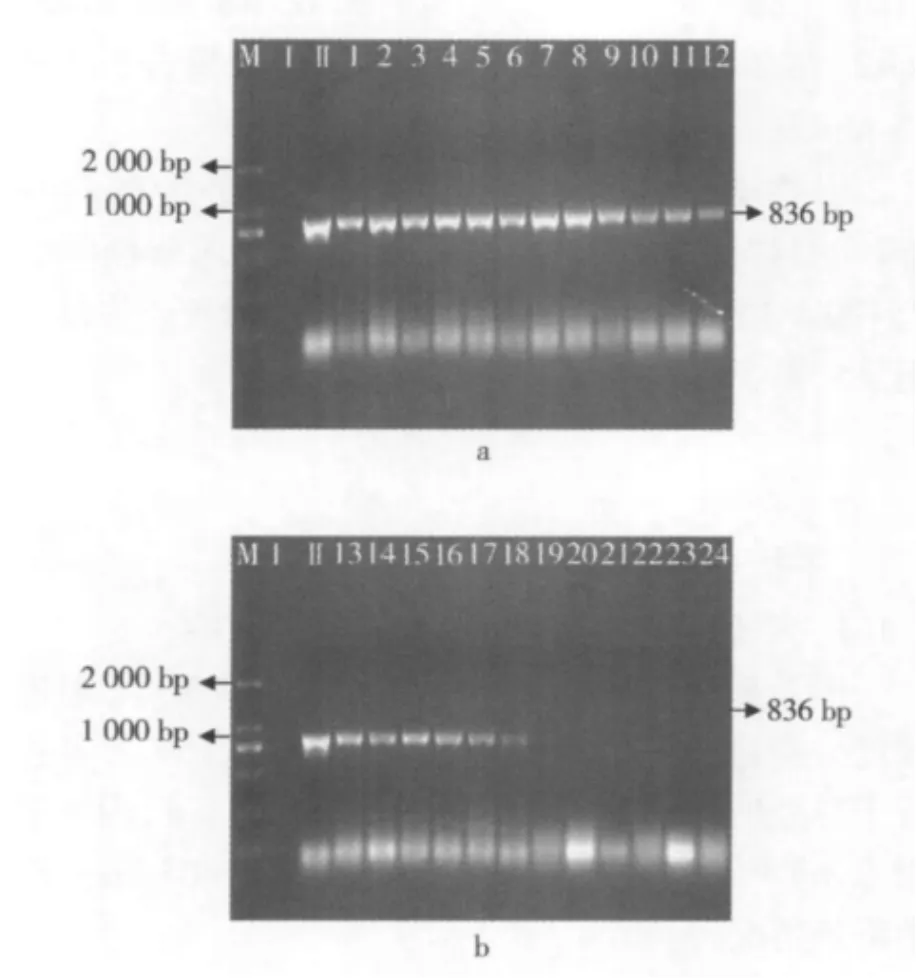
图2 大豆经过干热处理后Lectin 836 bp片段的PCR扩增电泳图
由图2a可以看出,在1~18的干热条件下Lectin 836 bp片段没有产生降解;而在19~24(图2b)中,内源基因Lectin 836 bp片段已检测不出。
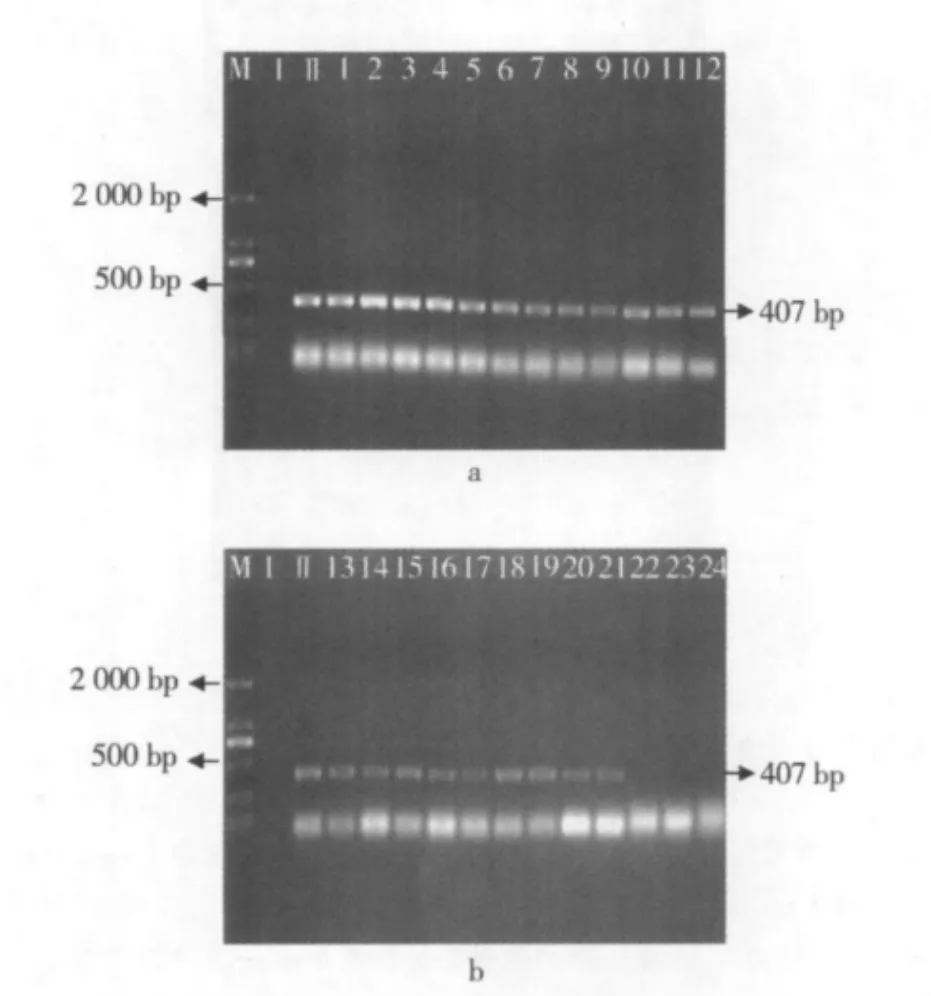
图3 大豆经过干热处理后Lectin 407 bp片段的PCR扩增电泳图
由图3a可以看出,在1~12的干热条件下Lectin 407 bp片段没有产生降解情况;而在22~24(图3b)中,内源基因Lectin 407 bp片段已检测不出。
图1~图3可知,从60℃一直加热到100℃所测Lectin基因片段都未出现降解情况,但经过110℃,6 min处理后,1 060 bp片段开始被降解(图1b),不能再检测到;当温度升高到120℃,时间到达3 min时,836 bp的DNA片段不能被检测到(图2b);随着时间的延长,当条件达到130℃,3 min时Lectin逐渐被降解到407 bp以下(图3b)。
2.1.2 干热处理对外源基因Cp4 epsps的影响
图4至图6所示为不同的干热处理条件(温度梯度分别为 60、70、80、90、100、110、120、130 ℃ 各进行干热处理,处理时间分别为3、6、9 min)下,外源基因 Cp4 epsps 1 512 bp、Cp4 epsps 408 bp和 Cp4 epsps 190 bp片段的降解情况。

图4 大豆经过干热加工后Cp4 epsps1 512 bp片段的PCR扩增电泳图
由图4a可知,在1~12的干热条件下Cp4 epsps 1 512 bp片段并未产生降解情况;而在13~24(图4b)中,外源基因Cp4 epsps 1 512 bp片段已检测不出。
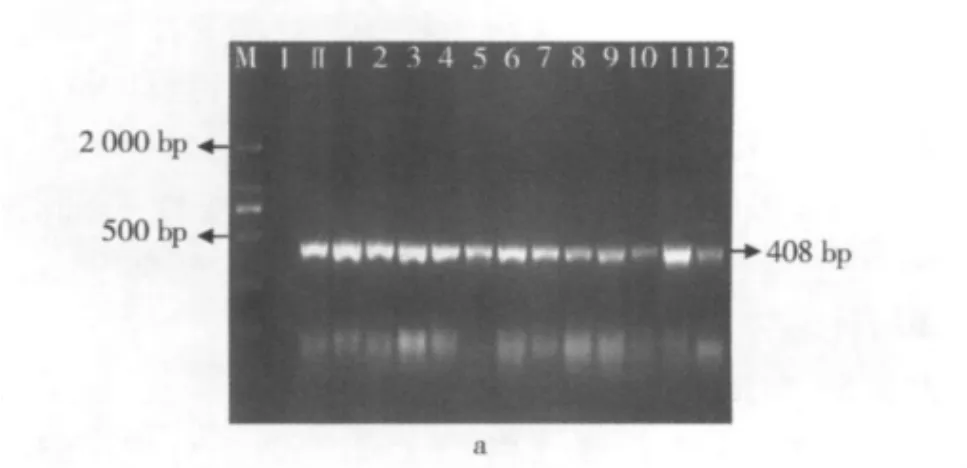

图5 大豆经过干热处理后Cp4 epsps408 bp片段的PCR扩增电泳图
由图5a可知,在1~12干热条件下Cp4 epsps 408 bp片段没有产生降解的情况;而在21~24(图5b)中,外源基因Cp4 epsps 408 bp片段已检测不出。

图6 大豆经过干热处理后Cp4 epsps190 bp片段的PCR扩增电泳图
由图6可知,在1~24(60℃加热3 min到130℃加热9 min)的加工条件下外源基因Cp4 epsps 190 bp片段始终未产生降解的情况。
由图4~图6可知,在60~90℃所测大豆Cp4 epsps基因都未出现降解情况,但大豆经过100℃加热3 min处理后1 512 bp片段就开始被降解了,不能再检测到(图4b);当温度升高到120℃,9 min的时候,408 bp的DNA片段不能被检测到(图5b),DNA逐渐被降解。
2.1.3 干热处理对启动子CaMv 35S与终止子Nos的影响
图7和图8所示为不同的干热处理条件(温度梯度分别为 60、70、80、90、100、110、120、130 ℃各进行干热处理,处理时间分别为3、6、9 min)下,启动子CaMv35S165 bp片段与终止子Nos 125 bp片段的降解情况。

图7 大豆经过干热处理后启动子CaMv 35S165 bp片段的PCR扩增电泳图
由图7可以看出,在1~24(60℃加热3 min到130℃加热9 min)的加工过程中启动子CaMv35S 165 bp片段都未产生降解。

图8 大豆经过干热处理后启动子终止子Nos 125 bp片段的PCR扩增电泳图
由图8可知,当干热条件达到24(130℃加热9 min)时,终止子Nos 125 bp片段已检测不出。
从图 7~图 8可以看出,在 60℃加热3 min到130℃加热9 min加工范围内,干热处理并未对启动子产生很大的影响(图7);而当加工条件达到130℃加热9 min时,终止子125 bp的片段开始产生降解(图8b)。
2.2 湿热处理对大豆基因及调控元件的影响
2.2.1 湿热处理对内源基因Lectin的影响
图9表示的是湿热处理对内源基因Lectin的影响PCR电泳扩增图,湿热处理即是将大豆置于蒸汽高压锅中,不同温度各放置3、9、15 min,当条件达到70℃,3 min时1 060 bp的片段就不能检测到了(图9a),1 060 bp的片段只能在大豆原料中存在;当条件达到100℃,9 min时Lectin的片段就降解到836 bp以下(图9b);当条件到达100℃,15 min时Lectin片段降解到407 bp以下(图9c)。
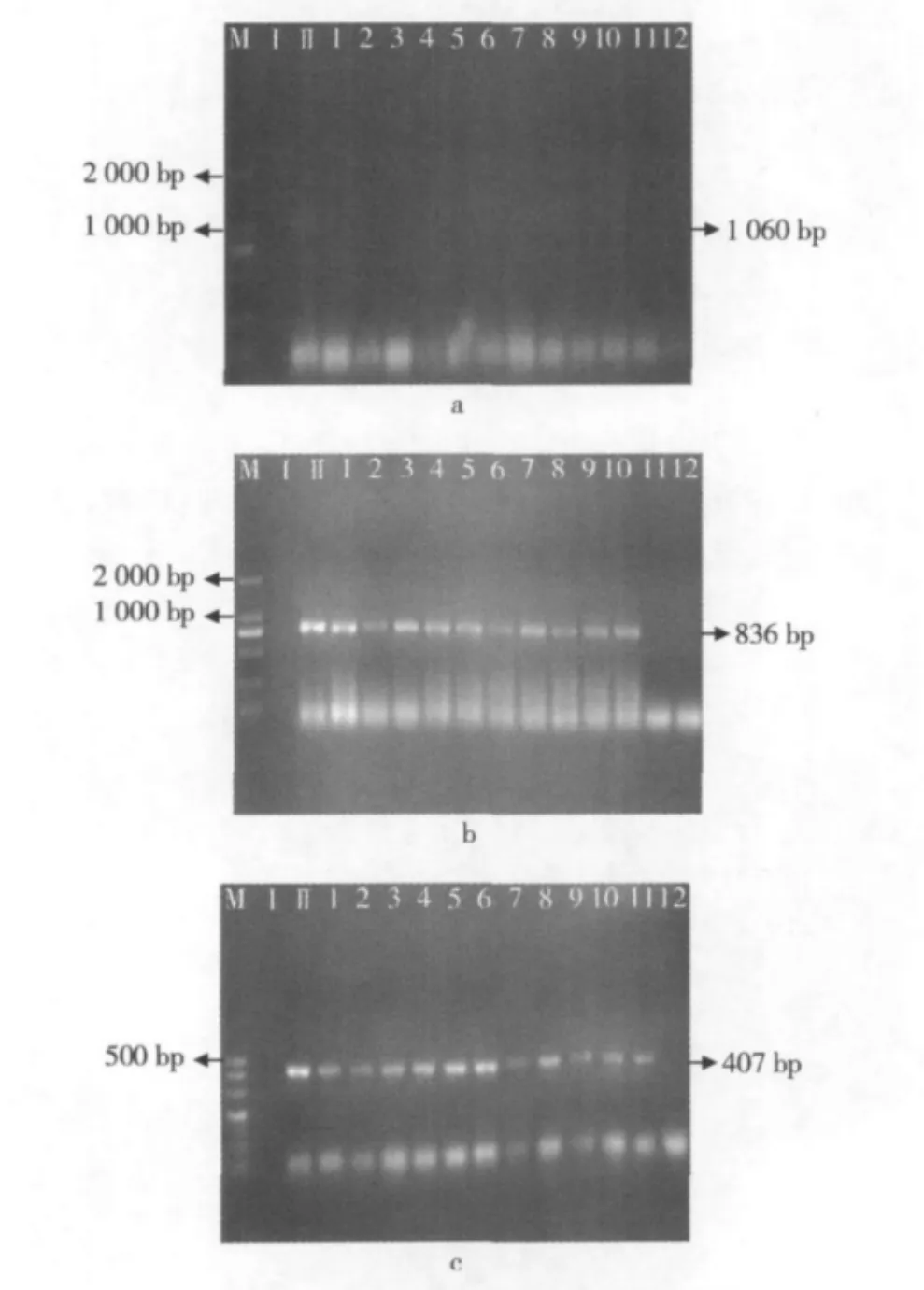
图9 大豆经过湿热处理后不同片段内源基因Lectin的PCR扩增电泳图
2.2.2 湿热处理对外源基因Cp4 epsps的影响
图10为将大豆置于蒸汽高压锅中70、80、90、100℃,各放置3、9、15 min得到 Cp4 epsps基因不同片段的扩增结果图,1 512 bp这样大一些片段在处理90℃湿热9 min已经不能检测到了(图10a);经过100℃湿热15 min处理后408 bp的片段不能被检测到(图10b),190 bp的小片段在所有处理后仍能检测到(图10c)。

图10 大豆经过湿热处理后外源基因Cp4 epsps的PCR扩增电泳图
2.2.3 湿热处理对启动子CaMv35S与Nos终止子的影响
当加工条件达到100℃湿热3 min时,启动子CaMv35S165 bp片段就再也检测不到了(图11a)。当试验条件达到100℃湿热3 min时,终止子Nos 125 bp的片段已经降解(图11b),相比干热处理,湿热加工更能对启动子和终止子产生降解。
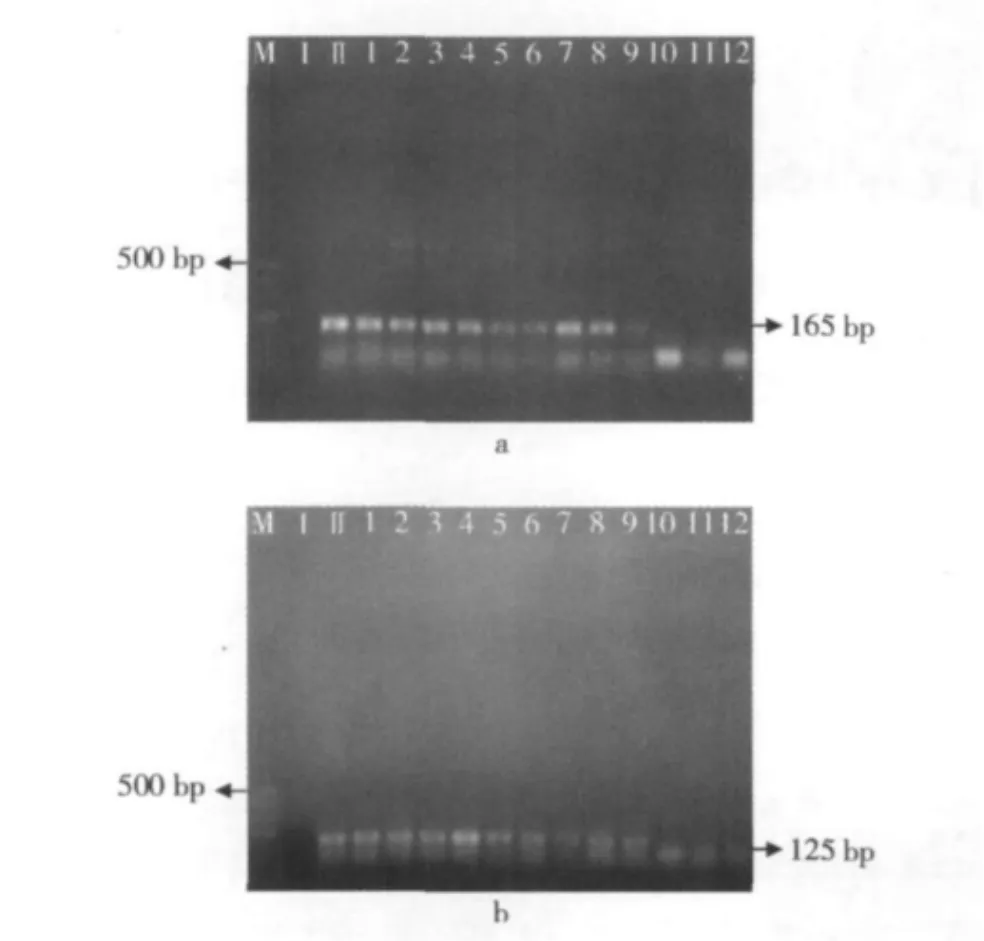
图11 大豆经过湿热处理后启动子CaMv35S与Nos终止子的PCR扩增电泳图
3 讨论与结论
目前市场上大多数的大豆为转基因大豆,从理论上来说,转基因产品经过若干的加工程序,例如物理、化学或者酶因子都会使DNA被破坏[3]。Gawienowski MC等[4]研究表明,经浸泡、湿磨等加工过程能使玉米基因和质粒DNA降解,135℃加热2 h后,DNA几乎完全降解。Rogan等[5]认为,浸泡后又经过物理破碎处理而做成的豆奶、豆腐和热加工做成的玉米糊和马铃薯,没有检测出大于1.1 kb的DNA片段。Chiter等[6]对饲料中的一些植物性原料,如油菜籽、小麦粉、亚麻籽、大豆、新鲜的玉米粉和玉米粒、甜菜及甜菜浆中DNA的稳定性进行了研究。结果表明,对作物原料至少进行5 min不低于95℃的热处理是降解DNA所必需的,但对作物叶片和种子采用如研磨、粉碎等物理方法处理不能有效地降解其DNA。陈颖等[7]研究了大豆在加工为豆腐、豆奶和豆粉过程中各项加工工艺对CaMv启动子和Nos终止子调控元件的影响,发现调控元件在食品加工过程中的降解变化与其所处位置有较大关系,大豆基因组DNA序列片段受加工过程的影响较小,在3种豆制品的加工过程中均能测到,原料经过加工后片段大小降解至200 bp以下;Nos终止子受食品加工工艺影响较小,在被检测的每个食品加工过程中均能检测到。此次试验的目的在于如何利用加工环节破坏转基因成分,降低转基因粮食的食用和使用安全风险,以转基因大豆为原料对其内外源基因及调控元件进行扩增,发现大豆在经过干热和湿热的制粒工艺后,其内源基因Lectin、外源基因Cp4 epsps、启动子CaMv、终止子Nos都会引起不同程度的降解。研究表明,大豆经过130℃干热处理3 min或100℃湿热处理15 min后,内源基因降解到407 bp以下;经过120℃加热9 min或100℃湿热处理15 min后,外源基因降解到408 bp以下;干热处理对启动子的片段长度并没有影响,而当加工条件达到130℃干热9 min时,终止子125 bp的片段开始会产生降解;当100℃,3 min湿热处理后启动子和终止子都会产生降解,不同干热和湿热制粒工艺对大豆转基因成分及调控元件的降解均有不同程度的影响。值得提出的是加工后的食品中含有多种添加剂,与普通原料相比,成分更为复杂,加工工艺更为繁琐,对其中基因的影响可能是多方面的[8-9],因此对加工后产品中基因的降解变化还需要进行深入的研究[10],以进一步明确外源基因以及调控元件造成的潜在风险。
[1]郑文杰,刘火亘,刘伟等.转基因大豆加工产品的定性PCR 检测[J].农业生物技术学报,2003,11(5):467-471
[2]朱元招,尹靖东,李德发等.抗草甘膦转基因大豆PCR定量检测研究[J].中国农业大学学报,2005,10(3):5-29
[3]Hagen M.Detection of genetically modified soy(Roundup -Ready)in processed food products[J].Berl Munch Tierarztl Wochenschr,2000,113(11 -12):454 -458
[4]Gawienowski MC,Eckhoff SR,Ping Y,et al.Fate of maize DNA during steeping wet milling and processing[J].Cereal Chem,1999,76(3):371 -374
[5]Rogan GJ,Dudin YA,Lee TC,et al.Immunodiagnostic methods for detection of enolpyruvyl shikimate phosphate synthase in Roundup Ready or soybeans[J].Food Control,1999,10:407-414
[6]Chiter A,Michael J,Forbes M,et al.DNA stability in plant tissues:implications for the possible transfer of genes from genetically modified food[J].FEBSLetters,2000,481:164 -168
[7]陈颖,王媛,徐宝梁,等.Roundup Ready大豆外源基因在食品加工过程中的降解变化[J].中国油料作物学报,2005,27(2):10 -14
[8]王媛.转基因大豆内、外源基因在食品加工过程中变化规律的研究[D].北京:中国农业大学,2005
[9]朱元招.抗草甘膦大豆转基因PCR检测及其饲用安全研究[D].北京:中国农业大学,2004
[10]梁杉,梁宁,蒋继志,等.转基因豆粕调控元件在饲料加工中降解变化的初步研究[J].华北农学报,2009,2:201-205.
Comparative Study on Degradation of Transgenic Ingredients and Non-target Gene Components of Generally Modified Soybean with Dry-heating and Sticky-heating Processing
Wang Lin1,2Han Fei1Li Aike1Liu Jianxue2Wang Yingyao1
(Academy of State Administration of Grain1,Beijing 100037)
(Institute of Food,Henan University of Science and Tech-nology2,Luoyang 471003)
Based on generally modified soybeans for materials,the qualitative research methods of PCR were adopted to study the effects to Lectin gene and exogenous gene of Cp4 epsps and promoter and terminator by dryheating and sticky- heating processing.Researches showed that endogenous gene degraded below to 407bp through processing after 130℃ dry-heating for 3min or 100℃ sticky-heating for 15 min.Exogenous gene degraded below to 408bp after 120℃ dry-heating for 9 min or 100℃ sticky-heating for 15 min.The DNA fragment of 125bp terminator turned to degrade after 130 ℃ dry-heating for 9min,while it made no difference to promoter.Promoter and terminator turned to degrade after 100℃ sticky-heating for 3 min.The results also indicated that gene sections had all degraded to some extent by dry-heating and sticky-heating palletizing processing.
processing,gene,promoter,terminator,PCR Tech-nology
Q7
A
1003-0174(2011)10-0044-07
转基因生物新品种培育重大专项(2009ZX08012-012B)
2010-10-22
王林,男,1985年出生,硕士,生物技术
韩飞,女,1973年出生,副研究员,博士,食品营养与安全

