PAR-1拮抗剂E5555的全合成*
苗华明,张林山,吴 疆,楼袁媛,邵 华,王建武,赵桂龙
(1.山东大学 化学与化工学院,山东 济南 250100; 2.青岛科技大学 化学与分子工程学院,山东 青岛 266042;3.天津药物研究院 a.药物设计与发现天津市重点实验室; b.知识产权办公室,天津 300193)
血小板能够被一系列的激活剂激活,例如凝血酶,ADP,血栓素A2,胶原,5-羟色胺和肾上腺素等。但是在这些激活剂中,凝血酶是最强的血小板聚集激活剂。凝血酶激活血小板聚集是通过凝血酶蛋白水解细胞表面的特定受体来实现的,这些受体被称为蛋白酶激活受体(PAR)或凝血酶受体。PAR有多个亚型,其中PAR-1是这些亚型中最主要的受体。PAR-1拮抗剂能阻断凝血酶激活血小板,从而抑制血小板聚集和血栓形成,是一类有前景的治疗动脉血栓性疾病的药物[1,2]。
1-(3-叔丁基-5-吗啉-4-甲氧基苯基)-2-(5,6-二乙氧基-7-氟-1-亚胺二氢异吲哚)乙酮氢溴酸盐(E5555)是日本卫材株式会社发现的一个强PAR-1拮抗剂[3],现在处于Ⅱ期临床阶段,具有良好的开发前景。我们在研究新型的PAR-1拮抗剂时,以E5555作为阳性对照品,对其进行了全合成[3,4]。
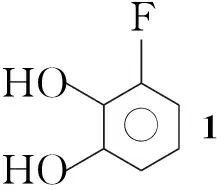
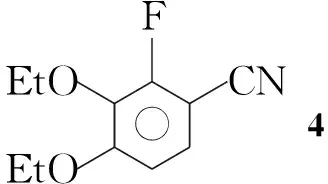
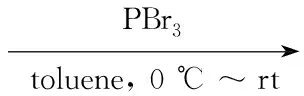

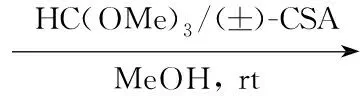

Scheme1
以3-氟邻苯二酚(1)和邻叔丁基苯酚(9)为原料,经14步反应合成了E5555(Scheme 1),总产率27.2%,其结构经1H NMR确证。对E5555的中间体2,3-二乙氧基-1-氟苯(2),5,6-二乙氧基-7-氟二氢异吲哚-1-亚胺(8)和1-(3-叔丁基-4-羟基苯基)乙酮(10)的合成工艺进行了研究,改进了合成方法步骤,简化了操作步骤,提高了收率。
1 实验部分
1.1 仪器与试剂
X-4型数字显微熔点仪;Bruker AV-400型核磁共振谱仪(DMSO-d6为溶剂,TMS为内标)。
所用试剂均为分析纯;DMF,THF,正己烷,甲苯等用前均按标准方法进行干燥处理。
1.2 合成
(1)2的合成
在反应瓶中依次加入K2CO316.11 g(116.7 mmol),KI 6.47 g(39.0 mmol),3-氟邻苯二酚(1)5.00 g(39.0 mmol)和DMF 30 mL,冰水浴冷却,搅拌下滴加溴乙烷21.27 g(195.2 mmol),滴毕,于室温反应过夜。小心倒入冰水(200 mL)中,用二氯甲烷(3×100 mL)萃取,合并有机相,用饱和食盐水(200 mL)洗涤,无水硫酸钠干燥,旋蒸除去二氯甲烷后经硅胶柱层析[洗脱剂:A=V(乙酸乙酯)∶V(石油醚)=1∶100]分离得无色液体26.82 g,产率95.0%;1H NMRδ: 6.99(ddd,J=1.6 Hz, 7.2 Hz, 16.0 Hz, 1H), 6.76~6.85(m, 2H), 4.03(sext,J=7.2 Hz, 4H), 1.33(t,J=7.0 Hz, 3H), 1.24(t,J=7.0 Hz, 3H)。
(2) 3,4-二乙氧基-2-氟-1-溴苯(3)的合成
在反应瓶中加入26.82 g(37.0 mmol),N-溴代琥珀酰亚胺(NBS)9.90 g(55.6 mmol)和乙腈80 mL,搅拌下于室温反应过夜。倒入冰水(200 mL)中,用二氯甲烷(3×100 mL)萃取,合并有机相,用饱和食盐水(200 mL)洗涤,无水硫酸钠干燥,旋蒸除溶后经硅胶柱层析(洗脱剂:A=1∶100)分离得无色液体38.25 g,产率84.6%;1H NMRδ: 7.30(dd,J=7.8 Hz, 9.0 Hz, 1H), 6.86(dd,J=2.0 Hz, 9.2 Hz, 1H), 4.02~4.08(m, 4H), 1.33(t,J=7.0 Hz, 3H), 1.24(t,J=7.0 Hz, 3H)。
(3) 3,4-二乙氧基-2-氟苯腈(4)的合成
在反应瓶中依次加入38.24 g(31.3 mmol),CuCN 4.20 g(46.9 mmol)和DMF 50 mL,氮气保护,搅拌下回流反应3 h(TLC跟踪)。冷却至室温,缓慢倒入冰水(200 mL)中,用二氯甲烷(3×100 mL)萃取,合并有机相,用饱和食盐水(200 mL)洗涤,无水硫酸钠干燥,旋蒸除溶后经硅胶柱层析(洗脱剂:A=1∶6)分离得无色液体46.12 g,产率93.6%;1H NMRδ: 7.57(dd,J=7.2 Hz, 8.8 Hz, 1H), 7.05(dd,J=1.2 Hz, 8.8 Hz, 1H), 4.17(q,J=6.9 Hz, 2H), 4.07(q,J=6.9 Hz, 2H), 1.35(t,J=7.0 Hz, 3H), 1.25(t,J=7.0 Hz, 3H)。
(4) 6-甲酰基-3,4-二乙氧基-2-氟苯腈(5)的合成
在反应瓶中加入2,2,6,6-四甲基哌啶(TMP)6.83 g(48.4 mmol),氮气保护下用橡胶塞封口。磁力搅拌下用注射器注入THF 17 mL和正己烷12.5 mL,液氮-无水乙醇降温至-78 ℃后用注射器滴加正丁基锂27.4 mL(43.8 mmol, 1.6 mol·L-1的正己烷溶液),反应20 min;再逐滴注入4 6.12 g(29.3 mmol)的THF(9.5 mL)溶液,滴毕,反应1 h。逐滴注入干燥DMF 4.28 g(58.6 mmol)和干燥THF 4 mL,反应30 min后加入正己烷30 mL,反应1 h后加入冰醋酸9.2 g和THF 2.6 mL,继续反应1 h。打开瓶塞,加水40 mL和正己烷10 mL,搅拌30 min后缓慢倒入冰水(200 mL)中,用二氯甲烷(3×100 mL)萃取,合并有机相,用饱和食盐水(100 mL)洗涤,无水硫酸钠干燥,旋蒸除溶后经硅胶柱层析(洗脱剂:A=1∶7)分离得白色粉末55.94 g,产率85.7%,m.p.120 ℃~121 ℃;1H NMRδ: 9.97(d,J=2.0 Hz, 1H), 7.67(d,J=1.2 Hz, 1H), 4.20~4.31(m, 4H), 1.40(t,J=7.0 Hz, 3H), 1.28(t,J=7.0 Hz, 3H)。
(5) 6-羟甲基-3,4-二乙氧基-2-氟苯腈(6)的合成
在反应瓶中加入NaBH40.32 g(8.4 mmol)和THF 15 mL,冰水浴冷却,搅拌下滴加冰醋酸1.52 g(25.3 mmol)的THF(10 mL)溶液,滴毕,于室温反应3 h。滴加51.00 g(4.2 mmol)的THF(15 mL)溶液,滴毕,于室温反应2 h(TLC跟踪)。缓慢倒入冰水(100 mL)中,用二氯甲烷(3×50 mL)萃取,合并有机相,用饱和食盐水(100 mL)洗涤,无水硫酸钠干燥,减压旋蒸除溶后经硅胶柱层析(洗脱剂:A=1∶2)分离得白色粉末60.81 g,产率81.0%,m.p.121 ℃~123 ℃;1H NMRδ: 7.08(s, 1H), 5.61(t,J=5.6 Hz, 1H), 4.56(d,J=5.6 Hz, 2H), 4.18(q,J=7.0 Hz, 2H), 4.06(q,J=7.0 Hz, 2H), 1.36(t,J=7.0 Hz, 3H), 1.24(t,J=7.2 Hz, 3H)。
(6) 6-溴甲基-3,4-乙氧基-2-氟苯腈(7)的合成
在反应瓶中加入60.81 g(3.4 mmol)和甲苯10 mL,冰水浴冷却,搅拌下滴加三溴化磷0.92 g(3.4 mmol)的甲苯(5 mL)溶液,滴毕,于室温反应3 h(TLC跟踪)。缓慢倒入冰水(100 mL)中,用二氯甲烷(3×50 mL)萃取,合并有机相,用饱和食盐水(100 mL)洗涤,无水硫酸钠干燥,减压旋蒸除溶后经硅胶柱层析(洗脱剂:A=1∶10)分离得白色粉末70.80 g,产率78.0%,m.p.64 ℃~66 ℃;1H NMRδ: 7.32(d,J=1.2 Hz 1H), 4.72(s, 2H), 4.18(q,J=7.0 Hz, 2H), 4.10(q,J=7.0 Hz, 2H), 1.36(t,J=7.0 Hz, 3H), 1.26(t,J=3.6 Hz, 3H)。
(7)8的合成
在反应瓶中加入70.80 g(2.6 mmol)的THF(10 mL)溶液和饱和NH3/甲醇溶液30 mL,搅拌下于室温反应过夜(TLC跟踪)。加入二氯甲烷100 mL后用饱和食盐水洗涤,无水硫酸钠干燥,旋蒸除溶后加入石油醚20 mL,搅拌1 h。抽滤,滤饼干燥得黄色粉末80.50 g,产率79.4%,m.p.121 ℃(分解);1H NMRδ: 7.05(s, 1H), 6.19(d,J=6.0 Hz, 2H), 4.39(s, 2H), 4.12(q,J=3.5 Hz, 2H), 4.02(q,J=7.0 Hz, 2H), 1.35(t,J=6.8 Hz, 3H), 1.25(t,J=7.0 Hz, 3H)。
(8)10的合成
在反应瓶中加入无水AlCl317.76 g(133.0 mmol)和甲苯450 mL,冰水浴冷却,搅拌下滴加2-叔丁基苯酚(9)20.00 g(133.3 mmol)的甲苯(25 mL)溶液;滴加乙酰氯10.44 g(133.0 mmol)的甲苯(25 mL)溶液,滴毕,于室温反应2.5 h(TLC跟踪)。缓慢倒入冰水(500 mL)中,分液,水层用乙酸乙酯(20 mL)萃取,合并有机层,用饱和食盐水(200 mL)洗涤,无水硫酸钠干燥,减压旋蒸除溶后经硅胶柱层析(洗脱剂:A=1∶6)分离得白色固体1020.31 g,产率79.3%,m.p.163 ℃~164 ℃;1H NMRδ: 10.29(s, 1H), 7.76(d,J=2.0 Hz, 1H), 7.68(dd,J=2.2 Hz, 8.2 Hz, 1H), 6.85(d,J=8.4 Hz, 1H), 2.45(s, 3H), 1.35(s, 9H)。
(9) 1-(5-叔丁基-4-羟基-3-溴苯基)乙酮(11)的合成
在反应瓶中加入1020.10 g(104.7 mmol)和乙腈176 mL,冰水浴冷却,搅拌下缓慢滴加NBS 20.56 g(115.5 mmol)的乙腈(146 mL)溶液,滴毕,于室温反应2 h(TLC跟踪)。减压旋蒸除溶后经硅胶柱层析(洗脱剂:A=1∶6)分离得白色固体1124.53 g,产率86.5%,m.p.107 ℃~108 ℃;1H NMRδ: 9.66(s, 1H), 7.99(d,J=2.0 Hz, 1H), 7.76(d,J=2.0 Hz, 1H), 2.50(s, 3H), 1.36(s, 9H)。
(10) 1-(5-叔丁基-4-甲氧基-3-溴苯基)乙酮(12)的合成
在反应瓶中依次加入1124.50 g(90.4 mmol),碳酸钾18.63 g(135.0 mmol)和DMF 30 mL,冰水浴冷却,搅拌下缓慢滴加碘甲烷25.56 g(180.8 mmol),滴毕,于室温反应3 h(TCL跟踪)。缓慢倒入冰水(200 mL)中,用浓盐酸调pH至4~5,用乙酸乙酯(3×200 mL)萃取,合并有机相,用饱和食盐水(200 mL)洗涤,无水硫酸钠干燥,减压旋蒸除溶后经硅胶柱层析(洗脱剂:A=1∶45)分离得黄色油状物1224.11 g,产率93.6%;1H NMRδ: 8.06(d,J=2.0 Hz, 1H), 7.84(d,J=2.0 Hz, 1H), 3.91(s, 3H), 2.55(s, 3H), 1.36(s, 9H)。
(11) 3-叔丁基-5-(1,1-二甲氧基乙基)-2-甲氧基溴苯(13)的合成
在反应瓶中依次加入1224.10 g(84.6 mmol),HC(OMe)347.20 g(253.8 mmol),(±)-樟脑磺酸[(±)-CSA]0.98 g(4.2 mmol)和甲醇22 mL,搅拌下于室温下反应2 h。加入碳酸钾2.33 g(16.9 mmol),搅拌40 min后缓慢倒入冰水(200 mL)中,用二氯甲烷(3×200 mL)萃取,合并有机相,用饱和食盐水(200 mL)洗涤,无水硫酸钠干燥,减压除溶得黄色油状物13(未经纯化直接用于下一步反应)24.3 g,产率86.8%;1H NMRδ: 7.46(d,J=2.0 Hz, 1H), 7.31(d,J=2.0 Hz, 1H), 3.84(s, 3H), 3.05(s, 6H), 1.42(s, 3H), 1.33(s, 9H)。
(12) 4-[3-叔丁基-5-(1,1-二甲氧基乙基)-2-甲氧基苯基]吗啉(14)的合成
在反应瓶中依次加入1314.30 g(43.2 mmol),醋酸钯0.67 g(3.0 mmol),BINAP 2.01 g(3.2 mmol),吗啉7.52 g(86.4 mmol),叔丁醇钠10.05 g(94.6 mmol)及DME 100 mL,氮气保护,搅拌下回流反应过夜。冷却后用硅藻土抽滤,滤饼用DME洗涤,滤液旋蒸浓缩后经中性三氧化二铝柱层析(洗脱剂:A=1∶40)分离得黄色黏稠液体1412.45 g,产率85.2%;1H NMRδ: 7.00(d,J=2.0 Hz, 1H), 6.89(d,J=2.0 Hz, 1H), 3.87(s, 3H), 3.76(t,J=4.6 Hz, 4H), 3.05(s, 6H), 2.93(t,J=4.4 Hz, 4H), 1.41(s, 3H), 1.31(s, 9H)。
(13) 1-(3-叔丁基-5-吗啉-4-甲氧基苯基)-2-溴乙酮(15)的合成
(14) E5555的合成
在反应瓶中加入80.48 g(2.0 mmol),150.74 g(2.0 mmol)和THF 20 mL,氮气保护,搅拌下于室温反应过夜。加入THF 10 mL和石油醚30 mL,搅拌30 min,抽滤,滤饼干燥得浅红色粉末E5555 1.02 g,产率84.0%,m.p.198 ℃~199 ℃;1H NMRδ: 9.29(s, 1H), 9.05(s, 1H), 7.60(d,J=1.6 Hz, 1H), 7.50(d,J=1.6 Hz, 1H), 7.34(s, 1H), 5.51(s, 2H), 4.80(s, 2H), 4.22(q,J=7.0 Hz, 2H), 4.12(q,J=7.0 Hz, 2H), 3.95(s, 3H), 3.81(t,J=4.2 Hz, 4H), 3.00(s, 4H), 1.40(t,J=7.0 Hz, 3H), 1.37(s, 9H), 1.30(t,J=7.2 Hz, 3H)。
2 结果与讨论
(1) 2的合成
在K2CO3提供的碱性环境中,1在DMF中被溴乙烷乙基化得到2。该反应是典型的SN2取代反应,使用偶极溶剂DMF作为反应溶剂,在KI催化下反应,反应在室温下顺利完成,产率(95.0%)极高。反应避免了使用文献[3]方法中硫酸二乙酯等毒性较大的乙基化试剂。
(2) 8的合成
溴化苄7在室温下与NH3/MeOH反应顺利得到了期望亚胺中间体8,避免了文献[4]方法使用的高压反应和繁琐的操作,极大地简化了该反应。
(3) 10的合成
9在AlCl3催化下乙酰化,通过多次实验,将反应温度调整为0 ℃,避免了使用-45 ℃的低温[4],节约了能源动力并简化了操作。
[1] Chackalamannil S. Thrombin receptor(protease activated receptor-1) antagonists as potent antithrombotic agents with strong antiplatelet effects[J].J Med Chem,2006,49:5389-5403.
[2] Perez M, Lamothe M, Maraval C,etal.Discovery of novel protease activated receptors-1 antagonists with potent antithrombotic activity in vivo[J].J Med Chem,2009,52:5826-5836.
[3] 铃木秋一,小竹真,宫本光明,等.2-亚胺基吡咯烷衍生物[P].CN 1 503 784,2004.
[4] Shimumoru N, Sasho M, Kayano A,etal.Methods for producing cyclic benzamidine derivatives[P].US 0 058 370,2006.

