新型水溶性大环席夫碱锰(Ⅱ)配合物的合成及其模拟超氧化物歧化酶的活性研究*
袁泽利,吴 庆,杨兴变,胡庆红,钟永科,周旭美,张铭钦
(遵义医学院 药学院,贵州 遵义 563003)
锰的配位化学由于其生物功能,而愈来愈引起人们的广泛兴趣。在某些生物酶中,锰的配位环境多为咪唑的氮和羧基及水分子的氧原子配位[1,2]。在模型配合物的研究方面,由于席夫碱配体具有与生物体系有关的N,O给体,且配位环境可调,与生物体环境比较接近,这激发了人们对该类化合物在生物生理功能作用机制及其模型配合物研究的兴趣。
超氧化物歧化酶(SOD)是一类氧化还原酶,在防止有氧生物免受氧化性损伤中具有重要的作用[3]。市售的SOD系从动物血液中提取,存在操作烦琐、价格昂贵、在体内寿命短及分子量较大不能透过细胞膜等缺点,限制了其在临床中的应用。为此,研究者们致力于用化学方法合成模拟SOD。然而,已有模拟配合物的SOD活性不甚理想。可能是由于人工合成的模拟SOD的水溶性差使其在生理条件下的活性受到影响,妨碍了在医药方面的应用。因此寄希望于合成出水溶性的模拟SOD以开发实际应用价值。目前,有关开链水溶性席夫碱锰配合物的研究取得了一些进展[4,5],而有关水溶性大环席夫碱配体及其锰配合物却鲜见文献报道。
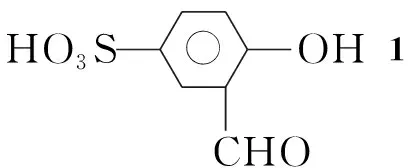

Scheme1
1 实验部分
1.1 仪器与试剂
WRS-2A型数字熔点仪(温度未校正);TU-1901型双光束紫外可见分光光度计;BrukerAV-500型核磁共振仪(D2O为溶剂,TMS为内标);Varian 1000 FT-IR型红外光谱仪(KBr压片);MS HP-1100型质谱仪;Vario ELⅢ型元素分析仪;SG 7200 HPT型超声振荡仪。
1按文献[10]方法制备;乙二胺,1,3-丙二胺,1,4-丁二胺,水杨醛,化学纯;其余所用试剂和溶剂均为分析纯;实验用水为二次蒸馏水。
1.2 合成
(1)2的合成
在三口瓶中依次加入Na2CO323.32 g,1 4.02 g(20 mmol)的50%乙醇(100 mL)溶液,于50 ℃超声振荡使其完全溶解;于30 min内缓慢滴加1,3-二氯-2-丙醇1.28 g(10 mmol)的50%乙醇(20 mL)溶液,滴毕,超声振荡60 min。冷却至室温,抽滤,滤饼依次用水、稀盐酸洗涤数次,用50%无水乙醇重结晶,真空干燥得白色长方型晶体2 4.26 g,收率84.6 %, m.p.98 ℃~101 ℃;1H NMRδ: 10.18(s, 2H, CHO), 8.07(s, 1H, OH), 7.91~6.95(m, 6H, ArH), 4.62(m, 1H, CHOH), 4.37(s, 4H, CH2); IRν: 3 452, 2 758, 1 675, 1 248, 1 010, 1 245, 1 045 cm-1; Anal.calcd for C17H16O11S2: C 44.35, H 3.50; found C 44.42, H 3.63。
(2) Lx的合成(以L2的合成为例)
将2 0.94 g(2 mmol)溶于75%乙醇(100 mL)中,搅拌下加热至回流;于1 h内缓慢滴加乙二胺0.12 g(2 mmol)的乙醇(20 mL)溶液,滴毕,回流反应5 h。旋蒸至溶液体积约20 mL,冷却后置冰箱中过夜,抽滤,滤饼真空干燥得微黄色固体粉末L2。
分别以1,3-丙二胺和1,4-丁二胺代替乙二胺,用类似方法合成微黄色固体L3和黄色固体L4。
L2: 产率41.31%,m.p.138 ℃~140 ℃; UV-Visλmax: 310, 245 nm;1H NMRδ: 9.58(s, 2H, CH=N), 8.41(s, 1H, OH), 7.60~6.44(m, 6H, ArH), 4.78(m, 1H, CHOH), 4.50(s, 4H, OCH2), 4.02(s, 4H, NCH2); IRν: 3 438, 1 637, 1 498, 1 400, 1 238, 1 112 cm-1; MSm/z: 480(M+-4); Anal.calcd for C19H20O9S2: C 47.10, H 4.16, N 5.78; found C 47.28, H 4.03, N 5.88。
L3: 产率38.51%,m.p.115 ℃~118 ℃; UV-Visλmax: 309, 250 nm;1H NMRδ: 9.45(s, 2H, CH=N), 8.39(s, 1H, OH), 7.75~6.62(m, 6H, ArH), 4.75(m, 1H, CHOH), 4.65(s, 4H, OCH2), 4.02(s, 4H, NCH2), 2.11(m, 2H, CH2); IRν: 3 495, 1 641, 1 510, 1 400, 1 240, 1 005, 1 120 cm-1; MSm/z: 497(M++1); Anal.calcd for C20H22O9S2: C 48.18, H 4.45, N 5.62; found C 48.29, H 4.39, N 5.48。
L4: 产率27.06%,m.p.109 ℃~111 ℃; UV-Visλmax: 310, 252 nm;1H NMRδ: 9.40(s, 2H, CH=N), 8.28(s, 1H, OH), 7.78~6.45(m, 6H, ArH), 4.81(m, 1H, CHOH), 4.72(s, 4H, OCH2), 4.28(s, 4H, NCH2), 2.05~1.98(m, 4H, CH2); IRν: 3 505, 1 640, 1 448, 1 402, 1 246, 1 110 cm-1; MSm/z: 511(M+-1); Anal.calcd for C21H24O9S2: C 49.21, H 4.72, N 5.47; found C 49.46, H 4.28, N 5.37。
(3) MnLx的合成(以MnL2的合成为例)
将NaOH 0.16 g(4 mmol)和L2 0.97 g(2 mmol)溶于50%乙醇(25 mL)中,搅拌下缓慢滴加醋酸锰0.49 g(2 mmol)的乙醇(25 mL)溶液,滴毕,回流反应2 h。冷却后置冰箱中过夜,过滤,滤饼依次用少量冰无水乙醇、冰水洗涤,真空干燥得棕色粉末MnL2。
用类似方法合成棕色粉末MnL3和MnL4。
MnL2: 产率66.48%,m.p.>300 ℃; UV-Visλmax: 325, 251 nm; IRν: 3 550, 3 406, 1 620, 1 458, 1 384, 1 245, 1 115, 496, 424 cm-1; MSm/z: 642(M++1-H2O-OAc-); Anal.calcd for C23H24O13S2Na2Mn·H2O: C 38.39, H 3.64, N 3.89, Na 6.39; found C 38.28, H 3.53, N 3.88, Na 6.51。
MnL3: 产率68.12%,m.p.>300 ℃; UV-Visλmax: 330, 248 nm; IRν: 3 560, 3 416, 1 615, 1 452, 1 383, 1 252, 1 120 , 478, 430 cm-1; MSm/z: 714(M+-1-2H2O); Anal.calcd for C24H26O13S2Na2Mn·2H2O: C 38.36, H 4.02, N 3.73, Na 6.12; found C 38.16, H 3.97, N 3.78, Na 6.07。
MnL4: 产率52.76%,m.p.>300 ℃; UV-Visλmax: 328, 250 nm; IRν: 3 557, 3 420, 1 610, 1 452, 1 388, 1 260, 1 130, 498, 427 cm-1.MSm/z: 671(M++1-2H2O-OAc-); Anal.calcd for C25H28O13S2Na2Mn·2H2O: C 39.22, H 4.21, N 3.66, Na 6.01; found C 38.28, H 4.33, N 3.61, Na 6.13。
2 结果与讨论
2.1 配体及配合物的表征
实验结果表明,合成的配体及其锰配合物均具有良好的水溶性。配合物中钠的含量用醋酸铀酰锌测得,其实验值与计算值吻合较好。
1H NMR分析表明,9.40~9.58处的吸收峰分别对应于配体CH=N质子特征峰;6.44~7.78附近为芳香质子吸收峰;8.28~8.41处对应于柔性链中OH质子吸收峰;与该羟基相联的CH在4.75~5.23;而4.50~4.72为NCH2质子吸收峰;4.02~4.18为OCH2质子吸收峰;在1.98~2.11为L3,L4烷基二胺的CH2质子吸收峰。
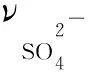
配体及配合物在双蒸馏水中的UV-Vis数据测定表明,它们的光谱图相似,都有两个相似的吸收带,即在250 nm附近吸收峰属于苯环的π-π*跃迁吸收,而在配体中的310 nm吸收峰属于分子中C=N双键的π-π*跃迁吸,在形成配合物该吸收峰均发生了一定程度的红移,进一步证明配体与金属离子存在了配位作用[6]。
MS分析表明,配体均观察到相应的分子离子峰,而在形成配合物后观察到其失去结晶水和一定的配位OAc-碎片峰;元素分析的实测值与理论值基本相符。这些数据进一步证明了合成得到的化合物为预期目标分子结构。
2.2 配合物对的清除作用
席夫碱型模拟SOD的活性测定多以DMF,DMSO等为溶剂[13,14]。本文合成的以磺酸修饰的SOD模型配合物可溶于水,且在水中具有良好的溶解度,故采用双蒸水为溶剂测定其活性。
采用邻苯三酚自氧化法[13]测定了MnLx的歧化超氧阴离子活性,以探索用人工合成的化合物代替SOD用于临床治疗的可能性,并与文献[14]中SOD作对照。
以抑制率[η=(1-νt/ν0)×l00%]对浓度(c)作图得标准曲线。在标准曲线上即可找到IC50值(表1)。

表1配合物的IC50值和pI50值*
*pI50=-lgIC50
[1] Najafpour M M.A possible evolutionary origin for the Mn4 clusterin photosystem Ⅱ:From manganese superoxide dismutase to oxygen evolving complex[J].Origins Life Evol Biosphere,2009,39(2):151-163.
[2] Gohdes J W, Armstrong W H.Synthesis,structure,and properties of [Mn(salpn)(EtOH)2](ClO4) and its aerobic oxidation product [Mn(salpn)O]2[J].Inorg Chem,1992,31(3):368-373.
[3] 王建华,雷文,王远亮.SOD酶模型配合物的合成及催化歧化作用——1,3,4-噻二唑类希夫碱配合物的合成、表征及对超氧离子的抑制作用[J].合成化学,2002,10(4):314-317.
[4] 石先莹,魏俊发术,高中强,等.水溶性席夫碱型锰配合物的合成、表征及其模拟超氧化物歧化酶活性研究[J].有机化学,2007,27(8):1027-1030.
[5] 朱必学,阮文娟,高峰,等.水溶性手性Salen Mn(Ⅲ)的光谱性质及其对氨基酸客体的分子识别研究[J].化学学报,2004,62(1):58-65.
[6] Ze-Li Yuan, Qi-Long Zhang, Bi-Xue Zhu.A new series of dinucleating macrocyclic ligands and their complexes of zinc(Ⅱ)[J].Polyhedron,2008,27(1):344-348.
[7] 袁泽利,胡庆红,吴庆,等.新型大环席夫碱化合物的合成及其抗菌活性研究[J].有机化学,2009,29(2):279-282.
[8] 袁泽利,吴庆,杨兴变,等.含双酰腙类新型席夫碱大环化合物的合成与表征[J].化学世界,2010,51(5):289-291.
[9] 吴庆,袁泽利,徐远飞,等.新型含硫杂环席夫碱型大环化合物的合成及其杀菌活性[J].合成化学,2010,18(5):608-610.
[10] 吴雪梅,董健媛等.磺化水杨醛缩苯胺含Cu配合物的合成表征及催化性质研究[J].化学世界,2007,48(8):456-459.
[11] 张生万,张有贤,曹晓峰,等.新试剂1-羟基-2-(6-溴-2-苯并噻唑偶氮)-8-氨基-3,6-萘二磺酸的合成及性能的研究[J].化学试剂,1993,15(4):205-210.
[12] Wang R M,Feng H X,He Y E,etal.Preparation and catalysis of NaY-encapsulated Mn(Ⅲ) schiff-base complex in presence of molecular oxygen[J].J Mol Catal A,2000,151(1):253-259.
[13] 吴庆,江艳,袁泽利,等.新型双核Cu(Ⅱ)席夫碱化合物的合成及其模拟超氧化物歧化酶活性研究[J].数理医药学杂志,2009,22(5):578-580.
[14] 吴辉禄,高忆慈.超氧化物歧化酶模型化合物的合成、表征及其SOD活性研究[J].化学通报,2002,66(11):770-774.

