杆状病毒SeMNPV Se29基因的克隆、表达与抗体制备
李赛男,李朝飞, 庞 义, 杨 凯
(1. 肇庆学院生命科学学院, 中国 肇庆 526061; 2. 中山大学有害生物控制与资源利用国家重点实验室, 中国 广州 510275)
甜菜夜蛾核多角体病毒(Spodopteraexiguamulticapsid nucleopolyhedrovirus,SeMNPV)属于昆虫杆状病毒科核多角体病毒属.杆状病毒是一类双链DNA 病毒,是感染昆虫和其它节肢动物的主要病原,具有高度的宿主专一性[1].SeMNPV的宿主昆虫甜菜夜蛾(Spodopteraexigua)属鳞翅目夜蛾科,是一种世界性分布的多食性害虫,自20世纪90年代以来曾相继在广东、云南、江西、湖南、浙江、江苏、台湾等多种蔬菜及棉花、大豆、甜菜等经济作物上暴发性发生,对当地农业生产造成重大损失,而且随着广谱杀虫剂的大量施用和滥用,甜菜夜蛾对许多农药产生了抗性,多类化学农药已对其失去防治效果.研究表明,SeMNPV能有效防治甜菜夜蛾,对控制甜菜夜蛾具有潜在的发展前景,已被成功开发为生物杀虫剂用于防治甜菜夜蛾[2-3].但是昆虫病毒种间的遗传变异较大,宿主专一性强,杀虫速度缓慢,故限制了它们的应用[4].为此,深入研究SeMNPV分子生物学,构建高杀虫毒力的重组病毒杀虫剂,具有重要的理论意义和广阔的应用前景.
自苜蓿丫纹夜蛾核型多角体病毒(Autographacalifornicamultiple nucleopolyhedrovirus,AcMNPV) 的全基因组序列被测定以来[5],至今已有50株杆状病毒的全基因组序列被测定.其中,46株病毒的宿主是鳞翅目昆虫,膜翅目昆虫病毒3株,1株双翅目昆虫病毒[6].BLAST搜索并Clustal W比对发现,Se29所编码的氨基酸序列与SpodopterafrugiperdaNPV ORF28、AgrotissegetumNPV ORF30、SpodopteralituraMNPV ORF119、HelicoverpaarmigeraSNPV ORF128、AcMNPV ORF17和BombyxmoriNPV ORF9所编码的氨基酸序列一致性分别为46%、43%、27%、25%、10%和9%.有研究表明,BombyxmoriNPV ORF9(Bm9) 是一个早期基因,在病毒感染后3 h开始转录,表达产物存在于被感染细胞的细胞质中,AcMNPV ORF17(Ac17) 是晚期基因,其表达产物存在于被感染细胞的细胞质和细胞核中,Bm9和Ac17的缺失均不影响病毒DNA的复制,但是降低了芽生型病毒粒子(Budded virus, BV)的生产水平[7-8].HelicoverpaarmigeraSNPV ORF128(Ha128)基因是一个晚期表达基因,其表达产物HA128位于被感染细胞的细胞质中,与宿主蛋白发生相互作用,可能在病毒的侵染过程中发挥作用[9].SE29与HA128同源性较高,其是否具有与HA128相同功能以及其在病毒侵染过程中的作用值得关注.到目前为止,有关Se29及其其它同源基因的分子生物学特性和功能的研究尚未见报道.本文为了深入研究Se29基因的结构与功能关系,在大肠杆菌(Escherichiacoli,E.coli)BL21( DE3)中表达了SE29蛋白,电泳纯化后免疫家兔,制备了多克隆抗体,为进一步研究SE29蛋白的功能奠定了基础.
1 材料和方法
1.1 材料
1.1.1 实验材料 甜菜夜蛾核多角体病毒毒株SeMNPV-SeUS1由美国California University, Riverside分校的Dr. Federici B A惠赠;E.coli菌株BL21 (DE3 )由中山大学有害生物控制与资源利用国家重点实验室保存;克隆载体pMD18-T 购自TaKaRa公司;表达载体pET-28a(+) 购自Novagen公司;甜菜夜蛾细胞系Se301由日本的Dr. Kawarabata惠赠,细胞维持于添加了体积分数为10%的胎牛血清(全文同)的Grace’s 培养基中,培养温度为28 ℃.
1.1.2 主要试剂 质粒提取试剂盒和DNA回收试剂盒购自Omega公司; 6×His-tag表达试剂盒(QIA expressionistTM)购自Qiagen公司;Taq酶购自上海生物工程公司;限制性内切酶购自TaKaRa公司;T4DNA连接酶、丙烯酰胺和N,N′-亚甲双丙烯酰胺为Promega产品;DNA相对分子质量、蛋白质相对分子质量标准、IPTG和X-gal等试剂均为东盛生物工程公司产品;弗氏完全佐剂和弗氏不完全佐剂购自Gibco BRL公司;其它试剂为国产分析纯.
1.1.3 仪器 PCR 扩增仪、凝胶成像系统、聚丙烯酰胺凝胶电泳与蛋白质转印系统装置购自美国Bio-Rad 公司,台式高速冷冻离心机为德国Eppendorf公司产品.
1.1.4 培养基 采用常规固体或液体LB培养基培养大肠杆菌,昆虫细胞培养基为添加了10%胎牛血清的Grace’s 培养基.
1.2 方法
1.2.1SeMNPV基因组DNA的提取SeMNPV基因组DNA的提取参照文献[10]的方法进行.
1.2.2 引物设计及PCR 根据SeMNPV 基因组全序列[11](Genbank accession No. NC_002169),运用DNASTAR软件设计一对扩增Se29基因全长的引物,由上海英骏生物技术有限公司合成.上游引物Se29-P1:5′-GGATCCATGTTTGAATTCGATAAAGATTTTA-3′(下划线部分为引入的BamHⅠ酶切位点);下游引物Se29-P2:5′-AAGCTTTTACATTTTACCTACACCATAAC-3′(下划线部分引入的HindⅢ酶切位点).PCR反应体系为50 μL,模板为SeMNPV基因组DNA.PCR反应设计为:94 ℃预变性,3 min,1次;94 ℃变性,1 min,50 ℃退火,1 min,72 ℃延伸,1 min,共30个循环;72 ℃延伸10 min后移至4 ℃存放.扩增完毕后,进行琼脂糖凝胶电泳检测,并对Se29基因的PCR产物进行回收.
1.2.3Se29基因原核表达质粒的构建 原核表达重组载体的构建策略如图1所示.DNA回收和质粒提取按照试剂盒操作说明进行.酶切、连接、转化等步骤均按文献[12]进行.重组表达质粒pET-Se29经过酶切鉴定后,在上海英骏生物技术有限公司对插入的DNA片段测序,鉴定插入片段的正确性.
1.2.4Se29基因在E.coli中的表达 将经测序鉴定后的重组质粒pET-Se29转化E.coliBL21(DE3),挑取含pET-Se29的单克隆接种于3 mL LB 培养基中,37 ℃过夜培养后,次日以1%转接,37 ℃振摇至OD600=0.5,加入IPTG至终浓度1 mmol/L,37 ℃诱导5 h,收集菌体进行12%(体积分数)聚丙烯酰胺凝胶电泳分析和Western印迹分析,方法参照QIA expressionistTM说明书进行.
1.2.5 抗体的制备 参照文献[12]的方法,表达产物经聚丙烯酰胺凝胶电泳分离后,按文献[13] 的方法制备抗体.从15~ 20 块SDS-PAGE胶上割取所需要的目的带,研磨成匀浆反复通过7号注射针头,纯化的融合蛋白与等体积的弗氏佐剂乳化后免疫新西兰大白兔,制备多克隆抗体.
1.2.6 抗体的检测 取SeMNPV感染72 h后的Se301细胞,用SE29多克隆抗体按Western免疫印迹试剂盒(Roche Molecular Biochemicals)说明进行Western blot分析.抗体以1∶1 000用1×封闭液稀释.
2 结果
2.1 原核表达质粒的构建
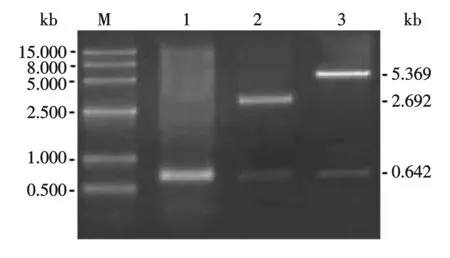
M:DNA相对分子质量标准;1:PCR产物;2:重组质粒T-Se29的BamHⅠ/HindⅢ双酶切;3:重组质粒pET-Se29的BamHⅠ/HindⅢ双酶切图2 PCR产物、重组质粒T-Se29和pET-Se29的鉴定
用引物Se29-P1和Se29-P2从SeMNPV基因组中扩增了Se29基因,扩增片段共642 bp,与预期大小相符(图2,泳道1).回收PCR产物,连入pMD18-T克隆载体,得到质粒T-Se29,进行BamHⅠ和HindⅢ双酶切鉴定,获得与预期大小一致的642 bp的目的片段和2.692 kb的载体片段(图2,泳道2).以BamHⅠ和HindⅢ酶切T-Se29,回收Se29基因片段,连接到同样双酶切的pET-28a(+)上,得到质粒pET-Se29,用BamHⅠ和HindⅢ双酶切鉴定,获得与预期大小一致的642 bp的目的片段和5.369 kb的载体片段(图2,泳道3).测序结果表明,插入片段与NCBI上公布的该片段序列完全一致,而且Se29基因与载体pET-28a(+)连接正确.
2.2 Se29在E.coli中的表达
将重组表达质粒pET-Se29转入E.coliBL21(DE3),以IPTG诱导5 h,离心收集细胞,进行SDS-PAGE.结果表明,产生了大小约为27 000 的特异性蛋白条带,Se29基因编码213个氨基酸,翻译产物理论相对分子质量为24 400,本实验所表达蛋白的大小比预期大小略大;而经诱导的E.coliBL21(DE3)和未经诱导的含重组表达质粒pET-Se29的E.coliBL21(DE3)在相应的位置上没有出现诱导的蛋白带( 图3 ).以Ni-NTA碱性磷酸酶偶联抗体进行Western blot分析,在硝酸纤维膜上检测到相对分子质量约为27 000的蛋白条带,而同时转印的对照样品则检测不到任何蛋白条带(图4),表明诱导的目的蛋白成功地进行了融合表达,并在N-端携带有6×His接头.

M:蛋白质相对分子质量标准;1:经IPTG诱导的BL21(DE3);2:未经IPTG诱导的BL21(DE3)/pET-Se29;3:经IPTG诱导的BL21(DE3)/pET-Se29图3 SE29蛋白在E.coli BL21(DE3)中的表达的SDS-PAGE

M:预染蛋白质相对分子质量标准;1:经IPTG诱导的BL21(DE3);2:未经IPTG诱导的BL21(DE3)/pET-Se29;3:经IPTG诱导的BL21(DE3)/pET-Se29图4 用Ni-NTA conjugate 抗体检测SE29蛋白在E.coli BL21(DE3)中的表达的Western blot分析
2.3 Se29抗体的制备与检测
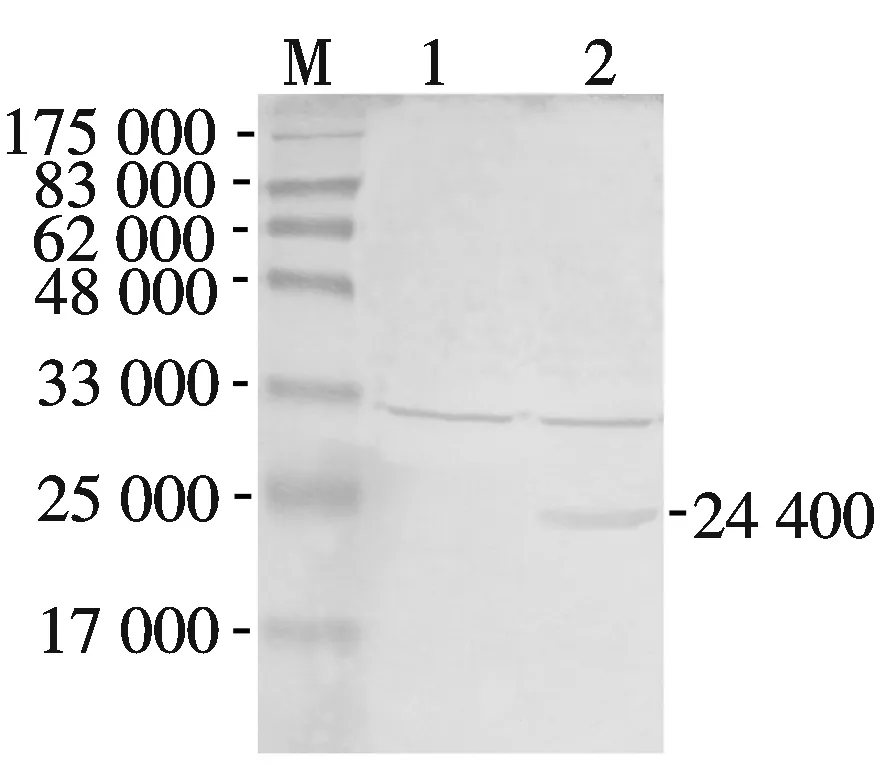
M:预染蛋白质相对分子质量标准; 1:未感染病毒的Se301细胞; 2:SeMNPV 感染后的Se301细胞图5 SE29蛋白抗体在病毒感染的细胞中的检测
将从SDS-PAGE胶上割取的融合蛋白免疫新西兰大白兔,3次加强免疫后收取抗血清.制备的SE29抗血清能在SeMNPV 感染72 h的Se301细胞总蛋白中杂交到一条约24 400的特异杂交带,而未感染病毒的对照细胞中没有阳性信号( 图5 ).表明制备的抗体特异性较好,适合用作以后有关Se29功能的研究.
3 讨论
SeMNPVSe29的同源基因广泛存在于已经测定全基因组序列的鳞翅目杆状病毒( NPV) 基因组中.Se29的同源基因Ac17和Bm9的缺失均不会影响病毒DNA的复制,但是降低了BV的产生水平[7-8].Ha128基因的表达产物HA128与宿主蛋白发生相互作用,可能在病毒的侵染过程中发挥作用[9].SE29与AC17和BM9的同源性较低,与HA128的同源性较高,其是否具有与HA128相同功能以及其在病毒侵染过程中的作用值得关注.
本论文通过PCR 的方法从SeMNPV 基因组中扩增得到Se29基因,构建了Se29基因的原核表达质粒,在大肠杆菌中实现了SE29蛋白的融合表达,跟预期大小相比蛋白稍微变大.由于原核表达载体pET-28a(+)的N 端携带有6×His Tag 序列,表达的蛋白在其N-端均带有融合的6×His接头,这可能是蛋白稍微变大的原因.用表达的融合蛋白免疫新西兰大白兔,制备了SE29蛋白的多克隆抗体.Western blot分析表明,SE29蛋白的多克隆抗体与SeMNPV感染的Se301 细胞总蛋白显示一条相对分子质量约24 400的特异杂交带,与推测的大小一致,而对照细胞中没有出现相应的带,表明所制备的抗体是成功的.这是因为在病毒感染的真核细胞中,蛋白没有6×His 接头,在原核细胞中表达后的可能的结合或修饰被去除,显示了蛋白自身的预测大小.该抗体的制备为进一步研究SE29 蛋白在病毒结构和感染细胞中的定位、相互作用蛋白的鉴定以及Se29基因在病毒侵染过程中的可能作用奠定了基础.
参考文献:
[1] 李玲玲, 李朝飞, 庞 义. 甜菜夜蛾核多角体病毒(SeMNPV) ORF100和ORF101基因的克隆、表达与纯化[J]. 生物技术, 2007, 17(5): 21-24.
[2] SMITS P H, VRIE V D, VLAK J M. Nuclear polyhedrosis virus for control ofSpodopteraexigualarvae on glasshouse crops[J]. Entomol Exp Appl,1987, 43(1): 73-80.
[3] 李广宏, 陈其津, 庞 义. 甜菜夜蛾核多角体病毒的研究与应用进展[J]. 中国生物防治,1999, 15(4): 178-182.
[4] WU J G, MILLER L K. Sequence, transcription and translation of a late gene of theAutographacalifornicanuclear polyhedrosis virus encoding a 34.8 K polypeptide[J]. J Gen Virol,1989, 70(9): 2449-2459.
[5] AYRES M D, HOWARD S C, KUZIO J,etal. The complete DNA sequence ofAutographacalifornicanuclear polyhedrosis virus[J]. Virology,1994, 202(2): 586-605.
[6] HISCOCK D, UPTON C. Viral genome database: storing and analyzing genes and proteins from complete viral genomes[J]. Bioinformatics,2000, 16(5): 484-485.
[7] YANG Z N, XU H J, THIEM S M,etal.Bombyxmorinucleopolyhedrovirus ORF9 is a gene involved in the budded virus production and infectivity[J]. J Gen Virol,2009, 90(1): 162-169.
[8] NIE Y C, THEILMANN D A. Deletion of AcMNPV AC16 and AC17 results in delayed viral gene expression in budded virus infected cells but not transfected cells[J]. Virology,2010, 404(2): 168-179.
[9] AN S H, WANG D, ZHANG N Y,etal. Characterization of a late expression gene, Open reading frame 128 ofHelicoverpaarmigerasingle nucleocapsid nucleopolyhedrovirus[J]. Arch Virol, 2005, 150(12): 2453-2466.
[10] O’REILLY D R, MILLER L K, LUCKOW V A. Baculovirus expression vectors-A laboratory manual[M]. New York: W H Freeman and Company, 1992.
[11] IJKEL W F, STRIEN E A, HELDENS J G M,etal. Sequence and organization of theSpodopteraexiguamulticapsid nucleopolyhedrovirus genome[J]. J Gen Virol,1999, 80(12): 3289-3304.
[12] SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular cloning: a laboratory manual[M]. New York: Cold Spring Harbor Laboratory Press, 1989.
[13] YIN C, YU J, WANG L,etal. Identification of a novel protein associated with envelope of occlusion-derived virus inSpodopteralituramulticapsid nucleopolyhe-drovirus[J]. Virus Genes, 2003, 26(1): 5-13.

