UFC1基因在乳腺癌和正常乳腺组织中的表达
贺爱兰, 张 波, 刘如石
(1.湖南人文科技学院生命科学系,中国 娄底 417000;2.湖南中医药大学基础医学院,中国 长沙 410208;3.湖南师范大学生命科学学院,中国 长沙 410081)
近年来,我国恶性肿瘤发病率越来越高,肿瘤严重威胁着人类健康,其中乳腺癌是一种严重威胁女性生命健康的恶性肿瘤之一,其患病率占女性恶性肿瘤的第一位.迄今为止,乳腺癌的病因及其恶性进展的具体机制尚未完全阐明,与其他恶性肿瘤一样,乳腺癌其形成与发展是一个多基因参与、多步骤进行及多阶段发展的过程.随着分子生物学的快速发展,一种新的途径引起人们的关注,即泛素 (ubiquitin)系统[1].
泛素在20世纪70年代中期被发现,随后与泛素类似的小蛋白家族,称泛素样蛋白(ubiquitin-like proteins,UBLs)被报道,并且新成员不断增加.Ufm1(ubiquitin-fold modifier 1)是泛素样蛋白家族的新成员,通过 Uba5 (E1) 和UFC1 (E2)共价结合到靶蛋白上[2-3].在人类的基因组中,有12个多E2家族基因.其中,UFC1就是一种E2类似酶[4],特异性地作用于Ufm1.UFC1在泛素系统中的作用越来越引起人们的重视,但对于UFC1的其他功能研究报道还比较少,特别是UFC1在乳腺癌发生和发展中的作用研究还未见报道,有待更进一步的研究和探讨,这是一项全新而有意义的工作.
1 材料与方法
1.1 材料
T4 DNA 聚合酶购自 TaKaRa;RNA反转录试剂盒为Promega公司产品;UFC1多克隆抗体购自Santa Cruz公司;二抗辣根过氧化物酶标记的羊抗兔IgG和辣根过氧化物酶标记的羊抗鼠 IgG 购于Jackson Immuno Research公司;SABC法免疫组化染色试剂盒和GAPDH单克隆抗体购自武汉博士德公司;新鲜的乳腺癌和正常乳腺组织来自湖南省湘雅附二医院的手术切除,所有乳腺癌病例术前均未进行辅助化疗和放疗.
1.2 方法
1.2.1 RT-PCR法检测UFC1基因在组织中的mRNA相对表达水平 TRIZOL法提取乳腺癌组织和正常乳腺组织总 RNA,各取2 μL 进行琼脂糖电泳检测其完整性;取5 μg 总RNA,构成20 μL反应体系,按Promega的反转录试剂盒说明书进行cDNA的合成.根据GenBank ( NM_016406 ) 登录的人UFC1基因序列,应用Primer Premier 5.0 设计上下游引物,以GAPDH为内参照.UFC1引物序列:上游引物5′-GATCGTGAGTTGTGGGTGCA-3′,下游引物5′-TGTTGGATGACGCCCTTCTG-3′,扩增片段长度413bp;GAPDH引物序列:上游引物5′-AATCCCATCACCATCTTCC-3′,下游引物5′-AGTCCTTCCACGATACCAA-3′,扩增片段长度 308 bp.UFC1和GAPDH扩增条件相同,反转录产物2 μL为模板,总反应体积20 μL,扩增条件为:94 ℃ 2 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃ 45 s,30个循环;72 ℃ 10 min.扩增产物经12 g/L琼脂糖凝胶电泳观察后.应用电泳凝胶成像分析系统分析扩增产物的D值并拍照,以UFC1 mRNA与GAPDH mRNA的D值比表示UFC1 mRNA的相对表达水平,以比值大于0.05为阳性表达.
1.2.2 Western blot 法检测UFC1基因在组织中的蛋白质表达水平 Western blot检测新鲜标本40例:乳腺癌组织 20例,癌旁正常乳腺组织 20例,贮存于-80 ℃ .不同乳腺组织各 50 mg,经组织裂解液均浆后置于冰上30 min,12 000 r /min离心15 min,吸取上清为细胞总蛋白.测定蛋白质浓度后,取 50 μg蛋白,向样品中加入适量的6×上样缓冲液,100 ℃水浴10 min,经125 g/L十二烷基硫酸钠聚丙烯酰胺凝胶 ( SDS-PAGE )电泳后,将蛋白质转印至PVDF膜,并用含50 g/L脱脂奶粉的TBS缓冲液封闭30 min;以标准蛋白为参照,随后与一抗(检测UFC1蛋白时用多克隆抗体;检测GAPDH蛋白时用单克隆抗体)结合2 h,用TBST 缓冲液洗膜4次,每次10 min;再与二抗(羊抗兔;羊抗鼠)结合1 h,TBST 缓冲液洗膜4次.最后用化学发光法显影.UFC1蛋白在 19 000处显示特异性条带,以相对分子质量为 36 000的GAPDH为内参.扫描存档并用Image J 软件分析.
1.2.3 免疫组织化学法检测UFC1基因在组织中的表达情况 乳腺癌组织和癌旁正常乳腺组织经常规甲醛固定,石蜡包埋,4 μm厚度连续切片,常规脱蜡.将切片浸入0.01 mol/L枸橼酸盐缓冲液 (pH6.0),电炉或微波炉加热至沸腾后断电,间隔5~10 min后,反复1~2 次进行热修复抗原.冷却后PBS (pH 7.2~7.6)洗涤1~2 次.滴加 50 g/L BSA封闭液,室温20 min.甩去多余液体,不洗.滴加适当稀释的一抗(UFC1多克隆抗体),37 ℃ 1 h左右或20 ℃ 2 h左右.也可 4 ℃过夜.PBS (pH 7.2~7.6)洗2 min×3 次.滴加生物素标记的二抗工作液山羊抗兔IgG, 20~37 ℃ 20 min. PBS (pH 7.2~7.6)洗 2 min×3 次.滴加试剂SABC,20~37 ℃ 20 min.PBS (pH 7.2~7.6)洗 5 min×4 次.最后DAB显色.以 PBS代替一抗作为阴性对照.
1.2.4 统计学分析 所有数据均用均数±标准差表示.用SPSS15.0进行统计处理,统计学采用t检验或方差分析,以P<0.05判定差异的显著性.
2 结果与分析
2.1 UFC1基因在不同乳腺组织中的相对表达水平
使用RT-PCR法检测乳腺癌组织和对应的癌旁正常乳腺组织中UFC1基因的 mRNA的相对表达水平,结果显示,乳腺癌组织中UFC1 mRNA平均相对表达水平为0.587±0.062 (见图1);正常乳腺组织中UFC1 mRNA平均相对表达水平为0.264±0.029(见图2).另外,检测结果还发现,乳腺癌组织与正常乳腺组织中UFC1 mRNA表达水平差异显著,有统计学意义(P<0. 05).
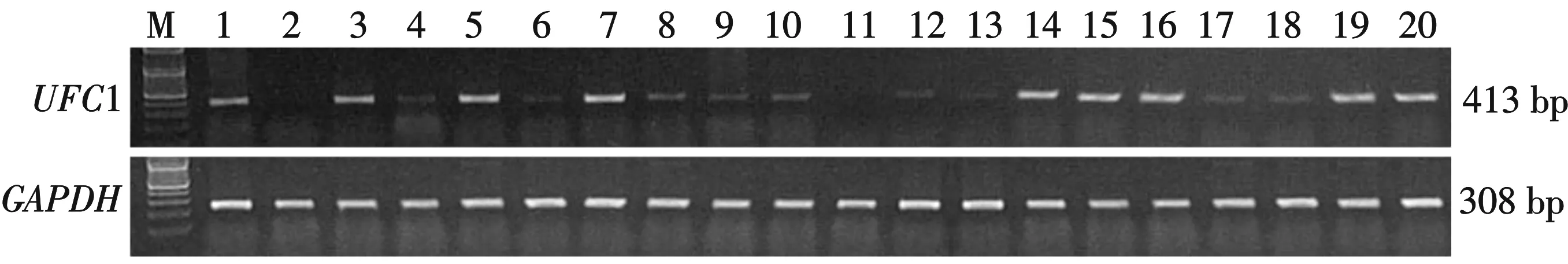
M:Marker;1~20泳道:20例乳腺癌组织;看家基因GAPDH为内参图1 用RT-PCR检测20例乳腺癌组织中UFC1 mRNA的表达

M:Marker;1~20泳道:20例对应的癌旁正常乳腺组织;看家基因GAPDH为内参图2 用RT-PCR检测20例对应的癌旁正常乳腺组织中UFC1 mRNA的表达

1~4泳道:乳腺癌组织(图1中的17~20号标本);5~8泳道:对应的癌旁正常乳腺组织(图2中的17~20号标本);看家基因GAPDH为内参图3 用Western blot 检测UFC1在乳腺癌组织和正常乳腺组织中的表达
2.2 Western blot 检测结果
在预染色蛋白标准约19 000处,可见UFC1特异性蛋白条带.图像分析发现,正常乳腺组织中仅有少量UFC1蛋白的表达.在乳腺癌组织中,UFC1蛋白表达明显增强,是正常乳腺组织表达量的 3.15倍(见图3).UFC1在正常乳腺组织中平均相对表达水平为0.445±0.056,在乳腺癌组织中平均相对表达水平为1.403±0.075,UFC1在乳腺癌中的表达与正常乳腺组织中的表达有显著性差异(P<0. 05)(见表1).
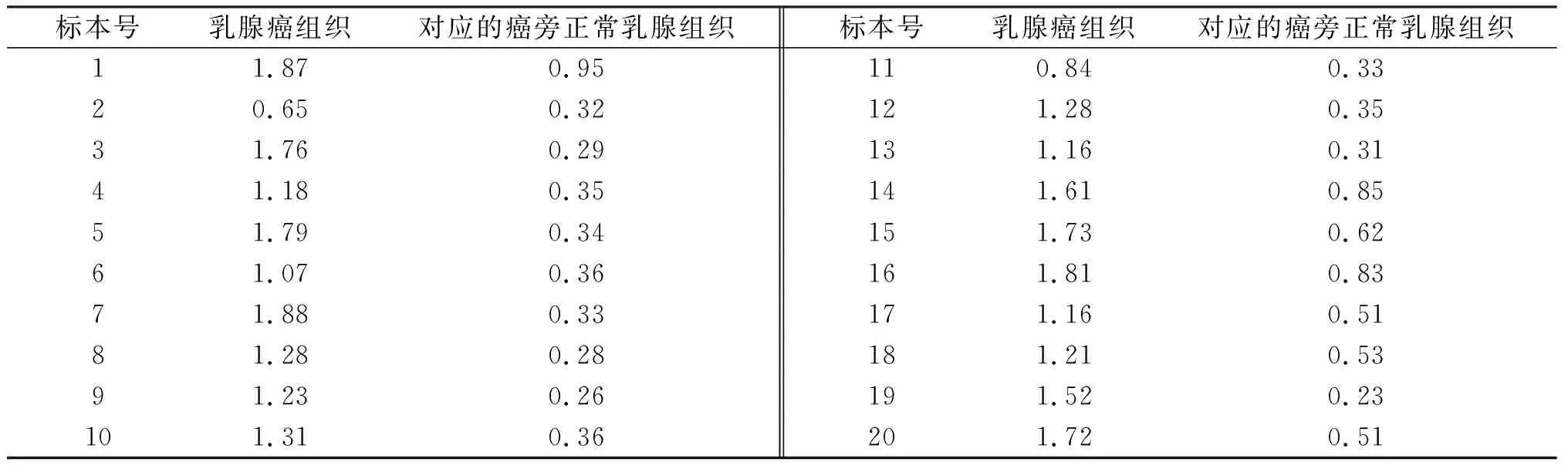
表1 Western blot 检测UFC1在乳腺癌组织和正常乳腺组织中的表达(UFC1/GAPDH的IOD比值)
2.3 免疫组织化学法检测结果
正常乳腺组织切片可见正常乳腺细胞中UFC1的表达很少(图4A、B、C).乳腺癌组织切片可见大量癌细胞呈阳性表达,呈棕黄色,数量多而浓染(图4D、E、F).免疫组织化学法检测结果显示UFC1主要在癌细胞的细胞质中表达.

A:正常乳腺组织(图2中的1号标本);B:正常乳腺组织(图2中的19号标本);C:正常乳腺组织(图2中的20号标本);D:乳腺癌组织(图1中的1号标本); E:乳腺癌组织(图1中的19号标本); F:乳腺癌组织(图1中的20号标本).图片中箭头表示有阳性信号的部位.图4 用免疫组织化学法检测UFC1在正常乳腺组织和乳腺癌组织中的表达
3 讨论
目前对蛋白质泛素化降解途径与肿瘤发生的关系方面的研究取得了长足的进步[5-6],UFC1在泛素系统中的作用越来越引起人们的重视,对其结构的研究越来越多[3-4].已有研究表明:在老鼠体内,Ufm1修饰系统参与了造血的调控[7];在利什曼原虫体内,该系统在线粒体的功能调节中有着重要作用[8].最近还发现了Ufm1修饰系统的类泛素连接酶Ufl1 (E3)和底物C20orf116,它们主要定位于内质网[9].但对于UFC1基因在肿瘤,特别是在乳腺癌方面的作用研究还未见报道.
本实验以UFC1为研究对象,分别应用RT-PCR法、Western-blot 法、免疫组织化学检测 20例乳腺癌患者的乳腺癌组织及其对应的癌旁正常乳腺组织中UFC1基因的表达水平,并进行比较,结果都表明乳腺癌组织中UFC1基因的表达明显高于正常乳腺组织,其表达量的不同,提示UFC1基因与乳腺癌的发生和发展有着密切关系.为将UFC1作为新的靶分子引入肿瘤的临床治疗提供实验依据.因此对乳腺增生性疾病进行UFC1检测有利于早期发现乳腺癌,根据检测结果判断病变向乳腺癌发展的风险性,并有可能通过UFC1抑制剂的应用减少乳腺癌的发生.因此,作者认为UFC1在乳腺癌的发生发展中发挥重要作用,而UFC1 在各种乳腺组织中的作用机制尚待进一步研究.
参考文献:
[1] HERSHKO A. Ubiquitin-mediated protein degradation [J]. J Biol Chem, 1988, 263(30):15237-15240.
[2] KOMATSU M, CHIBA T, TATSUMI K,etal. A novel protein-conjugating system for Ufm1, a ubiquitin-fold modifier [J]. EMBO J, 2004, 23(9):1977-1986.
[3] LIU G, ARAMINI J, ATREYA H S,etal. GFT NMR based resonance assignment for the 21 kDa human proteinUFC1 [J]. J Biomol NMR, 2005, 32(3):261.
[4] MIZUSHIMA T, TATSUMI K, OZAKI Y,etal. Crystal structure of Ufc1, the Ufm1-conjugating enzyme [J]. Biochem Biophys Res Commun, 2007, 362(4):1079-1084.
[5] CROSETTO N, BIENKO M, DIKIC I. Ubiquitin hubs in oncogenic networks [J]. Mol Cancer Res, 2006, 4(12):899-904.
[6] HERSHKO A, CIECHANOVER A, ROSE I A. Resolution of the ATP-dependent proteolytic system from reticulocytes: a component that interacts with ATP[J]. Proceedings of the National Academy of Sciences of the United States of America, 1979, 76(7): 3107-3110.
[7] TATSUMI K, YAMAMOTO-MUKAI H, SHIMIZU R,etal. The Ufm1-activating enzyme Uba5 is indispensable for erythroid differentiation in mice [J]. Nat Prod Commun, 2011, 2:181.
[8] GANNAVARAM S, SHARMA P, DUNCAN R C,etal. Mitochondrial associated ubiquitin fold modifier-1 mediated protein conjugation in Leishmania donovani [J]. Plos One, 2011, 6(1):e16156.
[9] TATSUMI K, SOU Y S, TADA N,etal. A novel type of E3 ligase for the Ufm1 conjugation system [J]. J Biol Chem, 2010, 285(8):5417-5427.

