有机小分子催化的不对称胺化反应的研究进展*1
李艳春, 明俊男, 王斐英, 付记亚, 王琪琳, 徐小英, 王立新
(1. 中国科学院 成都有机化学研究所 手性技术与不对称合成四川省重点实验室,四川 成都 610041; 2. 中国科学院 研究生院,北京 100039)
手性含氮化合物广泛存在于自然界中[1],不对称C-N键形成反应是构建含氮化合物的重要方法,如亚胺[2~5]、硝基烯[6~8]、氰基化合物[7~11]、偶氮二羧酸酯[RO2CN=NCO2R(1a~1d, R=Et, Bn,t-Bu,i-Pr)][12~15]等参与的不对称反应。其中1参与的不对称催化反应是形成C-N键的重要方法之一,催化剂主要包括金属催化剂及有机小分子催化剂。近年来,有机小分子催化的不对称胺化反应得到了很大的发展,各种不同的有机小分子催化剂被用于催化不对称胺化反应。
本文根据催化剂的类型并结合其反应机理,介绍近几年来以1作氮源的有机小分子催化的不对称胺化反应的研究进展。
1 脯氨酸及其衍生物作催化剂
Jørgensen[12]和List[13]报道了L-脯氨酸(L-proline)催化的醛(2)与1a,1b或1c的不对称胺化反应(Scheme 1),取得了很好的收率(57%~92%)和对映选择性(89%ee~95%ee)[12]。
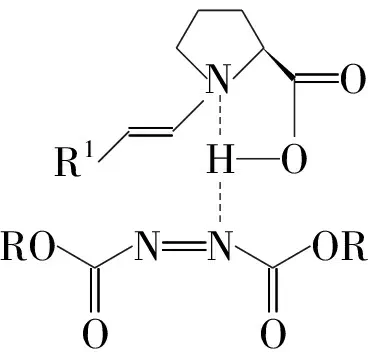
Chart 1
基于胺化产物的绝对构型,作者提出了反应的过渡态模型如Chart 1所示: L-proline的仲胺与醛形成烯胺,活化醛;L-proline的羧基质子与1的氮形成氢键,活化1。该不对称胺化反应可以由廉价易得的原料和催化剂方便地得到手性氨基醛、氨基醇、氨基酸等。
Jørgensen等[14]研究发现,L-proline也能很好地催化酮(3)与1a的反应(Scheme 2),高收率(67%~92%)和高对映选择性(79%ee~99%ee)地得到亚甲基胺化产物4。
Bräse等[15]采用L-proline催化大位阻的支链醛(5)与1a或1b的反应构建季碳中心的含氮化合物。以二氯甲烷为溶剂,于室温反应,但结果并不理想(Scheme 3),反应时间较长。他们[16,17]进一步研究发现,以乙腈为溶剂,在微波条件下于60 ℃反应,反应时间明显缩短,且收率(52%~99%)和对映选择性(52%ee~90%ee)都有提高。
Barbas等[18]发现L-proline也能很好的催化醛,丙酮和1b的不对称串联反应,反应取得了较好的收率(75%~85%)和对映选择性(99%ee)(Scheme 4)。作者将该反应用于合成肾素抑制剂氨基二醇。在前面研究的基础上,他们[19]发现L-proline还能很好地催化2,3-二氢-1H-茚-1-甲醛(8)的不对称胺化反应,高选择性地得到胺化产物9(Scheme 5),9是一类重要的药物骨架结构(如代谢型谷氨酸受体拮抗剂AIDA, APICA)。
Adolfsson等[20]合成了一系列脯氨酸衍生的仲胺砜类催化剂,用来催化醛与1的不对称胺化反应,通过催化剂的筛选,10a(Chart 2)的催化效果最好,最高得到87%ee的胺化产物。
Barbas等[21]设计了仲胺四唑催化剂10b(Chart 2)用于催化支链醛(5a, R1=Me, R2=BrC6H4-, Scheme 3)与1b的反应,得到了80%ee的对应胺化产物。Ley等[22]也用10b催化醛与1的不对称胺化反应,胺化产物不经处理直接与含一个烯丙基的季磷盐反应,中间经不稳定的膦叶立德中间体(11),再发生分子内的Wittig反应,得到高对映选择性的1,6-二氢哒嗪类化合物(12, Scheme 6)。
Jørgensen等[23]发现在脯氨酸硅醚(10c, Chart 3)作用下,α,β-不饱和醛(13)与硫醇(14)发生1,4-共轭加成,同时,加成产物在10c的活化下与1发生Michael加成反应,再经还原、环化得到含两个手性中心的加成产物15(Scheme 7)。他们还发现以琥珀酰亚胺(16)为给体时,也可以得到很好的结果(17, Scheme 8)[24]。其反应历程为:在酸性条件下,10c与13缩合脱水得α,β-不饱和亚胺正离子,再与16发生1,4-加成得烯胺中间体,随后再与1a发生亲核加成,催化剂离去得17。他们[25]发现10c还能很好地催化1对13的γ-胺化反应,以苯甲酸作添加剂时得到中等收率(40%~58%)和高对映选择性(88%ee~93%ee, Scheme 9)。通过理论计算和实验证明了其催化机理为:10c与底物13形成烯胺二烯体中间体烯胺二烯(19),从而达到由13的缺电子二烯体转变为富电子的19;19与1会同时发生[4+2]环加成和γ-胺基化反应,但环加成产物易水解,由动态平衡最后得到热力学稳定的18。
2 金鸡纳碱衍生物作催化剂
2004年,Jørgensen课题组[26]首次报道了金鸡纳碱类衍生物20(Chart 3)催化的α-腈基取代的酯23的不对称胺化反应,1的取代基对反应活性及立体控制起关键作用,当R为大位阻的t-Bu时反应结果最好,ee值达到98%。催化剂20对该反应有很好的普适性,不论23之Ar的取代基是吸电子的还是供电子的,或者杂原子的噻吩,都能得到很好的反应结果(收率95%~99%, 91%ee~98%ee),而取代基的位置对反应结果影响不大(Scheme 10)。
当β-酮酸酯或β-二酮为给体时,也能得到较好的收率(86%~99%)和对映选择性(83%ee~90%ee)。Deng Li等[27]发现以金鸡纳碱类衍生物21c(Chart 3)催化23的胺化反应时,可以得到更好的结果(收率96%~99%, 93%ee~99%ee),21c对该反应有更好普适性。
2005年,Jørgensen等[28]设想用手性有机碱来活化烯丙基位的碳氢键,再与亲电试剂发生不对称反应从而得到官能团化的烯丙基类化合物。基于此作者采用金鸡纳碱类催化剂催化α-腈基取代烯丙基化合物24与1的不对称胺化反应,经过对反应条件的系统优化,作者发现催化剂22a(Chart 3)的催化效果最好,对反应底物进行了扩展,发现22a的使用范围广,且当底物为四取代烯时,也得到了高达88%ee的γ-胺化产物25(Scheme 11)。

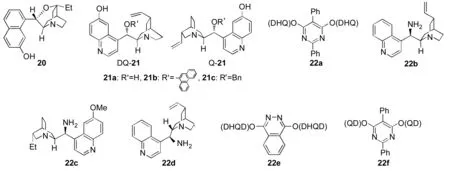
Chart 3
陈应春等[29]用金鸡纳碱类衍生物22b(Chart 3)为催化剂,对大位阻的芳酮3与1的不对称胺化反应进行了研究,通过反应条件的优化发现以对甲苯磺酸为添加剂、异丙醇为溶剂,室温下反应可以取得很好的收率(39%~77%)和对映选择性(88%ee~99%ee)。
P Melchiorre课题组[30]也用金鸡纳碱衍生的手性伯胺22c(Chart 3)为催化剂,以三氟乙酸(TFA)为添加剂催化α-取代的吲哚26,α,β-不饱和醛27与1的cascade反应,该反应是Michael加成反应和胺化反应的串联反应(Scheme 12)。用此方法可以有效地得到含有两个手性中心,且有一个手性中心是季碳的高光学纯的多官能团的胺化产物。
Lu课题组[31]发现以金鸡纳碱类衍生物22d(Chart 3)为催化剂,樟脑磺酸为添加剂来催化支链醛5与1的反应,可以得到很好的收率(80%~99%)和对映选择性(68%ee~99%ee)的胺基化产物。
氧化吲哚的不对称胺化产物是多种生物活性分子和药物分子的核心骨架。陈拥军等[32]首次用金鸡纳碱类衍生物22e(Chart 3)来催化氧化吲哚30与1d的不对称胺化反应,取得很好的收率和对映选择性(Scheme 13)。同时,周建等[33]发现催化剂22f(Chart 3)也能很好的催化30与1d的不对称胺化反应,并且也得到了很好的结果(收率90%~98%, 82%ee~94%ee)。Barbas研究小组[34]采用22e催化N-取代的氧化吲哚与1d的不对称胺化反应,也取得了很高的收率(57%~92%)和对映选择性(87%ee~98%ee)。

3 相转移催化剂
Maruoka等[35,36]设计出以联萘为手性骨架的新型手性季磷盐相转移催化剂32(Chart 4),并首次成功地将其用于催化β-酮酸酯33,β-二酮的不对称胺化反应(Scheme 14)。他们[37]还开发了更为稳定的季铵盐催化剂35a~35c(Chart 4)用于催化该胺化反应。当为大位阻的叔丁基取代时催化剂35c有更好的立体选择性,产物的ee值最高达到97%。该方法可以用来合成羟醛还原酶抑制剂AS-3201的中间体。
4 轴手性胍类催化剂
近年来,胍类催化剂作为有机小分子催化剂得到了很大的发展。2006年,Hitoshi Ube课题组[38]首次将手性胍类催化剂36a(Chart 5),用于催化1,3-二羰基化合物37的不对称胺化反应(Scheme 15),取得了很好的反应结果(收率54%~99%, 15%ee~98%ee)。作者认为催化机理如Chart 5所示:胍夺取37之α-H并与其形成多氢键活化1,3-二羰基化合物,具有轴手性的联萘结构以及与萘环连接的芳香基团的空间位阻来控制立体选择性,因此萘环上芳基的位阻对该反应的对映选择选性有很大的影响。随后,Nakano等[39]将36a用于α-腈基取代的硫代酯与1c的不对称胺化反应,得到了高对映选择性的胺化产物。
5 双功能硫脲类催化剂
Takemoto课题组[40]报道用叔胺-硫脲双功能催化剂39a(Chart 6)来催化33与1c的不对称胺化反应,反应取得了很好的收率(52%~99%)及对映选择性(80%ee~90%ee)。随后,Kim课题组[41]发现用大位阻的叔胺硫脲催化剂39b(Chart 6)催化此反应,催化效果更好。作者认为叔胺可以夺去羰基α-H而使羰基化合物烯醇化后与叔胺形成离子对,而使羰基化合物得到活化,39b与1c的羰基形成双氢键,活化1。Rawal课题组[42]开发了新型的叔胺芳酸催化剂40(Chart 6),以其催化37与1c的不对称胺化反应。在很温和的条件下得到了高收率(90%~99%)和高对映选择选(88%ee~98%ee)的胺化产物(38)。
我们课题组[43,44]用仲胺硫脲催化剂39c(Chart 7)分别催化直链醛和大位阻的支链醛与1的不对称胺化反应,都取得了很好的收率(65%~97%[43], 52%~99%[44])和对映选择性(77%ee~99%ee[43], 81%ee~97%ee[45])。
6 其它催化剂
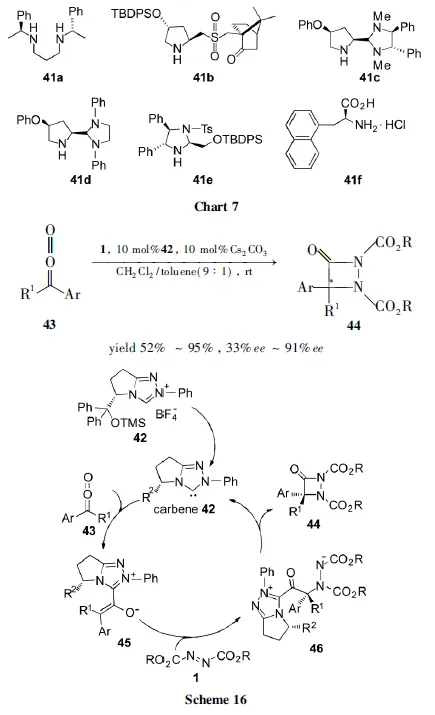
Juaristi课题组[45]用简单易得的苯乙胺衍生的仲胺催化剂41a(Chart 9)来催化23的不对称胺化反应,得到最高达84%ee的胺化产物24。Chen Kwunmin等[46]发现脯氨醇衍生的仲胺砜类催化剂41b(Chart 7)催化醛的不对称胺化反应,得到了很好的收率(79%~95%)和对映选择性(92%ee~99%ee)。Alexakis等[47]和Wills等[48]分别用脯氨醇衍生的咪唑41c~41e(Chart 7)催化此反应,都得到了不错的结果。我们课题组[49]发现3-(1-萘基)-L-丙氨酸的盐酸盐41f(Chart 7)能很好的催化支链醛5与1a或1d的不对称胺化反应,得到了不错的收率(99%)和对映选择性(97%ee)。
叶松课题组[48]报道了[2+2]环化反应。在N-杂环卡宾42的催化下,芳基乙烯酮(43)与1发生[2+2]环化反应,生成aza-β-内酰胺(44, Scheme 16)。反应历程为:42进攻43得到烯醇化中间体45;45再与1发生亲核加成,生成中间体46;46发生自身合环,催化剂离去得44。
7 结束语
近年来,报道了很多以偶氮二羧酸酯作氮源的有机小分子催化的不对称胺化反应,为合成手性含氮化合物提供了方法。这些方法具有操作简单,环境友好等优点,许多方法已经小规模应用到药物及天然产物的合成中,具有潜在的工业应用前景。
[1] Genet J P, Greck C, Lavergne D. In modern amination methods[M].Ed R A,Wiley-VCH:Weinheim,2000.
[2] Córdova A, Notz W, Barbas III C F,etal. A highly enantioselective amino acid-catalyzed route to functionalizedγ-amino acids[J].J Am Chem Soc,2002,124:1842-1843.
[3] Nugent B M, Yoder R A, Johnston J N. Chiral proton catalysis:A catalytic enantioselective direct Aza-Henry reaction[J].J Am Chem Soc,2004,126:3418-3419.
[4] Li C Q, Wang C, Xiao J L,etal. Chiral counteranion-aided asymmetric hydrogenation of acyclic imines[J].J Am Chem Soc,2008,130:14450-14451.
[5] Chen Y J, Seki K, Kobayashi S,etal. Catalytic carbon-carbon bond-forming reactions of aminoalkane derivatives with imines[J].J Am Chem Soc,2010,132:3244-3245.
[6] Li H M, Wang B M, Deng L. Enantioselective nitroaldol reation ofα-ketoesters catalyzed by cinchona alkaloids[J].J Am Chem Soc,2006,128:732-733.
[7] Taylor M S, Jacobsen E N. Asymmetric catalysis by chiral hydrogen-bond donors[J].Angew Chem Int Ed,2006,45:1520-1543.
[8] Chen X H, Feng X M. A secondary amine amide organocatalyst for the asymmetric nitroaldol reaction ofα-ketophosphonates[J].Chem Eur J,2008,14:10896-10899.
[9] Li H M, Song J, Deng L,etal. Catalytic enantioselective C-C bond forming conjugate additions with vinyl sulfones[J].J Am Chem Soc,2005,127:8948-8949.
[10] Wang X S, Kitamura M, Maruoka K. New,chiral phase transfer catalysts for effecting asymmetric conjugate additions ofγ-alkyl-γ-cyanoacetates to acetylenic esters[J].J Am Chem Soc,2007,129:1038-1039.
[11] Marini F, Sternativo S, Testaferri L,etal. Enantioselective organocatalytic michael addition ofα-substituted cyanoacetates toα,β-unsaturated selenones[J].Adv Synth Catal,2009,351:103-106.
[13] List B. Direct catalytic asymmetricα-amination of aldehydes[J].J Am Chem Soc,2002,124:5656-5657.
[14] Kumaragurubaran N, Juhl K, Zhuang W,etal. Direct L-proline catalyzed asymmetricα-amination of ketones[J].J Am Chem Soc,2002,124:6254-6255.
[15] Vogt H, Vanderheiden S, Bräse S. Proline-catalysed asymmetric amination ofα,α-disubstituted aldehydes:Synthesis of configurationally stable enantioenrichedα-aminoaldehydes[J].Chem Commun,2003:2448-2449.
[16] Baumann T, Bächle M, Hartmann C,etal. Thermal effects in the organocatalytic asymmetricα-amination of disubstituted aldehydes with azodicarboxylates:A high-temperature organocatalysis[J].Eur J Org Chem,2008:2207-2212.
[17] Hartmann C E, Baumann T, Bächle M,etal. Asymmetric synthesis of deuterated and fluorinated aromaticα,α-disubstituted amino acid derivatives[J].Tetrahedron:Asymmetry,2010,21:1341-1349.
[18] Chowdari N S, Ramachary D B, Barbas III C F. Organocatalytic asymmetric assembly reactions:One-pot synthesis of functionalizedβ-amino alcohols from aldehydes, ketones, and azodicarboxylates[J].Org Lett,2003,5:1685-1688.
[19] Suri J T, Steiner D D, BarbasⅢ C F. Organocatalytic enantioselective synthesis of metabotropic glutamate receptor ligands[J].Org Lett,2005,7:3885-3888.
[20] Dahlin N, Bevig A, Adolfsson H.N-arenesulfonyl-2-aminomethylpyrrolidines——Novel modular ligands and organocatalysts for asymmetric catalysis[J].Adv Synth Catal,2004,346:1101-1105.
[21] Chowdari N S, Barbas Ⅲ C F. Total synthesis of LFA-1 antagonist BIRT-377 via organocatalytic asymmetric construction of a quaternary stereocenter[J].Org Lett,2005,7:867-870.
[22] Oelke A J, Kumarn S, Ley S V,etal. An enantioselective organocatalytic route to chiral 3,6-dihydropyridazines from aldehydes[J].Synlett,2006:2548-2552.
[23] Marigo M, Schulte T, Jrgensen K A,etal. Asymmetric multicomponent domino reactions and highly enantioselective conjugated addition of thiols toα,β-unsaturated aldehydes[J].J Am Chem Soc,2005,127:15710-15711.
[24] Jiang H, Nielsen J B, Jrgensen K A. Organocatalysed asymmetricα-amination and multicomponent syn-selective diamination ofα,β-unsaturated aldehydes[J].Chem Eur J,2007,13:9068-9075.
[25] Bertelsen S, Marigo M, Jrgensen K A,etal. Dienamine catalysis:Organocatalytic asymmetricγ-amination ofα,β-unsaturated aldehydes[J].J Am Chem Soc,2006,128:12973-12980.
[26] Saaby S, Bella M, Jrgensen K A. Asymmetric construction of quaternary stereocenters by direct organocatalytic amination ofα-substitutedα-cyanoacetates andβ-dicarbonyl compounds[J].J Am Chem Soc,2004,126:8120-8121.
[27] Liu X M, Li H M, Deng L. Highly enantioselective amination ofα-substitutedα-cyanoacetates with chiral catalysts accessible from both quinine and quinidine[J].Org Lett,2005,7:167-169.
[28] Poulsen T B, Alemparte C, Jrgensen K A. Enantioselective organocatalytic allylic amination[J].J Am Chem Soc,2005,127:11614-11615.
[29] Liu T Y, Cui H L, Chen Y C,etal. Organocatalytic and highly enantioselective directγ-amination of aromatic ketones[J].Org Lett,2007,9:3671-3674.
[30] Galzerano P, Melchiorre P. Asymmetric organocatalytic cascade reactions withα-substitutedα,β-unsaturated aldehydes[J].Angew Chem Int Ed,2009,48:7892-7894.
[31] Liu C, Zhu Q, Huang K W,etal. Primary amine/CSA ion pair:A powerful catalytic system for the asymmetric enamine catalysis[J].Org Lett,2011,13:2638-2641.
[32] Cheng L, Liu L, Chen Y J,etal. Highly enantioselective and organocatalyticγ-amination of 2-oxindoles[J].Org Lett,2009,11:3874-3877.
[33] Qian Z Q, Zhou F, Zhou J,etal. Asymmetric construction of quaternary stereocenters by direct organocatalytic amination of 3-substituted oxindoles[J].Chem Commun,2009:6753-6755.
[34] Bui T, Borregan M, Barbas III C F. Expanding the scope of cinchona alkaloid-catalyzed enantioselectiveα-aminations of oxindoles:A versatile approach to optically active 3-amino-2-oxindole derivatives[J].J Org Chem,2009,74:8935-8938.
[35] He R J, Wang X S, Maruoka K J. Binaphthylmodified quaternary phosphonium salts as chiral phase transfer catalysts:Asymmetric amination ofβ-keto esters[J].Angew Chem Int Ed, 2008,47:9466-9468.
[36] He R J, Maruoka K J. Binaphthyl-modified quaternary phosphonium salts as chiral phase transfer catalysts:Asymmetric amination ofβ-keto esters[J].Synthesis,2009:2289-2292.
[37] Lan Q, Wang X S, He R J,etal. Highly efficient asymmetric amination ofβ-keto esters catalyzed by chiral quaternary ammonium bromides[J].Tetrahedron Lett,2009,50:3280-3282.
[38] Terada M, Nakano M, Ube H. Axially chiral guanidine as highly active and enantioselective catalyst for electrophilic amination of unsymmetrically substituted 1,3-dicarbonyl compounds[J].J Am Chem Soc,2006,128:16044-16045.
[39] Terada M, Tsushima D, Nakano M. Enantioselective electrophilic amination ofα-cyanothioacetates with azodicarboxylates catalyzed by an axially chiral guanidine Base[J].Adv Synth Catal,2009,351:2817-2821.
[40] Miyabe H, Takemoto Y. The amino thiourea-catalyzed asymmetric nucleophilic reactions[J].Chimia,2007,61:269-275.
[41] Jung S H, Kim Y. Catalytic enantioselective electrophilicα-hydrazination ofβ-ketoesters using bifunctional organocatalysts[J].Tetrahedron Lett,2008,49:5527-5530.
[42] Konishi H, Lam T Y, Malerich J P,etal. Enantioselectiveγ-amination of 1,3-dicarbonyl compounds using squaramide derivatives as hydrogen bonding catalysts[J].Org Lett,2010,12:2028-2031.
[43] Fu J Y, Huang Q C, Wang L X,etal. Highly effective and enantioselectiveα-amination of aldehydes promoted by chiral proline amide-thiourea bifunctional catalysts[J].Tetrahedron Lett,2010,51:4870-4873.
[44] Fu J Y, Xu X Y, Wang L X,etal. Effective construction of quaternary stereocenters by highly enantioselectiveα-amination of branched aldehydes[J].Org Biomol Chem,2010,8:4524-4526.
[45] Liu Y J, Roberto M F, Juaristi E. Enantioselective amination ofα-phenyl-α-cyanoacetate catalyzed by chiral amines incorporating theα-phenylethyl auxiliary[J].J Org Chem 2007,72:1522-1525.
[46] Liu P M, Chang C, Chen K,etal. Remarkable reaction rate and excellent enantioselective directα-amination of aldehydes with azodicarboxylates catalyzed by pyrrolidinylcamphor-derived organocatalysts[J].Eur J Org Chem,2010:42-46.
[47] Quintard A, Belot S, Alexakis A,etal. Aminal-pyrrolidine organocatalysts——highly efficient and modular catalysts forα-functionalization of carbonyl compounds[J].Eur J Org Chem,2010:927-936.
[48] Gosiewska S, Soni R, Wills C,etal. Synthesis and use of a stable aminal derived from TsDPEN in asymmetric organocatalysis[J].Tetrahedron Lett,2010,51:4214-4217.
[49] Fu J Y, Yang Q C, Wang L X,etal. Enantioselective-amination of branched aldehydes promoted by simple chiral primary amino acids[J].J Org Chem,2011,76:4661-4664.
[50] Huang X L, Chen X Y, Ye S. Enantioselective synthesis of aza-β-lactams via NHC-catalyzed [2+2] cycloaddition of ketenes with diazenedicarboxylates[J].J Org Chem,2009,74:7585-7587.

