肝素纯化工艺中离子交换树脂的选择与应用研究
宋大巍,李良玉,张丽萍,2*
1黑龙江省农产品加工工程技术研究中心;2黑龙江八一农垦大学食品学院,大庆163319
肝素纯化工艺中离子交换树脂的选择与应用研究
宋大巍1,李良玉1,张丽萍1,2*
1黑龙江省农产品加工工程技术研究中心;2黑龙江八一农垦大学食品学院,大庆163319
研究比较了5种树脂对肝素的吸附能力,从中选出S5428阴离子交换树脂来纯化肝素。通过对各因素的研究,确定了树脂对肝素的静态、动态吸附以及解吸的最佳条件。结果表明:静态吸附的温度45℃,pH 8.0的条件下吸附2 h,肝素的吸附率为90.5%;层析柱的动态吸附温度45℃,肝素溶液进样浓度1.0 mg/mL,进样速度1.5 mL/min,树脂柱能处理1.5 BV肝素液而不发生泄露,吸附量为3.05 mg/mL,达到饱和吸附时可处理4 BV的料液,吸附量为9.18 mg/mL;采用2.0 mol/L NaCl洗脱,洗脱流速1.5 mL/min,肝素解吸率可达95.8%,肝素效价可达150 U/mg,效价回收率98%。
肝素;离子交换树脂;吸附;层析
肝素是一种由艾杜糖醛酸和葡萄糖醛酸双糖重复单位组成的酸性黏多糖,具有抗凝、抗血栓形成,还有抗炎、抗过敏等多种生物学功能[1]。组织内的肝素与其他粘多糖在一起和蛋白质相结合,粗品肝素中含有其它粘多糖,也含有大量未除尽的蛋白质和核酸类物质,从而使粗品肝素的效价过低[2,3]。国内目前纯化肝素的方法主要采用高锰酸钾氧化法、过氧化氢一高锰酸钾组合氧化法,过氧化氢二次氧化法。但缺点是产品的色泽差,肝素的效价较低,氧化过程对肝素的结构会产生破坏作用[4]。也有学者研究采用三氯化铝,凹凸棒土和活性炭等精制肝素的工艺,但效果不佳[5,6]。国外很多学者很早就研究应用离子交换层析方法纯化肝素,并取得满意效果。Geeen在60年代最早使用Dowex-1、Dowex-2、Dowex-3及Amberlite G-45对肝素进行分级分离,讨论了洗脱条件[7]。90年代,karlsson等使用DEAESephacle离子交换柱,把商品肝素分为不同的组分,讨论了各种组分的生物活性[8]。Louis等采用Sephadex A-25进行离子交换,再使其在Sephacryl-200进行凝胶过滤而得纯化肝素[9]。近年来国内也有报道采用离子交换层析纯化肝素[10,11],柱层析介质多采用国产的大孔径离子交换树脂[12],其特点是动态分离效果好、连续化程度高、运行周期短、树脂可再生重复利用、设备简单,是一经济有效的方法。但国产离子交换树脂纯化肝素,存在树脂机械强度低,纯化后肝素的提取率低,效价低,产品颜色不佳等问题。因此本研究综合前人的研究结果,根据肝素中杂质的种类和性质,可利用离子交换树脂对粗品肝素进行纯化,在五种树脂中进行筛选,并通过静态吸附和动态吸附实验,确定肝素的最佳纯化工艺,为得到高纯度、高效价肝素和工业化生产提供技术参数。
1 材料与方法
1.1 试验原料
粗品猪小肠肝素(实验室自制);肝素标准品购买于中国药物生物检定所(北京);其他的试剂均为市售(分析纯);透析袋(截留分子量为1KDa),Roehe;S5428树脂(北京百迪信公司);D208树脂,江阴有机化工厂;D290树脂,天津南开大学树脂厂; D254树脂,杭州争光树脂有限公司;D202树脂,蚌埠市天星树脂有限公司。
1.2 试验设备
层析柱(1.6 cm×100 cm),上海精科实业有限公司;HL-2D定时数显恒流泵,上海精科实业有限公司;JJ-1精密定时电动搅拌器,江苏荣华仪器有限公司;T6紫外-可见分光光度计,北京普析通用仪器有限责任公司;HZQ-QX全温振荡器,哈尔滨市东联电子技术开发有限公司;AP2140电子分析天平,梅特勒-托利多仪器有限公司;TGL-16B型高速离心机,上海森信试验仪器有限公司;R-205型旋转蒸发仪,上海申胜生物技术有限公司;DZF-6032型真空干燥箱,上海一恒科学仪器有限公司。UV-265FW型傅立叶红外光谱仪,日本岛津。
1.3 试验方法
1.3.1 浓硫酸氧化法检测肝素含量
采用浓硫酸氧化法来检测溶液中肝素的含量,使用猪小肠肝素标准品来制作标准曲线,准确称取肝素标准品,配成482 ug/mL肝素水溶液,再按0.1、0.3、0.5、0.7、0.9、1.1 mL的浓度梯度,分别吸取不同体积的肝素水溶液,每份中加入3 mL含0.025 M硼砂的90%的硫酸水溶液,充分摇匀,置于90℃水浴中,经常搅动,10 min后取出,冷至室温,30 min后采用T6紫外-可见分光光度计测定298 nm光密度(另做不加肝素,以水代之的空白实验作对照)。按照各组试验数据可绘制出标准曲线根据标准曲线方程计算溶液中的肝素含量[13]。
1.3.2 树脂静态吸附动力学试验和树脂筛选试验
将5种已处理好的离子交换树脂分别准确称取10 mL,置于于250 mL三角瓶中,分别向三角瓶内加入100 mL,浓度为1 mg/mL的肝素溶液,在45℃,140 rpm摇床下静态吸附,每隔一定时间测吸附液肝素含量,连续测定12 h,计算树脂对肝素的吸附量与时间的关系,绘制树脂静态吸附动力学曲线,并计算树脂的吸附率。将吸附达到饱和的树脂水洗后,再加入2 M NaCl溶液在45℃,140 rpm摇床下静态解吸,收集解吸液,测定肝素浓度,计算解吸率。通过比较对肝素的吸附和解吸效果筛选出最佳的树脂。吸附率和解吸率的计算公式如下:

在式(1)和(2)中:A为吸附率;D为解吸率;C0为吸附原液中肝素的浓度;V0为吸附原液体积;Ce为肝素的平衡浓度(静态试验),或上柱和水洗时流出液体合并后溶液中肝素的浓度(动态实验);CD为解吸液中肝素的浓度;Ve为吸附原液体积(静态实验,等于V0),或上柱和水洗时流出液合并混匀后的体积(动态实验);V为湿树脂体积;VD为解吸液体积。
1.3.3 树脂静态吸附试验
1.3.3.1 温度对树脂静态吸附的影响
准确量取10 mL已筛选出的湿树脂于250 mL三角瓶中,向三角瓶内加入100 mL,浓度1 mg/mL的肝素溶液(pH 8.0),分别于25、30、35、40、45℃和50℃条件下摇床振荡4 h,为降低引入的误差,每个实验做三个平行样,采用T6紫外-可见分光光度计,用浓硫酸氧化法测定吸附后液体在298 nm处的吸光度,计算吸附率。
1.3.3.2 时间对树脂静态吸附的影响
准确量取10 mL已筛选出的湿树脂于250 mL三角瓶中,向三角瓶内加入100 mL,浓度1 mg/mL的肝素溶液(pH 8.0),在45℃条件下恒温振荡1、2、3、4 h和5 h,为降低引入的误差,每个实验做三个平行样采用T6紫外-可见分光光度计,用浓硫酸氧化法测定吸附后液体在298 nm处的吸光度,计算吸附率。
1.3.3.3 pH对树脂静态吸附的影响
准确量取10 mL已筛选出的湿树脂于250 mL三角瓶中,向三角瓶内加入pH分别为6、7、8、9、10的100 mL,浓度1 mg/mL的肝素溶液,在45℃条件下恒温振荡2 h,为降低引入的误差,每个实验做三个平行样,采用T6紫外-可见分光光度计,用浓硫酸氧化法测定吸附后液体在298 nm处的吸光度,计算吸附率。
1.3.4 树脂动态吸附试验
1.3.4.1 进样速度对动态吸附的影响
将筛选出的已预处理好的90 mL S5428树脂湿法装柱于带有夹套恒温水浴的层析柱内(1.6 cm× 100 cm),夹层温度设定为45℃。用去离子水进行平衡树脂,平衡后将浓度为1 mg/mL的肝素溶液用恒流泵分别以0.5、1.0、1.5、2.0 mL/min和2.5 mL/min的流速泵入层析柱进行吸附,分别收集流出液,采用T6紫外-可见分光光度计,用浓硫酸氧化法测定流出液在298 nm处的吸光度,计算吸附率。
1.3.4.2 进样浓度对动态吸附的影响
用“1.3.4.1”同样的层析柱,去离子水平衡后,用恒流泵以1.5 mL/min的流速分别将配制好的浓度分别为0.5、1.0、1.5、2.0 mg/mL和2.5 mg/mL肝素溶液泵入层析柱进行吸附,分别收集流出液,采用T6紫外-可见分光光度计,用浓硫酸氧化法测定流出液在298 nm处的吸光度,按“1.3.2”的公式计算计算吸附率。
1.3.4.3 S5428树脂吸附渗漏曲线
用“1.3.4.1”同样的层析柱,去离子水平衡后,待树脂平衡后用恒流泵将浓度为1 mg/mL,pH 8.0的肝素溶液,以1.5 mL/min的流速通过树脂柱进行吸附,收集流出液,采用T6紫外-可见分光光度计,用浓硫酸氧化法测定流出液在298 nm处的吸光度,绘制树脂吸附渗漏曲线,计算饱和动态吸附量。
1.3.5 树脂动态解吸条件试验
1.3.5.1 洗脱液浓度的确定
用“1.3.4.1”同样的层析柱,去离子水平衡后,将100 mL浓度为1.0 mg/mL的肝素样品液以1.5 mL/min的流速通过层析柱进行吸附后,依次用300 mL蒸馏水洗涤,分别用浓度为0.5、1.0、2.0、3.0 mol/L和4.0 mol/L的NaCl溶液进行洗脱,分别收集洗脱液,采用T6紫外-可见分光光度计,用浓硫酸氧化法测定流出液在298 nm处的吸光度,按“1.3.2”的公式计算解吸率,以解吸率为指标优化洗脱液浓度对解吸效果的影响。
1.3.5.2 洗脱流速的确定
用“1.3.4.1”同样的层析柱,去离子水平衡后,将100 mL浓度为1.0 mg/mL的肝素样品液以1.5 mL/min的流速通过层析柱进行吸附后,依次用300 mL蒸馏水洗涤,分别用浓度为2.0 mol/L的NaCl溶液以0.5、1.0、1.5、2.0 mL/min和2.5 mL/min的流速进行洗脱,分别收集洗脱液,采用T6紫外-可见分光光度计,用浓硫酸氧化法测定流出液在298 nm处的吸光度,按“1.3.2”的公式计算解吸率,以解吸率为指标优化洗脱流速对解吸效果的影响。
2 结果与分析
2.1 浓硫酸氧化法检测肝素标准曲线
以肝素浓度为横坐标X,肝素在298 nm的吸光度为纵坐标Y,根据测定结果绘制标准工作曲线,试验结果得到线性回归方程为:Y=0.0039X+0.052,回归方程的决定系数R2=0.9994,说明方程拟合较好。
2.2 树脂静态吸附动力学曲线及树脂筛选结果
5种离子交换树脂的吸附率与解吸率结果见表1。由表1可知,S5428树脂对肝素有较好的吸附量和解吸率。

表1 五种离子交换树脂的静态吸附结果Table 1 Absorption results of five macroporous ion exchange resins

图1 树脂静态吸附动力学曲线Fig.1 Absorption dynamic curves of macroporous ion
45℃时各树脂对肝素的静态吸附动力学曲线如图1。从图1中可以看出,S5428树脂起始阶段的吸附量较大,然后逐渐增加,达到吸附平衡的时间较长,为属于快速平衡型的吸附剂;D254、D290、D208和D202几种树脂树脂起始阶段的吸附量较小,达到吸附平衡的时间长,平衡吸附量也不是很大,为慢速平衡型的吸附剂。在试验过程中,不仅要考虑吸附剂吸附量的大小,而且要考虑时间因素,从吸附动力学曲线所表现出的吸附量与时间的关系看,S5428树脂对肝素的吸附40 min内即达到平衡,而其他几种树脂吸附量一直缓慢上升,吸附平衡时间较长,综合考虑树脂对肝素吸附特性,选择S5428树脂作为肝素的纯化树脂。
2.3 静态吸附试验结果
2.3.1 温度对S5428树脂吸附效果的影响
图2是S5428树脂静态吸附试验得到的温度-吸附率变化曲线图。从图2中可以看出,温度对离子交换树脂的吸附性能影响比较大。温度在25~45℃区间内吸附率逐渐增大,超过45℃后吸附率下降较为明显。分析认为,温度升高有利于分子的扩散速度加快,有利于肝素的吸附,但是温度高于45℃时,由于S5428树脂的耐氧化性能差,高温会使树脂的性能受到影响、使用寿命降低、吸附效率下降,因此选择45℃的吸附温度度较为适宜。
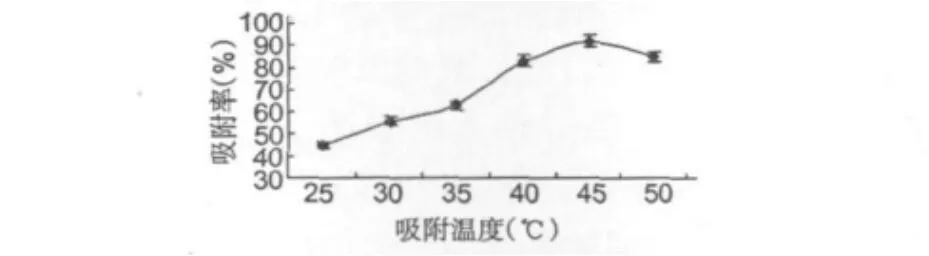
图2 温度对树脂吸附效果的影响Fig.2 Effects of temperature on the absorption rate of S5428 resin
2.3.2 时间对S5428树脂吸附效果的影响
图3是S5428树脂静态吸附试验得到的时间-吸附率变化曲线图。从图3中可以看出,随着时间的增长,树脂的吸附率也在增加,当吸附时间达到2 h后吸附率基本保持不变,说明S5428树脂对肝素的吸附量已达到饱和,故吸附时间为2 h即可。
2.3.3 pH对S5428树脂吸附效果的影响
图4是S5428树脂静态吸附试验得到的pH-吸附率变化曲线图。从图4中可以看出,不同pH的肝素溶液对吸附效果有较大的影响。S5428树脂对肝素的吸附率随着pH的增加,呈缓慢的先增加后降低的趋势,在pH 8.0时吸附效果最好,吸附率达90.4%。这是因为S5428树脂为强碱性阴离子交换树脂,在碱性条件下更有利于其吸附肝素,故选择pH 8.0较为适宜。

图4 pH对树脂吸附效果的影响Fig.4 Effects of pH on the absorption rate of S5428 resin
2.4 树脂动态吸附试验结果
2.4.1 进样速度对S5428树脂吸附效果的影响
图5是S5428树脂动态吸附试验得到的流速-吸附率变化曲线图。从图5中可以看出,肝素溶液以一定流速流经层析柱,在流速较小的情况下比在流速较大的情况下吸附效果较好。当以0.5 mL/ min的流速进行吸附时效果最好,因为在流速较小的情况下肝素溶液可以和树脂进行充分的接触,并且能够进入树脂孔道的内部进行吸附,但是流速太慢会延长操作时间,使整体效率下降;当进样速度超过1.5 mL/min时,因为流速太快,溶质分子来不及扩散到树脂内表面,会发生漏过,肝素溶液和树脂表面层接触的时间较短,并且有部分肝素溶液未进入树脂孔道内部进行吸附而直接流出,所以产生肝素溶液吸附效果较差。因此,应采用1.5 mL/min的流速进行吸附,吸附率达到了90.2%,既保证了吸附的效果,也减少了吸附的时间。
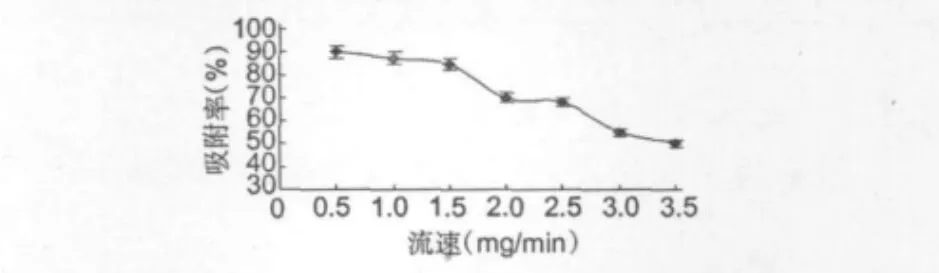
图5 样速度对树脂吸附效果的影响Fig.5 Effects of flow rate on the absorption rates of S5428 resin
2.4.2 进样浓度对S5428树脂吸附效果的影响
图6是S5428树脂动态吸附试验得到的上样浓度-吸附率变化曲线图。从图6中可以看出,当不同浓度肝素溶液进样时,树脂对肝素的吸附效果不同。结果表明,当肝素样品液的浓度为1.0 mg/mL时,S5428树脂对肝素的饱和吸附量最大。当肝素样品液的浓度为1.2 mg/mL和1.4 mg/mL时,S5428树脂对肝素的饱和吸附量与样品浓度为1.0 mg/mL时相差很小。为了节省原料,减少肝素浓缩造成的延长操作时间,是整体效率下降,本实验确定最佳上样浓度为1.0 mg/mL。

图6 进样浓度对树脂吸附效果的影响Fig.6 Effects of feed concention on the absorption rate of S5428 resin
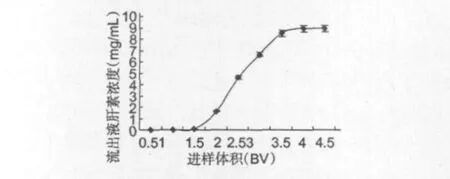
图7 S5428树脂吸附渗漏曲线Fig.7 Leakage curve of S5428 resin
2.4.3 S5428树脂吸附渗漏曲线
图7是S5428树脂吸附的动力学曲线。从图7可知,在最适动态吸附条件下,S5428树脂能吸附1.5倍柱床体积(BV),浓度为1.0 mg/mL的肝素溶液而不发生泄露,吸附量可达3.05 mg/mL,达到饱和吸附可处理4 BV的肝素溶液,动态饱和吸附量为9.18 mg/mL。
2.5 S5428树脂动态解吸条件的确定
2.5.1 洗脱液浓度的确定
表2是不同解吸剂对S5428树脂解吸性能的比较。用水做解吸剂,不能解吸肝素;用0.5 M NaCl和l M NaCl作为解吸剂时,能解吸下来树脂表面吸附的一些蛋白质杂质,但是对肝素的解吸率非常低,因为0.5 M和l M NaCl的离子强度比较弱,能与树脂表面吸附的硫酸软骨素,类肝素,透明质酸等其他杂多糖类物质发生离子交换,能将这些类肝素物质解吸下来,但是只能解吸极少量的肝素;用2 M NaCl的解吸下来的主要的成分为肝素,解吸率为95.8%,并且肝素的效价达到150 U/mg;而3 M NaCl和4 M NaCl的洗脱率与2 M NaCl的洗脱率接近,并且解吸下来的成分与2 M NaCl基本一致,为了降低洗脱液中的含盐量,节约成本,得到最大的解吸率,应选取2 M NaCl作为解吸剂。洗脱剂的pH对洗脱效果也有影响,通过检测在不同pH条件下2 M NaCl解吸肝素的解吸率,确定pH 8.0时解吸率最高,解吸效果最好,因此选择解吸溶液为2 M NaCl,pH 8.0。

表2 不同解吸剂对S5428树脂解吸性能的比较Table 2 Desorption performances of different eluants for S5428 resin
2.5.2 洗脱流速的确定
图8为洗脱速度对肝素解吸效果的影响曲线。
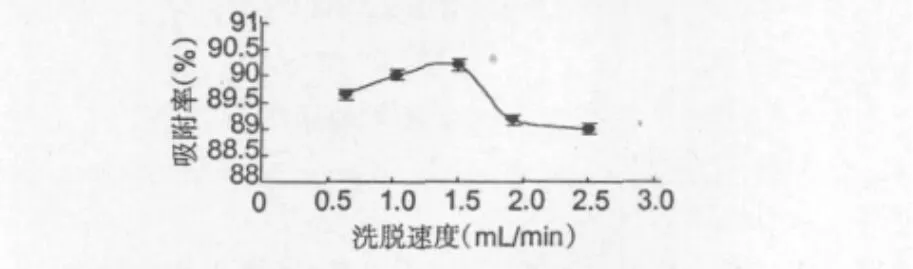
图8 洗脱速度对解吸效果的影响Fig.8 Effects of elution speed on the desorption rate
结果表明,当洗脱流速为0.5~1.5 mL/min时,解吸率逐渐增加;当洗脱速度为2.0~2.5 mL/min时,解吸率明显降低。分析原因,是因为用较高的流速洗脱时,洗脱液还没跟树脂充分接触就流过层析住,使得解吸下来的肝素的减少。综合考虑各因素的影响,本实验确定最佳洗脱流速为1.5 mL/min。
2.6 验证试验
将筛选出的已预处理好S5428树脂90 mL湿法装柱于带有夹套恒温水浴的层析柱内(1.6 cm×100 cm),夹层温度设定为45℃。用去离子水平衡树脂,平衡后将浓度为1 mg/mL的肝素溶液用恒流泵以1.5 mL/min的流速泵入层析柱进行动态吸附后,依次用300 mL蒸馏水和300 mL浓度为2 mol/L的NaCl溶液以1.5 mL/min的流速进行洗脱,分别收集吸附后液体和洗脱液,并根据“1.3.2”的公式计算吸附率和解吸率,并根据相对标准偏差,考察重现性,结果如表3所示。
实验结果表明,S5428型树脂纯化肝素工艺的效果良好,并且测定结果均无显著性差异。
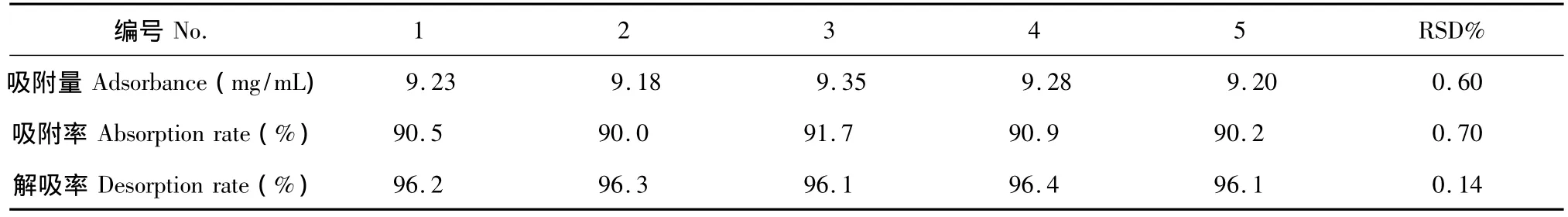
表3 树脂验证试验Table 3 Results of verification test
3 结论
通过静态吸附、动态吸附和动态解吸试验,选出S5428树脂对肝素溶液具有最好的吸附能力和解吸效果,S5428树脂层析柱的最适动态吸附条件是:吸附温度45℃,肝素溶液进样浓度1.0 mg/mL,进样速度1.5 mL/min,处理1.5 BV的肝素液而不发生泄露,吸附量可达3.05 mg/mL,达到饱和吸附时可处理4倍柱体积(BV)的料液,吸附量为9.18 mg/ mL;用2.0 mol/L NaCl为解吸剂,洗脱流速1.5 mL/ min,pH 8.0,洗脱温度45℃。在此条件下,肝素解吸率可达95.8%,肝素效价为150 U/mg,效价回收率为98%。使用S5428树脂可以很好地纯化肝素,其对肝素的吸附率和解吸率高于国内常用的其他大孔径阴离子树脂,具有很好的应用前景。
1 Liu H(刘晗),Bai XF(白雪芳),Du YG(杜昱光),et al.Biological activity of oligosaccharides.J Fine Special Chem (精细与专用化学品),2005,7(13),15-18.
2 Sun Y(孙岩).Discussion of heparin refining process.J Chin Biochem Pharm(中国生化药物杂志),1998,19:41-42.
3 Wang QY(王庆元).Study on heparin technology.J Chin Pharm(中国医药工业杂志),1991,22:201-202.
4 Cheng SB(程松宝).A heparin purification technology.J Chin Pharm(中国医药工业杂志),1993,24:245-246.
5 Luo XN(罗喜牛).Aluminum chloride refining heparin process.J Chin Pharm(中国医药工业杂志),1998,299: 441-442.
6 Xue RZ(薛荣珍),Wang RJ(王仁杰),Yang CM(杨长明).Discussion of attapulgite and activated carbon applied in remove impurities during the preparation of heparin sodium.J Hebei Med(河北医药),1997,19:171-172.
7 Green JP.Fractionation of heparin on an anion exchange.Nature,1960,186:472.
8 karlsson E,Ryden L,Brewer J.Ion Exchange Chromatography.NY,1998.145-206.
9 Louis R.Comparison of the separation of Bovine heparin by strong anion exchange and by gel filtration chromatography.Thromb Res,1991,64:203-211.
10 Fang JN(方积年).Polysaccharides separation,purification,purity Identification and molecular weight determination.J Chin Pharm(药学通报),1998,19(10):46-49.
11 Guo H(过红).Application of chromatography on heparin purification.J Chin Biochem Pharm(中国生化药物杂志),1998,19:104-105.
12 Zhu ZH(朱祖恒),Feng SS(丰树山).Study ion exchange purification heparin.J Jiangsu Chem Ind(江苏化工),1998,26:18-21.
13 Ji ZH(季钟煌),Jiang CK(蒋传葵).A simple chemical determination of heparin.Acta Biochim Biophys Sin(生物化学与生物物理进展),1980,5:61-63.
14 Wu JG(吴瑾光).Modern Fourier Transform Infrared Spectroscopy and Its Application.Beijing:Scientific and Technological Literature Publishing House(科学技术文献出版社),1994.108-113.
Selection and Application of Ion Exchange Resin for Heparin Purification Process
SONG Da-wei1,LI Liang-yu1,ZHANG Li-ping1,2*1Agricultural Food Processing and Engineering Technology Research Center of Heilongjiang Province;2College of Food Science,Heilongjiang Bayi Agricultural University,Daqing 163319,China
Five kinds of resins were compared for the heparin adsorption capability,and S5428 ion exchange resin was chosen as the best.On the basis of single factor test,the optimum conditions of static and dynamic adsorption heparin were determined.The results showed that the rate of heparin adsorption was 90.5%under the temperature of 45℃,pH 8.0,and 2 h adsorption in the static adsorption experiment.The dynamic adsorption conditions of ion exchange chromatography(IEC)were determined as follows:the temperature of 45℃,the concentration of heparin solution 1 mg/mL,feed rate 1.5 mL/min,1.5 BV of heparin solution through the resin column without leaking,the adsorption capacity of 3.05 mg/mL,4 BV of saturated adsorption,and the adsorption capacity of 9.18 mg/mL.And 2.0 mol/L NaCl was applied as elution with flow rate 1.5 mL/min.Under these conditions,the rate of heparin desorption was 95.8%,the potency of purified heparin was 150 U/mg,and the potency recovery was 98%.
heparin;ion exchange resin;adsorption;column chromatography
1001-6880(2011)05-0956-06
2010-03-22 接受日期:2010-07-01
黑龙江省“十一五”重点项目(GB06B403-3)
*通讯作者 Tel:86-459-6819230;E-mail:zlp57@yahoo.com.cn
Q946.91;R284.1;TS202.3
A

