茶多酚对稻瘟病菌的抑制作用及抑菌机理
汪金莲,邱业先,扶教龙,韩 俊,冯 稳
苏州科技学院化生学院,苏州215009
茶多酚对稻瘟病菌的抑制作用及抑菌机理
汪金莲,邱业先*,扶教龙,韩 俊,冯 稳
苏州科技学院化生学院,苏州215009
用不同浓度茶多酚对稻瘟病菌进行抑菌和抑菌机理研究。结果表明,不同浓度的茶多酚对稻瘟病菌菌丝生长和分生孢子萌发具有很强的抑制作用。随着茶多酚浓度的增加,其抑制作用增强,其中5.00 mg/mL和10.00 mg/mL抑制效果最好,其抑制率高达100%,且分生孢子畸形,细胞破裂,原生质外溢。其作用机理主要是破坏菌体的细胞膜结构,抑制CAT、POD酶活,使其丧失细胞膜的屏障和酶系的保护功能,最终导致菌体生长受到抑制或死亡。
茶多酚;稻瘟菌;抑制作用;抑菌机理
稻瘟病是全世界稻区危害最严重的水稻病害,也是我国水稻三大病害之一,病害流行地区,一般减产10%~20%,重的可达40%~50%,特别严重的田块造成绝收[1]。目前,水稻抗瘟性品种的利用和化学农药的使用仍是防治稻瘟病行之有效的措施,但因抗瘟品种的单一化、稻瘟病菌生理小种遗传的复杂性和致病性的多样性以及化学农药的毒性和病原菌的抗药性,水稻抗瘟性品种和化学农药使用在生产上都受到一定的限制[2]。为此,稻瘟病生物农药的研究与开发是水稻生产中亟待解决的问题。而植物源农药最能体现生物防治的特点,它不仅不会造成环境污染,不易使病菌产生抗药性,为人们提供更安全更高效的生防途径,而且植物源农药还具有种植广泛,取材容易,成本较低等特点,近年来日益受到人们的重视。茶多酚(tea-polyphenols)是茶叶中提取的酚类化合物,属植物源农药,具有以上特点。目前国内外对于茶多酚的研究主要以茶多酚的药理、病理、毒理学以及茶多酚的保颜、保鲜、及除臭作用为主[3],经查阅大量文献证明,茶多酚对病原细菌尤其对医学和食品致病细菌研究较多,证明茶多酚对病原细菌有较强的抑制作用[3-6],而茶多酚对植物病原真菌抑制作用尤其是不同浓度的茶多酚对植物病原真菌抑制作用及机理的研究报道甚少。我们在植物脲酶抑制剂的筛选工作中,发现茶多酚具有较强的抑制土壤脲酶和土壤真菌的作用[7-9]。本研究旨用不同浓度茶多酚对植物病原真菌稻瘟病菌进行抑菌和抑菌机理实验,其目的是探究茶多酚对植物病原真菌稻瘟菌抑制作用及作用机理,以期筛选出最佳抑菌浓度和揭示其作用机理,为稻瘟病的生物防治和新型的植物源农药在农业方面开发应用提供理论依据。
1 材料与方法
1.1 材料
茶多酚(Tea-polyphenols TP)为市售金龙公司产品,含量为50%。EDTA、PVPP、PBS、KH2PO4、愈创木酚、H2O2等。
1.1.2 供试菌种和培养基
稻瘟病菌(Pyricularia oryzae Cav),由江苏农科院提供。用时在PSA平板上预培养6 d。培养基为PSA固体培养基和PS液体培养基[10]
1.2 方法
1.2.1 不同浓度茶多酚对稻瘟病菌菌丝生长的抑制作用
抑制菌丝生长速率法[11]:用无菌水配成100.00、50.00、33.30、25.00、20.00 mg/mL茶多酚母液。设茶多酚平板浓度为10.00、5.00、3.33、2.5、2.00 mg/mL共5种浓度梯度,无菌水为对照(CK),共6个处理。在灭菌培养皿中分别加入5种对应浓度的茶多酚母液1 mL,对照(CK)加等量无菌水,将冷却至45℃左右的PSA培养基9 mL倒入各培养皿中,立即轻轻摇匀后,待凝固成平板,即为设定的10.00、5.00、3.33、2.50、2.00 mg/mL浓度。用打孔器打取稻瘟病菌菌落边缘生长旺盛的菌圆片(φ9 mm),各挑取一块移入对应平板中间,每处理3个重复。置25℃恒温箱中培养7 d,观察、测量各处理的菌落直径并摄影,计算菌落平均直径和平均抑菌率。并用邓肯法进行差异显著性检验[12]。
1.2.2 不同浓度茶多酚对稻瘟病菌分生孢子萌发抑制的形态变化
方:除了您对图书馆学硕士学位点建设作出了积极贡献以外,您对学生也是真情付出、关爱有加。为此,学生们都心存感激,在他们心中,您是一名非常值得敬重的研究生导师。能谈谈您在指导研究生方面的心得体会吗?
悬滴法[11]:设茶多酚浓度为10.00、5.00、3.33、2.00 mg/mL共4种浓度梯度,无菌水为对照(CK),共5个处理。将稻瘟病菌培养至产生孢子后,分别配成以上不同浓度的茶多酚孢子悬浮液,对照(CK)用无菌水配制,每视野15~20个孢子,每处理3个重复,置25℃恒温箱内悬滴培养12 h,显微观察各处理的孢子萌发形态变化并显微摄影。
1.2.3 不同浓度茶多酚对稻瘟病菌膜透性的影响
电导法[11,13]:用灭好菌的打孔器在生长旺盛的菌落边缘以同心圆方式打菌圆片(φ9 mm),各取1片菌圆片放入10.00、5.00、3.33、2.50、2.00 mg/mL的不同浓度茶多酚PS液体培养基(50 mL锥形瓶装20 mL培养基)中,25℃ 130 r/min恒温摇床培养,以培养基(PS)内不加茶多酚为对照,每天取各处理发酵培养液10 mL直接读取电导率值,每处理重复3次。计算各处理2 d之间电导率的变化值并绘制曲线。
1.2.4 不同浓度茶多酚对稻瘟病菌CAT、POD酶的影响[11]
在250 mL锥形瓶内加入80 mL液体培养基PS和8.89 mL不同浓度的茶多酚母液,配成浓度为10.00、5.00、3.33、2.50、2.00 mg/mL的茶多酚PS液体培养基。对照CK(80 mL液体培养基加8.89 mL无菌水)。用灭好菌的打孔器在生长旺盛的菌落边缘以同心圆方式打菌圆片(φ9 mm),取1片菌圆片放入不同处理的PS液体培养基内,25℃130 r/min恒摇床培养7 d。每处理3个重复。
1.2.4.1 过氧化氢酶(CAT)酶活测定
紫外吸收法[11,14]:设茶多酚为 10.00、5.00、3.33、2.50、2.00 mg/mL共5个浓度梯度。每浓度各取2 mL培养液加6 mL样品提取液冰镇研磨成匀浆,3000 r/min离心20 min后取4 mL上清液,加1 mL反应液稀释10倍于常温25℃反应10 min后马上于240 nm处测紫外吸光值。对照(CK)中加入1 mL反应液、4 mL 150 mmol/L PBS(pH7.5)。每处理3个重复。设每min减少0.001 A240为一个CAT活力单位(U)。
1.2.4.2 过氧化物酶(POD)酶活测定
可见光吸收法[11,14]:设茶多酚为10.00、5.00、3.33、2.50、2.00 mg/mL共5个浓度梯度。每浓度各取2 mL培养液加4 mL样品提取液冰镇研磨成匀浆,4000 r/min离心15 min后取1 mL上清液,加3 mL反应液于常温25℃反应5 min后马上于470 nm处测可见吸光值。对照(CK)中加入3 mL反应液、1 mL 100 mmol/L PBS(pH 6.0)。每处理3个重复。设每min减少0.002 A470为一个 POD活力单位(U)。
2 结果与分析
2.1 不同浓度茶多酚对稻瘟病菌菌丝生长的抑制作用
表1图1结果显示,5种浓度的茶多酚对稻瘟病菌都有很强的抑制作用,与对照比较差异均达极显著水平(P<0.01)。且随着浓度增加,抑制作用增强。尤其10.00 mg/mL和5.00 mg/mL的抑制效果最好,其抑制率高达100%(两者差异不显著)。即使最低浓度为2.00 mg/mL其抑制率也达68.45%,由此可见,茶多酚对稻瘟病菌的抑制效果在本设置最低浓度为2.00 mg/mL时已经非常明显。

表1 不同浓度茶多酚对稻瘟病菌菌丝生长的抑制作用Table 1 Inhibition of tea-polyphenol of different concentration on the growth of P.oryzae
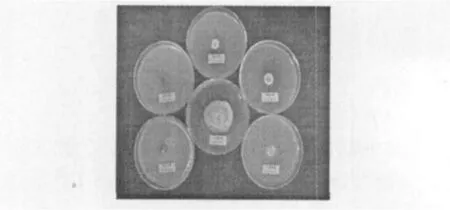
图1 不同浓度茶多酚对稻瘟病菌菌丝生长的抑制Fig.1 Inhibition of TP of different concentration on the mycelia growthof P.oryzae
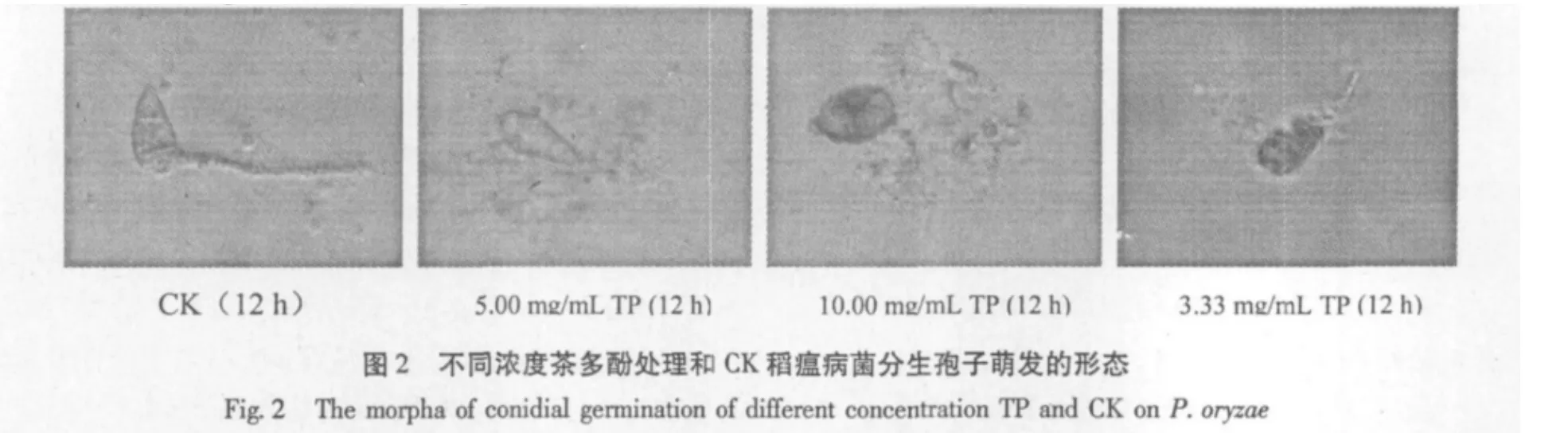
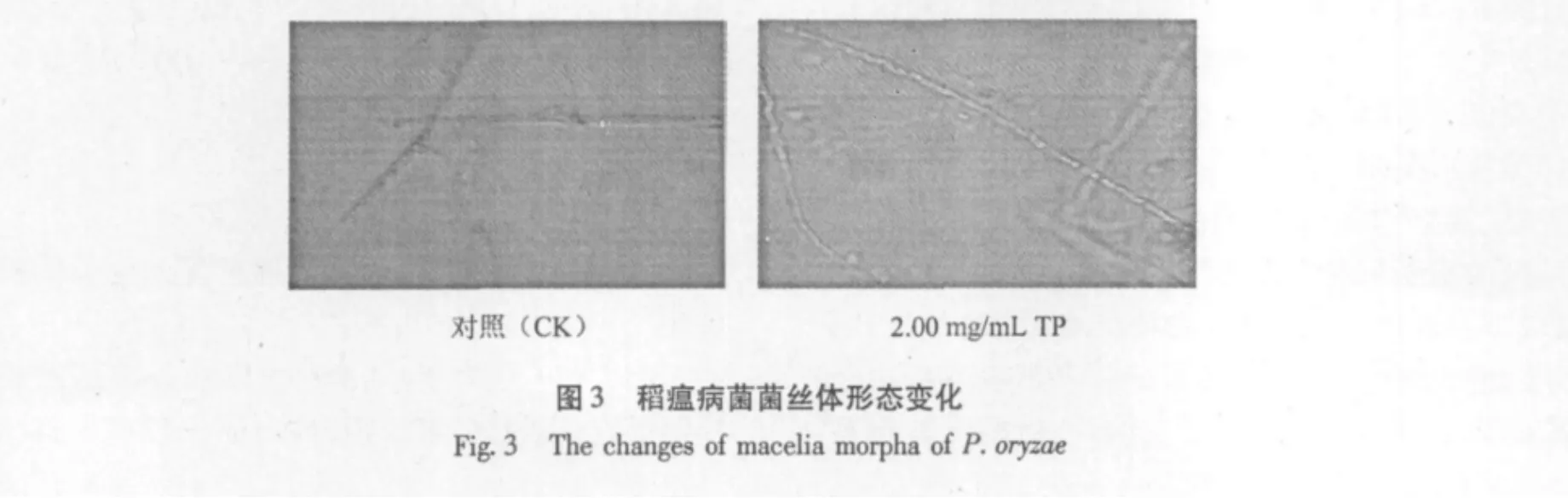
从图2可以看出,几种浓度茶多酚对稻瘟病菌分生孢子萌发都具有强烈的抑制作用,其分生孢子周围和顶端聚集大量颗粒状物质即原生质均大量外溢,尤其5.00 mg/mL和10.00 mg/mL处理的分生孢子不仅不能萌发产生芽管,而且孢子严重畸形、破裂,崩溃;由此可见,茶多酚对稻瘟菌不仅有很强的抑菌作用,而且有强烈的杀菌作用。3.33 mg/mL和2.00 mg/mL茶多酚处理的孢子虽然能产生芽管,但是芽管又短又细,伸长受到严重抑制。而CK的分生孢子萌发产生的芽管长而粗壮,孢子形态正常,雅梨形且二个隔膜清晰可见。另外菌丝萌发结果显示,经茶多酚处理的菌丝,尽管是低浓度为2.00 mg/mL时,菌丝仍畸形(见图3)。由此可以得出,茶多酚抑制孢子的萌发主要体现两方面作用,低浓度主要抑制孢子芽管的伸长与萌发,表现为抑菌作用;而高浓度主要为细胞崩溃死亡,表现为杀菌作用。
2.2 不同浓度的茶多酚对稻瘟病菌细胞膜透性的影响
图4结果显示,不同浓度茶多酚处理的稻瘟病菌丝电导率值均急剧变化,其变化大小趋势与浓度成正比,即浓度越大,电导率值变化越大。尤其在第2 d与第5 d之间变化最大;而CK电导率值一直较平稳,没有明显的变化,基本在0值上下波动。电导率值的改变可以间接反映细胞膜透性的改变,说明经茶多酚处理后稻瘟病菌丝膜系统通透性发生了变化,因细胞膜的主要成分是脂质双分子层,其中含有亲水端和疏水端,茶多酚可直接进入脂质双分子层,以多酚羟基和脂质的亲水端结合,使脂质凝集,从而破坏细胞膜的脂质双分子结构,使膜系统通透性骤然加大,有的甚至完全破裂,菌体内大量细胞质外溢,最终导致菌体细胞死亡,从而引起电导率值急剧变化。而CK没有茶多酚的作用,其膜透性几乎没有改变,当然也没有细胞质的渗漏。图2和图3分生孢子和菌丝的细胞质外溢现象也充分证明了这一点。可见,茶多酚对细胞膜的影响是抑制或杀灭真菌的重要机理。
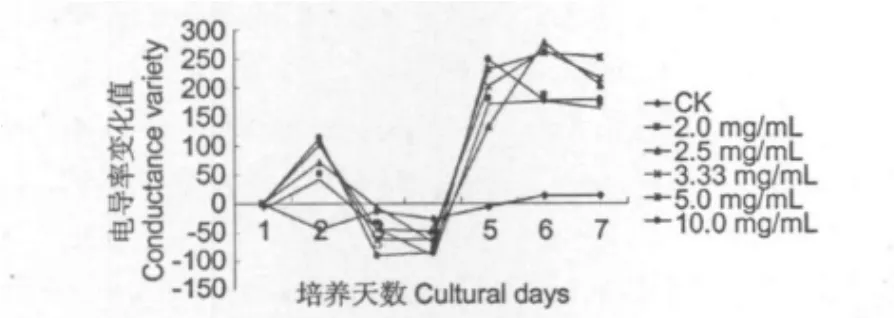
图4 不同浓度茶多酚对稻瘟病菌菌丝细胞膜透性的影响Fig.4 Effect of different concentration TP on membrane permeability of P.oryzae
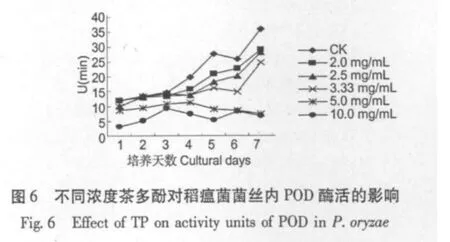
2.3 不同浓度茶多酚对稻瘟病菌丝细胞内CAT、POD酶活性的影响
图5和图6结果显示,茶多酚对稻瘟病菌CAT、POD酶活性有明显抑制作用,随着茶多酚浓度增加,酶活性递减。尤其10.00 mg/mL和5.0 mg/mL CAT和POD酶活在7 d内始终为最低;而CK酶活在7 d内均为最高。CAT、POD酶存在于需氧生物内,属于细胞保护酶系统,可以清除活性氧自由基,对于抵御多种理化因子胁迫、减少活性氧积累、维护膜结构的完整都起到重要作用。CAT、POD酶活受到抑制,使菌丝膜系统、菌体蛋白质更易受到内外环境影响,从而影响微生物的代谢。
3 讨论
国内外许多研究证明,茶多酚对许多病原细菌具有很强的抑制作用,Kodamo和Yeo的研究结果分别证实了茶多酚对植物病原细菌和食物病原细菌均有较好的抑制效果[15,16];陶荣达指出:按Bergey细菌分类系统,对于自然界中19类群的近百种细菌均有优异的抗菌活性,显示出茶多酚抗菌的广谱性的强抑制力[17];王岳飞研究发现TP具有抗菌广谱性并具强的抑制能力,它对自然界中几乎所有动植物病原细菌都有抑制能力[3];董金莆研究表明茶多酚对细菌有广泛的抑制作用[18]。综上所述,茶多酚对病原细菌抑制作用已完全得到证实,但对病原真菌尤其植物病原真菌研究甚少。因此,为了使茶多酚能尽快在农业方面得到开发应用,建立茶多酚对植物病原真菌的抗菌谱是非常必要的。
本研究结果表明,不同浓度的茶多酚对稻瘟病菌均具有显著的抑制效果(P<0.01),且随茶多酚浓度增加抑制作用增强,可见,茶多酚对植物病原真菌的抑菌能力与浓度呈正相关,这点和王岳飞研究的茶多酚对细菌的抑菌能力与其浓度呈正效应一致[4]。另外,茶多酚对稻瘟菌菌丝和分生孢子萌发实验均已证明,5.00 mg/mL和10.00 mg/mL为最佳的抑菌浓度,其抑制率均高达100%,且分生孢子不能萌发,孢子畸形,细胞破裂崩溃,原生质外溢,说明茶多酚对稻瘟菌不仅有很强的抑菌作用,而且有强烈的杀菌作用。茶叶在我国种植广泛,具有丰富的资源,茶多酚的提取工艺简单,生产成本低,不污染环境,作为一种新型植物源农药在植物病原真菌方面开发应用将具有广阔的前景。
1Xu YG(徐雍高),Xu JY(徐敬友),Chen LF(陈利锋),et al.Agricultural Plant Pathology(农业植物病理学).Nanjing:Jiangsu:Scientific&Technical Publisher,1996.80.
2 Wang QL(王巧兰),Guo G(郭刚).Advances in the research of biological control against Blast Fungus.Henan Agric Sci(河南农业科学),2005,10:10-13.
3Yang XQ(杨贤强),Wang YF(王岳飞),Chen LJ(陈留记),et al.Chemistry of Tea-Polyphenol,1st Edition(茶多酚化学,第一版).Shanghai:Shanghai Scientific&Technical Publisher,2003.320.
4 Wang YF(王岳飞).The efffects of tea-polyphenol against bacterial.J Tea(茶叶),1994,20:37-41.
5Su MJ(宿迷菊),Wang YF(王岳飞),Luo YP(骆耀平),et al.Research progress in anti-inflammatory effects of tea polyphenols.J Tea(茶叶),2006,32:10-13.
6 Tang YF(唐裕芳),Zhang ML(张妙玲),Feng B(冯波),et al.Anti-microbial activities of tea-polypheno.J Zhejiang Forest Coll(浙江林学院学报),2005,22:553-554.
7Qiu YX(邱业先),Wang JL(汪金莲),Chen SM(陈尚钘),et al.A study on soil ureaseinhibition by tea-polyphenol.Chin Sci Abst(中国学术期刊文摘,科技快报),2000,6: 1286-1288.
8Qiu YX(邱业先),Wang JL(汪金莲),Lu XY(卢向阳),et al.Effect of tea-polyphenol on growth of urease-generating microbs and urease secretion.Plant Nutr Fertil Sci(植物营养与肥料学报),2002,8:119-121.
9 Qiu YX(邱业先),Wang F(王飞),Wang JL(汪金莲),et al.The effects of tea polyphenol on the growth and membrane permeability of Trichoderma sp.Chin J Soil Sci(土壤通报),2005,36:140-142.
10 Fang ZD(方中达).Research Method of Plant Pathology,3rd Edition(植病研究方法,第三版).Beijing:China Agriculture Press,1998.152.
11 Wang JL(汪金莲),Qiu YX(邱业先),Chen HW(陈宏伟),et al.Inhibitive action of tea-polyphenol on some plant pathogenic fungi.Nat Prod Res Dev(天然产物研究与开发),2008,20:690-269.
12 Du RQ(杜荣骞).Biostatistics(生物统计学).Beijing: Higher Education Publishing House,2003.106-110.
13 Zhang ZL(张志良),Qu WJ(瞿伟菁).Experimental Direction for Plant Pathology,3rd Edition(植物生理学实验指导,第三版).Beijing:Higher Education Publishing House,2004.
14 Zhang YG(张云贵),Qin GQ(覃广泉),Liu XY(刘祥云),et al.Experimental Direction for Biochemistry(生物化学实验指导).Tianjin:Tianjin University Press,1993.76-78.
15 Kodama K,Sagesaka Y,Goto M.Anti-microbial activity of catechins against plant pathogenic bacteria and fungi.Ann Phytopath Soc Japan,1991,57:306-311.
16 Yeo SG,Ahn CW,Kim IS,et al.Antioxidative effect of tea extracts from green tea,Oolong tea and black tea.J Korean Soc Food Nutri,1995,24:299-304.
17 Tao RD(陶荣达).Advances in the preparation and application of tea-polyphenol.J Chem World(化学世界),1997,3: 64-67.
18 Dong JP(董金莆),Li YQ(李瑶卿).Research of the effects of tea-polyphenol against microbial.J Bio(生物学杂志),1992,4:19-21.
Inhibitive Effect of Tea-polyphenols on Pyricularia oryzae and Its Mechanism
WANG Jin-lian,QIU Ye-xian*,FU Jiao-long,HAN Jun,FENG Wen
College of chemical and biology of university of science and technology of Suzhou,Suzhou 215009,China
The inhibitive effect of tea-polyphenols(TP)on Pyricularia oryzae at different concentrations and the inhibitive mechanism were studied.The results showed that TP had strong inhibition on hytha growth and conidia germination.With the increasing of TP concentration,the inhibition was increased.The inhibitive efficiency at the concentrations of 5.00 mg/mL and 10.00 mg/mL was the highest,and the inhibitive ratio achieved 100%.The conidia distorted,the cell burst,and the protoplasm overflowed in this condition.The action mechanism of TP was:TP destroyed the structure of cell membrane,strongly inhibited the enzyme activity of CAT,POD,made the cell lose the protection of cell membrane barrier and enzyme system,and finally lead the growth of fungi to be inhibited or die.
tea-polyphenols;Pyricularia oryzae;inhibition;inhibitory mechanism
1001-6880(2011)05-0918-05
2009-12-25 接受日期:2010-07-06
国家自然科学基金([2003]30260050)
*通讯作者 E-mail:qyx542@126.com
R285;Q946.91;S432.4
A

