TLC测定白芍配伍前后芍药苷的含量变化研究
王 瑞,展晓日,杜晓清,曾昭武
(1.山西中医学院中药系,山西 太原 030024;2.杭州师范大学生物医药与健康中心,浙江 杭州 310012)
TLC测定白芍配伍前后芍药苷的含量变化研究
王 瑞1,展晓日2*,杜晓清1,曾昭武2
(1.山西中医学院中药系,山西 太原 030024;2.杭州师范大学生物医药与健康中心,浙江 杭州 310012)
采用薄层扫描法测定白芍配伍前后芍药苷的含量,展开剂为三氯甲烷∶乙酸乙酯∶甲醇∶氨试液(8∶1∶4∶1),检测波长575 nm,参比波长700 nm.比较白芍单煎液和小建中汤复方煎液中芍药苷的含量变化,探讨小建中汤配伍的合理性.结果发现,该方法的精密度、稳定性和准确度良好,芍药苷在1.93~19.3 μg范围内线性良好,白芍单煎液和复方煎液的方法回收率分别为98.3%和95.9%,单煎液中芍药苷的含量明显低于复方煎液(P<0.01).表明白芍在小建中汤中配伍可以增加有效成分芍药苷的煎出量.
小建中汤;配伍;芍药苷;含量测定;薄层扫描法
小建中汤首见于《伤寒论》,由饴糖、白芍、大枣、桂枝、甘草(蜜炙)、生姜6味中药组成,具有温中补虚、和里缓急之功效[1-2].用于治疗中焦虚寒,气血不足之症兼伤寒表征,以及治脾虚腹痛兼少阳邪郁者.方中重用甘温质润之饴糖为君,温补中焦,缓急止痛.臣以辛温之桂枝温阳气,驱寒邪;酸甘之白芍养营阴,缓肝急,止腹痛.佐以生姜温胃散寒,大枣补脾益气.六药合用,温中补虚缓急之中,蕴有柔肝理脾,益阴和阳之意,用之可使中气强健,阴阳气血生化有缘,故以“建中”名之[3].该研究将中成药白芍的主要有效成分芍药苷作为含量测定的指标成分,通过薄层扫描法测定配伍前后白芍药材以及小建中汤中芍药苷的含量变化,探讨小建中汤配伍的合理性.
1 仪器与试药
SCANNER-3型薄层扫描仪(瑞士 CAMAG公司),METTLER(梅特勒)-AB135-S十万分之一电子分析天平,FA/JA1004型万分之一电子天平;芍药苷对照品(批号:0715-200211.含量测定用,纯度>98%,中国药品生物制品检定所).白芍、桂枝、甘草(蜜炙)均购自同仁堂药店,经山西中医学院裴香萍副教授鉴定,符合《中国药典》2010年版规定.大枣,生姜,饴糖均为市售.
乙醚,正丁醇,石油醚(60~90 ℃),乙酸乙酯,三氯甲烷,甲醇,浓氨试液,甲酸,冰醋酸等均为分析纯.
2 方法和结果
2.1 薄层色谱条件
SCANNER-3型薄层扫描仪,在λS=575 nm,λR=700 nm下扫描.
2.2 溶液制备
2.2.1 对照品溶液的制备 精密称取芍药苷对照品适量,用甲醇溶解制成每毫升含有芍药苷1.93 mg的对照品溶液.
2.2.2 小建中汤样品溶液的制备 称量生姜4.5 g,桂枝4.5 g,炙甘草3.0 g,大枣4.5 g(约2枚,去核),白芍9.0 g于500 mL的烧杯里,向其中加10倍量水(255 mL),浸泡30 min,第一次煎煮30 min,纱布过滤,滤渣和纱布一起用8倍量水204 mL再次煎煮20 min,和前一次滤液一起减压抽滤得滤液,加入饴糖15 g烊化,浓缩至50 mL左右,离心,离心液定容至100 mL.移取20 mL,用乙醚振摇提取3次,每次15 mL,弃去乙醚液,再用水饱和正丁醇振摇提取4次,每次15 mL,合并正丁醇液,用正丁醇饱和的水40 mL洗涤,弃去水液,正丁醇液蒸干,残渣加甲醇1 mL溶解,作为供试液.
2.2.3 白芍药材溶液的制备 称取白芍药材9.0 g于500 mL的烧杯里,向其中加入255 mL水,按照“2.2.2”项方法制备,得白芍样品溶液.
2.2.4 阴性样品溶液的制备 称取“2.2.2”项除白芍外的其他药材,按相同的方法制备,得缺白芍的阴性对照溶液.
3 芍药苷配伍前后含量测定
3.1 方法学考察[4-8,11]
3.1.1 标准曲线制备 取芍药苷对照品1,2,4,6,8,10 μL,照薄层色谱法(附录VIB)试验,分别交叉点于同一于羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以三氯甲烷∶乙酸乙酯∶甲醇∶浓氨试液(8∶1∶4∶1)为展开剂展开、取出、晾干,喷以5% 香草醛硫酸试液,加热至斑点显色清晰[9-10].按照“2.1”项色谱条件扫描,以峰面积Y对进样量X(μg)进行回归处理,得到芍药苷的回归方程为:Y=938.73X+286.36,r=0.997.芍药苷的线性范围为1.93~19.3 μg.
3.1.2 精密度实验 取芍药苷对照品,在同一块薄层板上点6个点,均点样4 μL,照薄层色谱法(附录VIB)[12]试验,以三氯甲烷∶乙酸乙酯∶甲醇∶浓氨试液(8∶1∶4∶1)为展开剂展开、取出、晾干,喷以5%香草醛硫酸试液,加热至斑点显色清晰.按照“2.1”项色谱条件扫描,其峰面积的RSD=1.8%,表明仪器精密度良好.
3.1.3 稳定性实验 按处方精密称取生姜4.5 g,桂枝4.5 g,炙甘草3.0 g,大枣4.5 g(去核),白芍9.0 g,按“2.2.2”项方法制备小建中汤供试品溶液,放置0,3,6,9,12,24 h后,按上述色谱条件进行TLC分析,每次点样4 μL,测定峰面积,计算芍药苷含量.芍药苷含量的RSD=2.8% ,表明芍药苷在24 h内稳定.
3.1.4 重复性实验 按小建中汤处方量(生姜4.5 g,桂枝4.5 g,炙甘草3.0 g,大枣4.5 g(去核),白芍9.0 g)精密称取6份,照“2.2.2”项方法制备,得小建中汤样品溶液1,2,3,4,5,6.称取白芍药材6份,每份9.0 g,精密称定,同法制得白芍样品溶液1,2,3,4,5,6.分别精密吸取上述溶液4 μL,依法测定,测得小建中汤样品溶液中芍药苷含量的RSD=3.1%,白芍供试液中芍药苷含量的RSD=3.6%.
3.1.5 加样回收率实验 取芍药苷对照品20 mg,精密称定,溶于甲醇中,制成浓度为10 mg·mL-1芍药苷对照品溶液.称取白芍药材6份,每份4.5 g,精密称定,均加入上述对照品溶液0.3 mL,按照“2.2.2”项方法制备,作为白芍加样回收率实验供试品溶液.按小建中汤处方量(白芍减半)(生姜4.5 g,桂枝4.5 g,炙甘草3.0 g,大枣4.5 g(去核),白芍4.5g)称取6份,精密称定,均加入上述对照品溶液0.4 mL,按照“2.2.2”项方法制备,作为小建中汤加样回收率实验供试品溶液.
移取上述供试品溶液各4 μL,对照品溶液4 μL,交叉点于同一硅胶G薄层板上,按照“2.1”项色谱条件扫描,测得白芍中芍药苷的平均回收率98.3%,RSD为2.6%,小建中汤中芍药苷的平均回收率为95.9%,RSD为2.3%.
3.1.6 阴性干扰实验 移取白芍药材溶液4 μL,阴性样品溶液4 μL,芍药苷对照品溶液4 μL,交叉点于同一硅胶G薄层板上,按照“3.1.1”项薄层色谱展开剂条件展开、取出、晾干,喷以5%香草醛硫酸试液,加热至斑点显色清晰.白芍药材溶液在与对照品相同的位置显示相同颜色的斑点,阴性样品溶液在与对照品相同的位置没有斑点,不干扰样品的测定.
3.2 芍药苷的含量测定
分别取白芍药材供试液4 μL,小建中汤供试液4 μL,芍药苷的对照品4 μL和6 μL(浓度为1.93 mg·mL-1).照薄层色谱法(附录VIB)试验,分别交叉点于同一羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以三氯甲烷∶乙酸乙酯∶甲醇∶浓氨试液(8∶1∶4∶1)为展开剂展开、取出、晾干,喷以5%香草醛硫酸试液,加热至斑点显色清晰.供试品色谱在与对照品色谱相应的位置上,显相同颜色的斑点.按照“2.1”项色谱条件扫描,结果见表1.
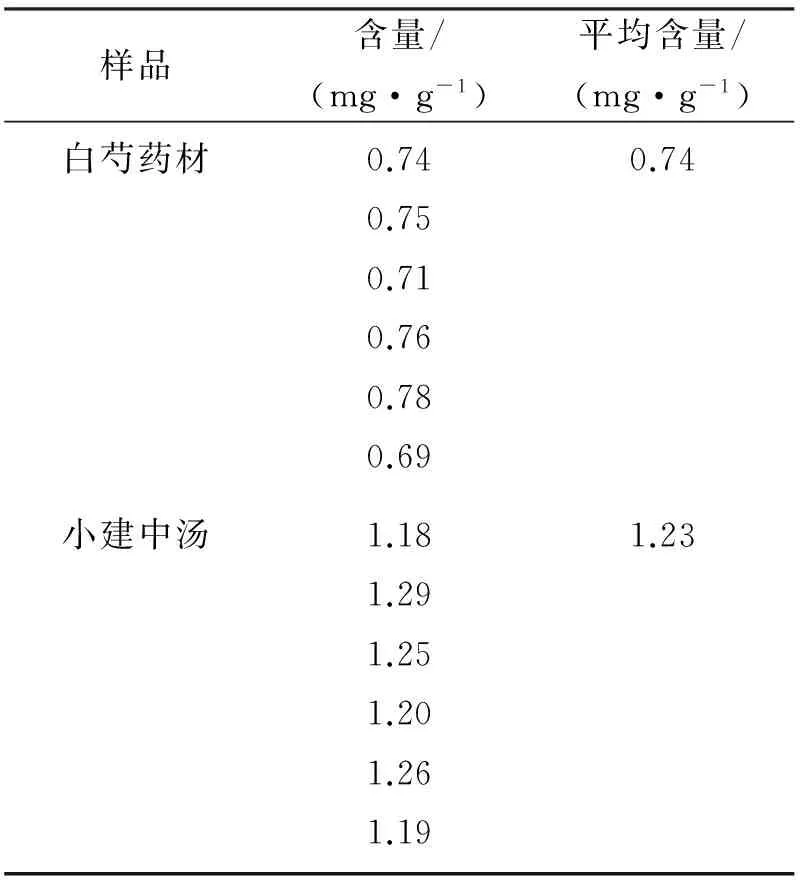
表1 芍药苷的含量测定结果Tab. 1 Determination results of paeoniflorin
表1中含量为折合成药材中芍药苷的含量.由表1可知小建中汤中芍药苷的含量显著大于白芍煎液中芍药苷的含量(n=6,P<0.01),故小建中汤配伍后对白芍中的药效成分芍药苷具有助溶作用,配伍有助于药效成分的溶出.
4 讨论与小结
多味中药依其配伍原则组合在一起,经过制剂后,其化学成分变得非常复杂,蛋白类、多糖类等生物大分子与萜类、黄酮类、苷类等成分同时存在于煎液中,为分离测定带来许多不便.为此,笔者分别采用抽滤、溶剂萃取等方法,对样品液进行预处理,使待测液中杂质相对减少,薄层色谱鉴别显色清晰.
煎煮时间的长短,对其成分的煎出量均有较大的影响,芍药苷在开始时,煎出量较低,随时间延长而增加,煎出量达到峰值,而后随时间延长则下降.该研究考察了煎煮时间,确定为第一煎30 min,第二煎20 min.
芍药苷为笼状烷骨架的单萜,易溶解于极性溶剂,故采用水煎煮提取,水饱和正丁醇萃取,正丁醇饱和水洗去极性较大的杂质,正丁醇萃取溶液蒸干后,用甲醇溶解点样.汤剂中甘草酸有利于芍药苷的溶出,增加了煎液中芍药苷的含量,故小建中汤中芍药苷含量较白芍药材中大一些.
[1] 韩淑华,林晓波.小建中汤的临床应用[J].中国医药导报,2007,4(35):97-98.
[2] 陶玲,柏帅,沈祥春.小建中汤组方配伍效应规律分析[J].时珍国医国药,2009,20(1):92-94.
[3] 吴华阳.小建中汤药物性味配伍与临床运用机理探析[J].中医药学刊,2005,23(5):904-905.
[4] 赵陆军,周毅生.薄层扫描法测定解郁丸中芍药苷的含量[J].中成药,2002,24(12):附2-3.
[5] 吴春艳,刘峰,张雪玲.气管炎丸的薄层色谱鉴别[J].中国实用医药,2009,4(15):163.
[6] 熊建文,聂惠君,张群.小建中颗粒芍药苷的含量测定[J].中药材,2003,26(11):817.
[7] 李守拙,李沈明.薄层扫描法测定正柴胡饮颗粒中芍药苷的含量[J].中草药,2002,33(4):326.
[8] 杨婉花,郝晓静,李娟,等.双白片质量标准研究[J].中国药房,2010,21(27):2549-2551.
[9] 许亚玲,廖波.小建中胶囊质量标准的建立与完善[J].时珍国医国药,2010,21(8):1922-1924.
[10] 姜泓,孟舒,陈再兴.白芍配方颗粒制备工艺和质量标准研究[J].中药材,2008,31(4):605-607.
[11] 廖日房,温预关,陈健玲,等.HPLC-MS-MS测定益智合剂中芍药苷的含量[J].中国医药导报,2008,5(33):11-13.
[12]卫生部药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010:附录34.
DeterminationonContentDifferenceofPaeoniflorinbeforeandafterRadixPaeoniaeAlbaCompatibilitybyTLCS
WANG Rui1, ZHAN Xiao-ri2, DU Xiao-qing1, ZENG Zhao-wu2
(1. Department of Chinese Herb, Shanxi College of Traditional Chinese Medicine, Taiyuan 030024, China; 2. Center of Biomedicine and Health, Hangzhou Normal University, Hangzhou 310012, China)
The experiment determined the content of paeoniflorin before and after Radix Paeoniae Alba compatibility by TLCS with chloroform, ethyl acetate, methanol, ammonia (8∶1∶4∶1) as developing agents, and the detection wavelength was 575 nm, reference wavelength was 700 nm. Comparing the content difference of paeoniflorin in Radix Paeoniae Alba single decoction and Xiaojianzhong compound decoction, the paper discussed the rationality of Xiaojianzhong decoction compatibility. The results show that the precision, stability and accuracy of the method are good, the linearity of paeoniflorin is good in the range of 1.93~19.3 μg, the percent recovery of paeoniflorin in Radix Paeoniae Alba single decoction and Xiaojianzhong compound decoction is 98.3% and 95.9% respectively, the content of paeoniflorin is lower in single decoction than that in compound decoction (n=6,P<0.01), so that it is considered that the content of paeoniflorin can be increased by the compatibility of Radix Paeoniae Alba in Xiaojianzhong decoction.
Xiaojianzhong decoction; compatibility; paeoniflorin; content determination; TLCS
10.3969/j.issn.1674-232X.2011.02.010
2010-11-01
国家自然科学青年基金项目(81001647);浙江省科技厅面上项目(2009C33005);中国博士后科学基金面上项目(20100471757).
王 瑞(1978—),女,河南驻马店人,讲师,博士,主要从事中药质量控制与体内代谢研究.E-mail: wrgreentea@163.com
*通信作者:展晓日(1980—),女,山东莱西人,助理研究员,博士,主要从事中药新药及质量控制研究.E-mail: cortex@163.com
R284.1
A
1674-232X(2011)02-0137-04

