二十碳五烯酸对脂多糖处理的人脐静脉内皮细胞核转录因子κB的表达及细胞因子分泌的影响
包永琴, 马景学, 叶存喜, 董白霞, 翟 英
(河北医科大学第二医院眼科,河北 石家庄 050000)
二十碳五烯酸对脂多糖处理的人脐静脉内皮细胞核转录因子κB的表达及细胞因子分泌的影响
包永琴, 马景学△, 叶存喜, 董白霞, 翟 英
(河北医科大学第二医院眼科,河北 石家庄 050000)
目的探讨二十碳五烯酸(EPA)对脂多糖(LPS)处理的人脐静脉内皮细胞(HUVECs)核转录因子κB(NF-κB)表达以及VEGF、IL-1α和IL-6分泌的影响。方法体外生长良好的传代HUVECs分为对照组、LPS组、0.030 g/L EPA+LPS处理组、0.050 g/L EPA+LPS处理组。LPS组仅加入LPS进行培养,EPA处理组先加入2种浓度的EPA(EPA终浓度分别为0.030 g/L和0.050 g/L)培养1 h,再加入LPS进行培养。LPS刺激6 h、12 h、24 h后,收集各组上清液,ELISA检测上清液中VEGF、IL-1α和IL-6的分泌量;LPS刺激24 h后的沉淀细胞,用Western blotting法检测HUVECs NF-κB p65的蛋白表达。结果与对照组相比,LPS刺激后,HUVECs NF-κB p65表达和VEGF 、IL-1α、IL-6分泌显著升高(P<0.05)。EPA抑制LPS处理的HUVECs NF-κB p65的蛋白表达及VEGF、IL-1α和IL-6分泌,除LPS刺激后6 h, EPA处理组IL-6的分泌量与LPS组比较无显著差异(P>0.05)外,其余均差异显著(P<0.05)。结论LPS使HUVECs NF-κB蛋白表达增加,促进其VEGF及细胞因子表达。EPA抑制LPS处理的HUVECs NF-κB的表达,VEGF和细胞因子的分泌,为EPA应用于各种新生血管性疾病和炎症性疾病的防治提供了理论依据。
二十碳五烯酸; 人脐静脉内皮细胞; NF-κB; 血管内皮生长因子; 细胞因子类
二十碳五烯酸(eicosapentaenoic acid, EPA)是一种n-3多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)。食物中EPA主要来源于鱼油、螺旋藻和微藻类。EPA对肺癌、直肠癌等多种肿瘤细胞的生长均有抑制作用[1]。EPA能调节免疫,抑制炎症[2,3],还能抑制血小板聚集,抗血栓和调血脂[4]等,但其中的确切机制尚不清楚。血管内皮细胞是新生血管因子作用的主要靶细胞[5],血管反应又是炎症过程的中心环节。因此,本研究以人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)为实验对象,观察EPA对脂多糖(lipopolysaccharide, LPS)刺激HUVECs核转录因子κB(nuclear factor kappa B, NF-κB)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、白细胞介素1α(interleukin 1α, IL-1α)和IL-6的影响,初步探讨EPA治疗新生血管性疾病和炎症性疾病的作用及可能机制。
材 料 和 方 法
1材料
HUVECs细胞株(Sciencell);LPS和EPA(Sigma);兔抗人NF-κB p65多克隆抗体(Santa Cruz);特异性人VEGF、IL-1α和IL-6 ELISA检测试剂盒(上海森雄科技实业有限公司)。
2方法
2.1HUVECs培养 -196 ℃液氮罐保存的HUVECs细胞株,37 ℃水浴复苏后,800 r/min离心10 min,弃去上清后加入10 mL含20%胎牛血清(fetal bovine serum, FBS)的DMEM培养液,置于37 ℃、5%CO2培养箱中常规培养。第2 d进行传代。HUVECs培养和鉴定方法参照张卓然等[6]和Bian等[7]的方法,经Ⅷ因子相关抗原免疫细胞化学鉴定阳性,倒置显微镜下观察细胞呈鹅卵石样排列,证实所培养的细胞为血管内皮细胞;生长良好,且已长满融合的HUVECs用于实验。
2.2HUVECs培养及ELISA检测 实验HUVECs随机分为对照组、LPS组、0.030 g/L EPA+LPS处理组、0.050 g/L EPA+LPS处理组。LPS组仅加入LPS,并使其终浓度为10 mg/L; EPA处理组先加入2种浓度的EPA(使EPA终浓度分别为0.030 g/L 和0.050 g/L)培养1 h,然后加入LPS(使LPS终浓度为10 mg/L),EPA和LPS的浓度参照文献[8-11]和本实验室预实验结果确定。以上HUVECs接种于24孔培养板中,每组设6个复孔,加入DMEM培养液于孔内,置于5%CO2培养箱内培养24 h,使细胞达到同步化。LPS刺激后6 h、12 h和24 h收集各组培养上清液, -20℃保存备ELISA用,用ELISA试剂盒检测上清VEGF、IL-1α和IL-6浓度,具体步骤按说明书操作;24 h沉淀细胞备Western blotting法检测用。
2.3Western blotting法检测HUVECs NF-κB p65总蛋白 用PBS液洗培养24 h的HUVECs沉淀细胞2次,离心弃洗液,加入5倍细胞沉淀体积的预冷的悬浮缓冲液,吹打沉淀。加入等体积2×SDS上样缓冲液,100 ℃煮5 min,然后进行聚丙烯酰胺凝胶电泳,每孔上样等量总蛋白,水浴式电印迹法将蛋白转移至膜上。室温振荡封闭膜2 h,加入1∶250兔抗人NF-κB p65多克隆抗体(Ⅰ抗)稀释液,室温轻摇2 h,用PBS-Tween 洗膜3次,加入1∶8 000 HRP标记的第Ⅱ抗体稀释液,室温振摇1 h, PBS-Tween充分洗膜,将膜浸入DAB显色液,充分显色,用蒸馏水洗膜,将膜转入PBS液中观察、照相。实验重复3次,FR-980A 生物电泳图像分析系统分析目的蛋白NF-κB p65和内参照β-actin电泳条带的灰度值,将目的条带的灰度值与同一样本内参照的灰度值相比,得出目的蛋白的相对表达量。
3统计学处理
结 果
1HUVECsNF-κBp65总蛋白
Western blotting法结果显示,LPS组HUVECs NF-κB p65表达较对照组提高,差异显著(P<0.05)。EPA组HUVECs NF-κB p65表达量较LPS组下降,差异显著(P<0.05),其下降呈浓度依赖性,见图1。

Figure 1. The protein expression of NF-κB p65 in cultured HUVECs stimulated by LPS after 24 h. 1:10 mg/L LPS+0.050 g/L EPA; 2:10 mg/L LPS+0.030 g/L EPA; 3:10 mg/L LPS; 4: control.s.n=3. *P<0.05 vs LPS group; #P<0.05 vs 0.030 g/L EPA group.
2HUVECsVEGF分泌
ELISA检测结果(图2)显示,LPS组HUVECs分泌VEGF明显增加,与对照组比较差异显著(P<0.01);LPS组3个时点的VEGF分泌量差异显著(P<0.01);LPS组3个时点的VEGF分泌量经SNK两两比较,差异显著(均P<0.05),即LPS呈时间依赖性增加HUVECs VEGF分泌,至24 h时VEGF分泌量为对照组的11倍。

Figure 2. The VEGF secretion in cultured HUVECs stimulated by LPS with or without EPA treatment.±s.n=6. *P<0.05 vs control group; #P<0.05 vs LPS group.
LPS刺激后6 h、12 h和24 h,EPA处理组VEGF的分泌量均较LPS组降低,均差异显著(均P<0.01)。SNK检验显示,3个时点2种浓度的EPA均可抑制LPS刺激的HUVECs的VEGF分泌,与LPS组比较均差异显著(均P<0.05),但2种浓度EPA的抑制作用比较差异无显著(P>0.05),24 h VEGF分泌量较LPS组分别下降81.0%和82.4%,。
3HUVECsIL-1α分泌
ELISA检测结果(图3)显示,LPS组HUVECs分泌IL-1α明显增加,与对照组比较差异显著(P<0.01,P<0.05)。LPS组3个时点的IL-1α分泌量差异显著(P<0.01);LPS组3个时点的IL-1α分泌量经SNK两两比较,除6 h、12 h之间差异无统计学意义外,其余任2个时点间差异显著(P<0.05),即LPS随时间延长增加HUVECs IL-1α分泌,至24 h IL-1α分泌量为对照组的16倍。
LPS刺激后6 h、12 h和24 h,EPA处理组IL-1α的分泌量均较LPS组降低,差异显著(均P<0.05)。SNK检验显示,LPS刺激后12 h,2种浓度的EPA均可抑制LPS刺激的HUVECs IL-1α的分泌,与LPS组比较差异显著(均P<0.05),且2种浓度EPA的抑制作用差异显著(P<0.05);LPS刺激后6 h和24 h,2种浓度的EPA均可抑制LPS刺激的HUVECs的IL-1α分泌,与LPS组比较差异显著(均P<0.05),至24 h分泌量较LPS组分别下降62.7%和68.6%,但不同浓度EPA的抑制作用差异无统计学意义(P>0.05)。
4HUVECsIL-6分泌
ELISA检测结果(图4)显示,LPS组HUVECs分泌IL-6明显增加,与对照组相比差异显著(P<0.05,P<0.01)。LPS组3个时点的IL-6分泌量差异显著(P<0.01);LPS组3个时点IL-6分泌量经SNK两两比较,差异显著(均P<0.05),即LPS呈时间依赖性增加HUVECs IL-6分泌,至24 h时IL-6分泌量为对照组的2倍。

Figure 3. The IL-1α secretion in cultured HUVECs stimulated by LPS with or without EPA treatment.s. n=6. *P<0.05 vs control group; #P<0.05 vs LPS group; △P<0.05 vs LPS+0.030 g/L EPA.
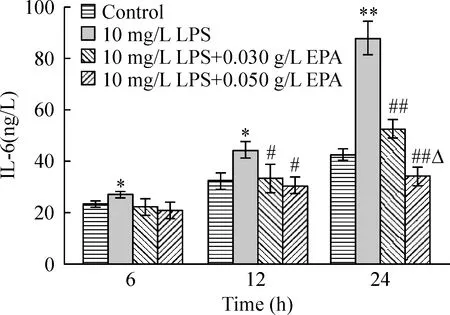
Figure 4. The IL-6 secretion in cultured HUVECs stimulated by LPS with or without EPA treatment.s.n=6. *P<0.05,**P<0.01 vs control group; #P<0.05,##P<0.01 vs LPS group; △P<0.05 vs LPS+0.030 g/L EPA.
LPS刺激后6 h, 2种浓度EPA处理组IL-6的分泌量与LPS组比较差异无显著(P>0.05)。LPS刺激后12 h和24 h,2个浓度EPA处理组IL-6的分泌量均较LPS组降低,差异显著(P<0.05,P<0.01),且24 h时2种浓度EPA的抑制作用差异显著(P<0.05),至24 h IL-6的分泌量较LPS组分别下降40.2%和61.0%。但12 h时2种浓度EPA的抑制作用差异无显著(P>0.05)。
讨 论
血管新生影响到一些眼病的发生发展,并常导致严重视力下降,如角膜新生血管、糖尿病视网膜病变、新生血管性青光眼等。新生血管形成的原因主要有:缺氧、炎症等。缺氧使组织产生和释放大量新生血管形成因子,巨噬细胞等炎症细胞也可产生大量的新生血管形成因子,刺激新生血管的形成。炎症同时也是其它眼病如角膜化学烧伤和增殖性玻璃体视网膜病变等的基本病理过程或原因。
VEGF可刺激体外培养的内皮细胞增殖、迁移和体内血管形成,是众多新生血管形成因子中最主要的一种。VEGF主要作用于血管内皮细胞[5],与血管内皮细胞表面的酪氨酸激酶受体(tyrosine protein kinase receptor, TPKR)结合,通过酪氨酸激酶信号转导路径,刺激内皮细胞的分裂、增殖和移行,导致血管发生和血管通透性增加。IL-1 和IL-6由激活的单个核细胞[5,6]、巨噬细胞[12,13]等产生,是介导急性炎症反应的重要细胞因子[14]。NF-κB是存在于体内多种细胞的核转录因子。LPS是革兰氏阴性细菌细胞壁的主要成分,是导致机体组织损伤和休克的重要介质,能促进多种细胞分泌致炎细胞因子[15]。富含鱼油的EPA具有抗动脉粥样硬化[4]、抗肿瘤[1]、抗炎[3]等作用。
本实验结果表明, LPS作用6 h、12 h、24 h引起HUVECs分泌VEGF增加,并呈时间依赖性,24 h达高峰。0.030 g/L EPA和0.050 g/L EPA均能抑制LPS诱导的HUVECs VEGF分泌。VEGF与内皮细胞细胞膜上酪氨酸激酶受体结合并作用于内皮细胞,加强血管管腔的形成[16]。因此,EPA可能通过抑制HUVECs VEGF的分泌直接发挥其抗血管生成作用。
本实验结果表明, LPS作用6 h、12 h、24 h后HUVECs分泌IL-1α和IL-6增加,呈时间依赖性,24 h达高峰。0.030 g/L EPA和0.050 g/L EPA均能抑制LPS处理的HUVECs IL-1α和IL-6的分泌。这与Moon等[17]与LeBlanc等[18]的报道一致,即EPA有抑制致炎细胞因子分泌的作用。但EPA的抗炎作用机制仍不十分清楚。有研究表明, EPA可抑制膜受体介导的信号转导和细胞因子基因表达[19]。一方面n-3多不饱和脂肪酸EPA和二十二碳六烯酸(docosahexaenoic acid, DHA)抑制Toll样受体的激活,阻断Toll样受体/细胞因子受体和NF-κB间信号级联放大,抑制Toll样受体介导的信号通路和基因表达,从而起抗炎作用;另一方面,EPA还抑制LPS与其Toll样受体结合后下游信号通路的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)活性,影响MAPK信号转导,抑制炎症因子基因表达,抑制致炎细胞因子如IL-1、IL-6 和 TNF-α表达[17、18],从而减轻炎症反应。EPA还可抑制核受体NF-κB信号转导通路:EPA通过抑制NF-κB活性,减少致炎细胞因子释放,达到抗炎作用[15]。本研究结果表明,LPS刺激后,HUVECs NF-κB p65蛋白表达较对照组增加,0.030 g/L EPA和0.050 g/L EPA均能抑制LPS处理的HUVECs NF-κB p65蛋白表达,其蛋白表达下降程度呈浓度依赖性。
总之,LPS显著上调HUVECs NF-κB p65蛋白表达,而NF-κB蛋白表达变化影响NF-κB的活性,进而影响靶基因表达,活化的NF-κB可介导HUVECs促血管生成因子VEGF,致炎细胞因子IL-1α和IL-6表达增强,导致细胞的增殖、炎症和免疫反应等,从而促进新生血管形成和炎症反应。EPA能降低LPS处理的HUVECs NF-κB p65蛋白表达,进而降低NF-κB活性,并抑制其VEGF 和致炎细胞因子IL-1α、IL-6分泌,从而发挥其抗血管生成作用和抗炎作用,这为EPA应用于各种新生血管性疾病和炎症性疾病的防治提供了理论依据。
[1] Hardman WE.(n-3) fatty acids and cancer therapy[J].J Nutr,2004,134(12 Suppl):3427S-3430S.
[2] 张敏芳,钱家麒,戴慧莉,等. 二十碳五烯酸抑制早期糖尿病肾病单核细胞趋化蛋白-1的表达[J].中国病理生理杂志, 2010,26(1):174-176,187.
[3] Singer P, Shapiro H, Theilla M,et al. Anti-inflammatory properties of omega-3 fatty acids in critical illness:novel mechanisms and an integrative perspective[J].Intensive Care Med,2008,34(9):1580-1592.
[4] Davidson MH, Stein EA, Bays HE,et al. Efficacy and tolerability of adding prescription omega-3 fatty acids 4 g/d to Simvastatin 40 mg/d in hypertriglyceridemic patients: An 8-week, randomized, double-blind, placebo-controlled study[J]. Clin Ther,2007,29(7):1354-1367.
[5] Maiti D,Xu Z,Duh EJ,et al. Vascular endothelial growth factor induces MEF2C and MEF2-dependent activity in endothelial cells[J]. Invest Ophthalmol Vis Sci,2008,49(8):3640-3648.
[6] 张卓然.培养细胞学与细胞培养技术[M].第1版.上海:上海科学技术出版社,2004.90-92.
[7] Bian F, Zhang MC, Zhu Y. Inhibitory effect of curcumin on corneal neovascularizationinvitroandinvivo[J]. Ophthalmologica, 2008,222(3):178-186.
[8] Li H, Ruan XZ, Powis SH,et al. EPA and DHA reduce LPS-induced inflammation responses in HK-2 cells: evidence for a PPAR-γ-dependent mechanism[J]. Kidney Int, 2005,67(3): 867-874.
[9] Tsuzuki T, Shibata A, Kawakami Y,et al.Conjugated eicosapentaenoic acid inhibits vascular endothelial growth factor-induced angiogenesis by suppressing the migration of human umbilical vein endothelial cells[J]. J Nutr,2007,137(3):641-646.
[10]夏延平,冯 翔,陈裕明,等.EPA、DHA对人单核细胞NO的产生、iNOSmRNA表达及NFκB活性的影响[J].卫生研究,2007,36(4):445-448.
[11]张敏芳,钱家麒,戴慧莉,等. 二十碳五烯酸对脂多糖刺激的内皮细胞炎症因子分泌的影响[J].上海交通大学学报(医学版), 2007,27(12):1444-1447.
[12]Koto T, Nagai N, Mochimaru H, et al.Eicosapentaenoic acid is anti-inflammatory in preventing choroidal neovascularization in mice[J]. Invest Ophthalmol Vis Sci,2007,48(9):4328-4334.
[13]Steer SA, Scarim AL, Chambers KT,et al.Interleukin-1 stimulates β-cell necrosis and release of the immunological adjuvant HMGB1[J].PLoS Med,2006,3(2):e17.
[14]郑 杰.炎症.见:李玉林,唐建武 主编.病理学[M].第6版.北京:人民卫生出版社,2006.70-71.
[15]Zhao Y,Joshi-Barve S,Barve S,et al. Eicosapentaenoic acid prevents LPS-induced TNF-α expression by preventing NF-κB activation[J]. J Am Coll Nutr,2004,23(1):71-78.
[16]Murota SI,Onodera M, Morita I. Regulation of angiogenesis by controlling VEGF receptor[J]. Ann N Y Acad Sci,2000,902(1):208-212.
[17]Moon DO, Kim KC, Jin CY,et al. Inhibitory effects of eicosapentaenoic acid on lipopolysaccharide-induced activation in BV2 microglia[J]. Int Immunopharmacol,2007,7(2):222-229.
[18]LeBlanc CJ, Horohov DW, Bauer JE,et al.Effects of dietary supplementation with fish oil oninvivoproduction of inflammatory mediators in clinically normal dogs[J].Am J Vet Res,2008,69(4):486-493.
[19]Lee JY, Plakidas A, Lee WH,et al. Differential modulation of Toll-like receptors by fatty acids: preferential inhibition by n-3 polyunsaturated fatty acids[J]. J Lipid Res,2003,44(3):479-486.
EffectsofeicosapentaenoicacidonexpressionofnuclearfactorκBandreleaseofcytokinesinhumanumbilicalveinendothelialcellsstimulatedbylipopolysaccharide
BAO Yong-qin, MA Jing-xue, YE Cun-xi, DONG Bai-xia, ZHAI Ying
(DepartmentofOphthalmology,TheSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China.E-mail:majingxue2003@yahoo.com.cn)
AIM: To investigate the effects of eicosapentaenoic acid(EPA) on the expression of nuclear factor kappa B(NF-κB) and release of vascular endothelial growth factor(VEGF), IL-1α and IL-6 in cultured human umbilical vein endothelial cells(HUVECs) stimulated by lipopolysaccharide(LPS).METHODSHUVECs were obtained from cell strain and culturedinvitro. HUVECs were divided into 4 groups: control group, LPS group, 0.030 g/L EPA treatment group and 0.050 g/L EPA treatment group. The cells were cultured with LPS alone in LPS group and incubated with EPA for 1 h in the EPA pretreatment groups at the concentrations of 0.030 g/L and 0.050 g/L before LPS stimulation. Twenty-four hours after stimulated by LPS, the protein expression of NF-κB p65 in HUVECs were assessed by Western blotting analysis at different time points. The production of VEGF, IL-1α and IL-6 in cultured HUVECs was evaluated by ELISA. The effects of EPA on the protein expression of NF-κB p65 and the production of VEGF, IL-1α and IL-6 in HUVECs challenged by LPS were also determined.RESULTSCompared with control group, the protein expression of NF-κB p65 was significantly increased in HUVECs induced by LPS and was inhibited by EPA. Compared with control group, the protein expression of VEGF, IL-1α and IL-6 was dramatically increased in HUVECs induced by LPS and most of the increase was inhibited by EPA.CONCLUSIONLPS enhances the protein expression of NF-κB and the release of VEGF, IL-1α and IL-6. EPA inhibits the protein expression of NF-κB, and the production of VEGF and the inflammatory cytokines in cultured HUVECs stimulated by LPS, indicating that EPA may be useful for preventing and treating neovascular and inflammatory diseases.
Eicosapentaenoic acid; Human umbilical vein endothelial cells; NF-kappa B; Vascular endothelial growth factors; Cytokines
Q3
A
10.3969/j.issn.1000-4718.2011.02-032
1000-4718(2011)02-0378-05
2010-06-12
2010-11-30
△通讯作者Tel:0311-66002352; E-mail:majingxue2003@yahoo.com.cn

