2010年广西中药饮片生产企业 G MP跟踪检查情况分析
韦广辉
2010年广西中药饮片生产企业 G MP跟踪检查情况分析
韦广辉
分析 2010年广西中药饮片生产企业跟踪检查中发现的缺陷项目情况,找出中药饮片生产企业实施 G MP运行过程中的薄弱环节,对如何加强中药饮片生产企业的技术监督管理提出建议。
中药饮片生产企业,跟踪检查,情况分析
为了确保已通过 G MP认证的中药饮片生产企业能严格按照 G MP要求组织生产,持续地、科学地、全面地抓好药品质量管理,防止企业在管理上出现松懈现象,推进药品专项整治工作深入开展,在 2010年,全区派出了 78人次对 26家中药饮片生产企业进行了 G MP证书有效期内跟踪检查,共发现缺陷项目 274次,其中出现 5次以上的一般缺陷项目268次,严重缺陷 6次,涉及检查条款 33项,出现频率最高的项目为 23次 (统计分析结果见表 1)。说明中药饮片生产企业在 G MP实施过程中存在一些普遍现象或共性问题,本文就跟踪检查中出现频次较高的条款进行简要分析,并提出建议。
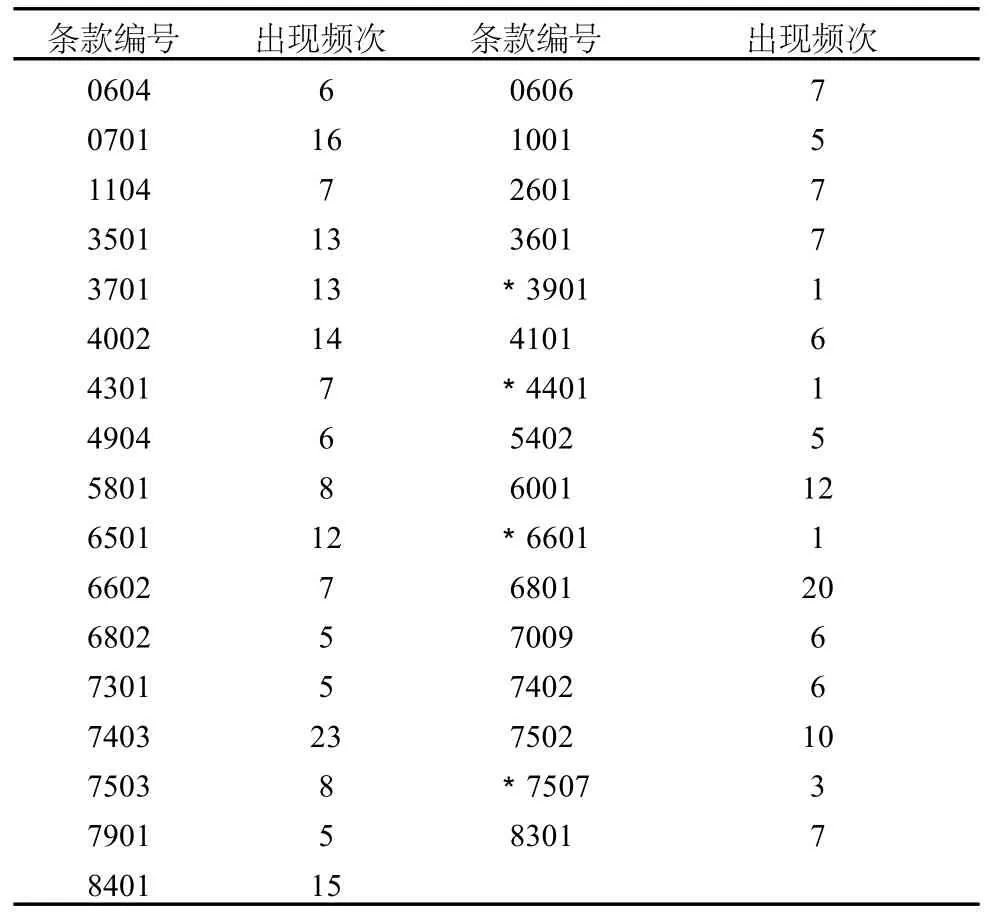
表 1 跟踪检查缺陷条款出现频次表(带*号的为严重缺陷):
1 跟踪检查中发现的存在问题
1.1 机构与人员
有的企业把认证工作当作一种形式,认证通过后万事大吉,不重视人才的引进和培养,专业人才和管理人才严重匮乏,导致人员结构欠稳定,变动较大。26家企业中有 14家企业的关键岗位如生产或质量负责人有变更,个别企业 2年内变更了 2次,生产操作人员流动性也较大 (占总数的 54%)。
人员培训工作流于形式,培训内容缺乏针对性,新法律、法规不能及时培训,工艺、设备更新不能及时培训,新员工及员工岗位调整后培训不到位,或针对性较差,部分从事保管、养护、炮制和质量管理的人员缺乏相应的中药材和中药饮片专业知识 (占总数的 64%)。
1.2 厂房与设备
26家中药饮片生产企业中,25家的生产设备均能正常运转,但其中 13家企业不同程度存在维护保养记录不全;生产和检验用的仪器、仪表、量具等未定期校验,有的厂房损坏、破裂、脱落不能及时修复,生产设备状态标志不清等现象 (占总数的 52%)。
1.3 物料
部分企业对购入的中药材贮存管理较差,未严格分区分垛存放,货位卡缺失,包装上无明显的标签,未注明规格、数量、产地、来源等,可追溯性较差 (占总数的 56%)。
1.4 验证
部分企业对验证工作认识不足,理解不深,导致验证过程的数据和分析内容过于简单、不足以支持验证结果。且部分验证的材料未能以文件的形式保存。有的企业在生产一定周期后,未进行再验证工作 (占总数的 48%)。
1.5 文件
部分企业制定的文件与实际生产和质量管理过程不符合,或是内容过于简单,未能对生产和质量管理全过程起指导和规范作用 (占总数的 48%)。
1.6 生产管理
部分企业不能按照工艺规程编写批生产记录,批生产记录未能反映出整个生产过程,或数据不完整,操作人员漏签名,不按规定更改记录等,个别企业有过后补记录的现象 (占总数的 80%)。
1.7 质量管理
大多数企业缺乏与生产规模、种类和质量检验要求相适应的仪器设备 (占总数的 92%),检验人员数量不足,检验水平有限,对原药材和成品未能做到全检,多数企业只能做主要项目 (如真伪鉴别)的检验,部分企业甚至连真伪鉴别都不能做到批批检验,未严格执行委托检验协议,送检率低 (占总数的 23%)。
1.8 自检
部分企业自检意识较差,未定期按照 G MP规范进行自检,或自检记录不完整,无纠偏措施和总结内容,自检后的存在问题整改不到位 (占总数的 52%)。
2 建议
2.1 加强宣传教育
中药饮片生产企业是为广大人民群众提供安全有效的中药饮片的重要场所,生产合格的中药饮片,企业自律是前提,因此,作为药监部门,应该采取措施,积极创造一种能够使企业自律的氛围,达到使中药饮片生产企业自觉遵守法律、法规、规章进行中药饮片的生产。如开展各种形式的《药品管理法》、《药品生产质量管理规范》等法律法规的广泛宣传,强化第一责任人意识,严格按中药饮片G MP要求组织生产和炮制中药饮片,确保生产出合格的中药饮片。
2.2 加强教育培训
中药饮片生产企业属于技术型生产企业,G MP管理措施的落实完全取决于执行者的技术水平及素质高低。因此,中药饮片生产企业应引进具有中药材鉴别知识和中药材炮制经验的老药工,或中药专业技术人员,对一些关键岗位如中药材购进、验收、炮制加工、质量检验等人员加强中药专业知识的培训,不断提高从业人员的综合素质。确保中药饮片的质量。
2.3 加强监督管理
跟踪检查是参通过 G MP认证后生产企业的动态监管,在日常监督管理中,结合认证检查中发现的缺陷项目的整改情况和药品质量抽查中发现的问题,重点检查生产现场的批生产记录和实验记录等数据和内容的符合性,提高企业在日常生产过程中的安全意识,确保中药饮片炮制、质量检验各环节的可追塑性,消除质量隐患。达到跟踪检查的目的。
530022广西食品药品监督管理局药品认证审评中心

