HPLC法测定石蒜中加兰他敏含量的方法研究
江海 曹小勇 吴三桥等
摘要:建立了测定石蒜中加兰他敏含量的高效液相色谱法。以梯度乙腈-0.2%磷酸为流动相,Eclipse XDB-C18(4.6 mm×150 mm,5 μm)为固定相,流速为1 mL/min,柱温为20 ℃,检测波长为289 nm,对加兰他敏进行分析。结果表明,加兰他敏在该色谱条件下与其他组分均能有效分离,符合分析条件。
关键词:高效液相色谱;加兰他敏;石蒜;含量
中图分类号:O657.7+2文献标识码:A文章编号:0439-8114(2011)16-3389-03
Determination of Galanthamine in Lycoris radiata by HPLC
JIANG Hai1,2,CAO Xiao-yong2,WU San-qiao1,LI Xin-sheng1,LI Zi-xuan2,WANG Yu-ting2
(1. Shaanxi Key Laboratory of Bio-resource, Hanzhong 723000, Shaanxi, China;
2. School of Biological Science & Engineering, Shaanxi University of Technology, Hanzhong 723000, Shaanxi, China)
Abstract: An HPLC method for analyzing galanthamine in Lycoris radiata was established. Eclipse XDB-C18(150 mm×4.6 mm,5 μm) was used to separate the analyte with a gradient mobile phase of Acetonitrile and 0.2% H3PO4 solution with 1 mL/min at 20 ℃, the sample was detected at 289 nm. The results showed that the established method was good for separating and analyzing galantamine effectively.
Key words: HPLC; galanthamine; Lycoris radiata; content
石蒜(Lycoris radiata)别名老鸦蒜,龙爪花,属于石蒜科石蒜属,多年生草本,叶带状,深绿色带白霜粉,分布于长江流域以南各省区,喜生于林缘、河岸阴湿处[1]。该属植物花朵色泽鲜艳,其品种众多,有红花、粉红花、黄花、淡红紫色、百合型、白长筒型等,形态别致,是一种具鳞茎的花卉植物,具有良好的观赏价值。石蒜鳞茎含淀粉,可提取植物胶代阿拉伯胶。全草含石蒜碱、加兰他敏等生物碱,具有镇静、镇痛、解热、降压、抗炎、催吐、抗病毒、抗癌等作用[2]。
陕西汉中是石蒜的适生地,在当地作为一种民间药材,已有悠久的使用历史。但另一方面,石蒜的品种繁多,不同种中的有效成分含量不一,如何科学评价石蒜中的有效成分,是开发石蒜药用价值的关键内容之一。石蒜中加兰他敏具有治老年痴呆症的功效,目前其测定方法包括:分光光度法[3]、荧光分光光度法[4]、薄层扫描法及高效液相色谱法等[5-9]。本研究对石蒜中的加兰他敏采用高效液相色谱法测定其含量,分析时间短,操作简单,能够有效测定石蒜中加兰他敏的含量,将为开发石蒜的药用价值提供基础依据。
1材料与方法
1.1材料
石蒜样品2008年8月采于陕西省西乡县,经80℃烘干、粉碎,过60目分样筛,备用。
1.2仪器
高效液相色谱仪Agilent 1100(美国安捷伦公司);SK-120E超声波提取仪(宁波科生仪器有限公司);UV-2550紫外-可见分光光度计(日本岛津公司);TTL-10A超纯水器(北京同泰联科技发展公司);302型电热恒温鼓风干燥箱(山东潍纺医药集团股份有限公司医疗器械厂);FW117型中草药粉碎机(天津市泰斯特仪器有限公司);AUW220D十万分之一分析天平(日本岛津公司);FA2004N万分之一电子天平(上海分析仪器);TD24-低速台式离心机(长沙湘仪器有限公司);G80D23YS2-Q6微波炉(格兰仕微波炉电器有限公司);电热板(北京科伟永兴仪器有限公司)。
1.3试剂
甲醇、氯仿、磷酸、氨水为分析纯,乙腈为色谱纯;加兰他敏标准品(纯度为99.8%,SIGMA公司)。实验用水为纯水仪制备的去离子水。
1.4方法
1.4.1检验波长选择取加兰他敏标准品适量,用去离子水配成标准溶液,在190~900 nm之间扫描其吸收图谱。
1.4.2色谱条件色谱柱:Eclipse XDB-C18柱(4.6 mm×150 mm,5 μm);检测波长:289 nm;流动相:不同体积比的乙腈-0.2%磷酸梯度洗脱,即:0 min(97∶3)-5 min(90∶10)-8 min (80∶20)-10 min(97∶3);流速:1 mL/min;柱温:20 ℃。
1.4.3标准溶液的制备精密称取5.0 mg加兰他敏标准品,用去离子水溶解,定容于10 mL容量瓶中。制得加兰他敏标准品0.5 mg/mL的标准母液[10]。
1.4.4线性范围考察精密吸取加兰他敏标准品母液0.25、0.5、0.75、1.0和1.25 mL,用去离子水定容至5.0 mL容量瓶,制备不同浓度的加兰他敏标准溶液,经0.45 μm微孔滤膜过滤,按上述色谱条件分别进样10 μL,测定标准溶液的峰面积。以进样量为横坐标,峰面积为纵坐标,拟合绘制标准曲线。
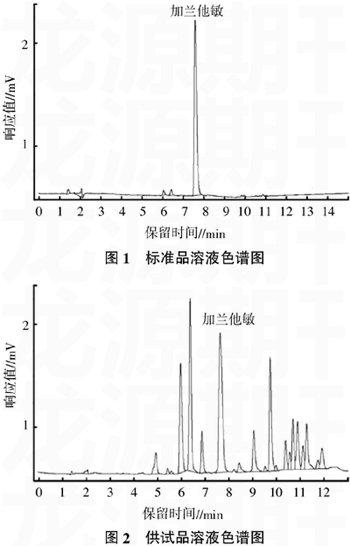
1.4.5样品溶液的制备称取干燥石蒜粉末1 g于80 mL烧杯中,加入25 mL甲醇,在常压下进行微波提取。间隔30 s后取出用冷水冷至室温,然后重复微波提取,直至累计提取时间达10 min。待提取液冷至室温后,以4 000 r/min离心5 min,取上清液于水浴50 ℃蒸干,残渣溶于5 mL 0.5 mol/L盐酸,离心,取上清液,用氨水调pH值至10,然后用氯仿萃取3次,每次10 mL,合并氯仿液,水浴50℃蒸干,残渣用去离子水溶解并定容于5 mL容量瓶中[11,12]。过0.45 μm微孔滤膜后进行色谱分析,同时进行精密度、稳定性、重现性以及回收率实验。
2结果与分析
2.1检测波长
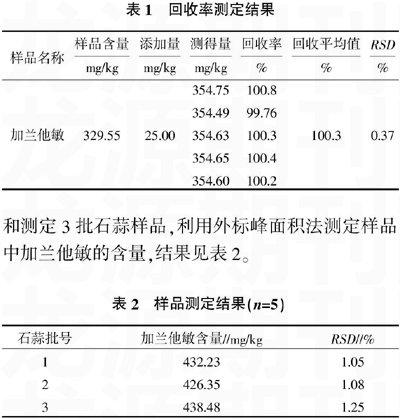
根据其紫外-可见吸收光谱,加兰他敏标准品在224、232和289 nm处存在最大吸收光谱,参照早期研究[7-9],本实验选用289 nm为检测波长。
2.2线性范围
标样色谱图见图1,根据不同浓度标准品的峰面积,计算得其线性回归方程为:y=46.2x+296.9,r= 0.999 8,表明加蘭他敏在0.25~1.25 μg范围内线性关系良好。
2.3精密度试验
精密吸取上述供试样品溶液10 μL,连续进样5次,测定加兰他敏峰面积,得结果分别为4 907、
4 951、4 946、4 915、4 988,RSD为0.65%(n=5)。
2.4稳定性实验
精密吸取上述供试样品溶液10 μL,分别在2、4、8、24和48 h进样测定加兰他敏的峰面积,RSD为1.08%(n=5)。结果表明供试品溶液中的加兰他敏在48 h内稳定。
2.5重现性实验
取同一材料,按1.4.5的制备方法平行制备5份,依法测定加兰他敏的峰面积,其RSD值为1.48%(n=5)。
2.6回收率试验
分别称取已知加兰他敏含量的石蒜样品1.0 g,共5份,加入25.00 μg/mL的加兰他敏标准品1 mL,按1.4.5样品溶液制备的方法操作,并做色谱分析。结果(表1)表明,加兰他敏的平均回收率为100.3%,RSD值为0.37%(n=5)。
2.7样品材料测定结果
按上述供试液制备方法及色谱条件分别提取和测定3批石蒜样品,利用外标峰面积法测定样品中加兰他敏的含量,结果见表2。
3讨论
1)在本试验中,我们首先考察了加兰他敏的提取方法。采用6 mol/L的盐酸-3 mol/L氢氧化钠提取法在过滤和蒸干时较为困难,提取率低,峰形较差,难以用于定量分析;而用甲醇提取时,也存在提取物峰形差的问题;经过摸索,发现采用甲醇-氯仿法提取物的提取率高,重复性好,色谱峰形对称,所以后续试验采用该法进行提取。
2)在液相分析过程中,采用碱性流动相时,出峰时间在20 min之后,且峰形拖尾严重,峰形对称性差,基线不易走平,而以乙腈∶水(22∶78,V/V),含1%(V/V)三乙胺,醋酸调pH值为7.0;或者磷酸盐缓冲液(pH值为3~4)∶甲醇(体积比为93∶7)以及体积比为20∶80的乙腈:水(含0.1%TFA,V/V)等流动相进行洗脱时[13],保留时间在5 min以内,将目标物与杂质分开。因此,最后选择不同体积比的0.2%磷酸-乙腈梯度洗脱,即:0 min(97∶3)-5 min(90∶10)-8 min(80∶20)-10 min(97∶3),并采用能耐受酸性环境的Eelipse XDB-C18(5 μm,4.6 mm×150 mm)色谱柱,石蒜中各种成分分离较好,而且加兰他敏的峰形较好,重复性好,能有效检测石蒜中的加兰他敏,为科学评价石蒜中的有效成分提供了分析依据。
参考文献:
[1] 张露,王光萍. 石蒜类植物无性繁殖技术[J]. 南京林业大学学报(自然科学版),2002,26(4):1-5.
[2] 邓传良,周坚. 石蒜属植物生物碱研究概况[J]. 中国野生植物资源,2004,23(6):13-14.
[3] 方玲,叶铭龙. 紫外分光光度法测定氢溴酸加兰他敏片的含量及含量均匀度[J]. 上海医药,1998,19(9):35-36.
[4] 李霞,熊远福,蒋利华,等. 荧光法测定石蒜中加兰他敏含量[J]. 作物研究,2006,20(2):149-150.
[5] 李霞,熊遠福,蒋利华,等. 一步法测定加石蒜中加兰他敏和石蒜碱含量[J]. 化工进展,2008,27(6):904-907.
[6] 靳朝东. 用HPLC法快速测定石蒜科植物中的加兰他敏[J]. 国外医药(植物药分册),2005(1):16.
[7] 范华均,染伟,李攻科. 微波辅助提取/HPLC分析石蒜中的生物碱[J]. 分析测试学报, 2006,25(3):27-30.
[8] ABDALLAH O M.Minor alkaloids from lycor is sanguinea[J]. Phytochemistry,1995,l39:477-478.
[9] 吴芳丽,李爱珍,毛慧芳. HPLC测定石蒜中加兰他敏含量[J]. 中国中药杂志,2005,30(7):523-525.
[10] 江海,吴三桥,李新生.利用HPLC法测定狼牙刺种子氧化苦参碱含量[J]. 江苏农业科学,2008(6):245-246.
[11] 王晓燕,黄敏仁,韩正敏.微波辅助提取石蒜属植物忽地笑中加兰他敏的研究[J].南京中医药大学学报,2005,21(6):374-375.
[12] KITA Y,GYOTEN M,NAKAJIMA M,et al. Oxidative intramolecular phenolic coupling reaction induced by hypervalent iodine(III) reagent: Leading to galanthamine-type amaryllidaceae alkaloids[J]. The Journal of Organic Chemistry,1998,63(19):6625-6633.
[13] 王晓燕,黄敏仁,韩正敏. 石蒜属植物中加兰他敏的分离提取及其应用[J]. 南京林业大学学报,2004,28(4):79-83.

