冷藏对鱼腥草品质及酶活性变化的影响
岳彩艳 徐俐 尹智华


摘要:为研究冷藏条件下鱼腥草(Houttuynia cordata Thunb.)保鲜效果,寻求简便、高效的保鲜方法,以新鲜鱼腥草为试材,在温度1~5 ℃、湿度75%~80%条件下,结合保鲜剂处理及包装对鱼腥草失重率、呼吸强度、总黄酮含量、1,1-二苯基-2-三硝基苯肼(DPPH)清除率、甲基正壬酮含量、剪切力、过氧化物酶及多酚氧化酶活性进行研究。结果表明,冷藏能很好地保持鱼腥草品质,减少失重的发生,保持总黄酮、甲基正壬酮含量及DPPH清除率;同时降低了呼吸强度,抑制了过氧化物酶和多酚氧化酶活性的上升。其中0.004%(m/m,下同)赤霉素、0.2%(m/m,下同)柠檬酸、0.005%(m/m,下同)亚硫酸钠结合低温处理效果最好,贮藏70 d仍保持较好的色泽及口感。
关键词:鱼腥草;品质;冷藏;酶活性
中图分类号:S567文献标识码:A文章编号:0439-8114(2011)16-3371-03
The Impact of Cold Storage on Quality and Enzyme Activity of Houttuynia cordata
YUE Cai-yan,XU Li,YIN Zhi-hua
(College of Life Science,Guizhou University,Guiyang 550025,China)
Abstract: To finda convenient and efficient preservation method, fresh Houttuynia cordata was stored at 1~5 ℃ with a humidity of 75%~80% combined with preservative treatment and package. The weight loss rate, respiration intensity, total flavonoids content, DPPH clearance rate, methylundecanones content, shear force peroxidase (POD), and polyphenol oxidase (PPO) activity were studied. The results showed that cold storage could keep the quality of H. cordata well, decrease the weight loss rate, keep the content of flavonoids and methylundecanones and DPPH clearance rate. Meanwhile, the respitatory rate was decreased and the ascending of POD and PPO activity was depressed. Treatment of 0.004%(m/m) gibberellin, 0.2%(m/m) citric acid, 0.005%(m/m) sodium metabisulfite and cold storage had the best effect, the colour and taste of H. cordata remained well in 70 days.
Key words: Houttuynia cordata Thunb.; quality; cold storage; enzyme activity
魚腥草(Houttuynia cordata Thunb.)为三白草科蕺菜属的多年生草本植物,鱼腥草原产我国,以长江流域以南分布最广,目前在云南、贵州、四川等地栽培较多[1]。现代临床研究证明,鱼腥草主要有抗菌、抗病毒、消炎、镇咳、抗过敏、利尿、增强机体免疫力等[2]作用。按照《卫生部关于进一步规范保健食品原料管理的通知》,2002年鱼腥草被国家卫生部正式确定为“既是药品,又是食品”的极具开发潜力的资源之一。
鱼腥草含有丰富的甲基正壬酮、癸酰乙醛等挥发性物质,还含有丰富的黄酮类、生物碱、有机酸、甾醇类等[2],是营养价值极高的植物。然而鱼腥草常温下贮藏易褐变老化[3],很快失去商品价值。
Lee[4]研究发现褐变与酚类物质和多酚氧化酶的活性有一定的相关性,Chisari等[5]研究发现草莓褐变不仅与多酚氧化酶有关,而且与过氧化物酶也有较大关系。就低温贮藏对鱼腥草品质及酶活性的影响进行研究,以期为鱼腥草贮藏保鲜提供理论依据。
1材料与方法
1.1材料
鱼腥草:于2010年1月10日采自贵阳市花溪区湖潮乡汪官村。试剂:柠檬酸(食品级),南通奥凯生物技术开发有限公司;赤霉素(分析纯),上海蓝季科技发展有限公司;二氧化氯(分析纯),贵阳科领化工有限公司;亚硫酸钠(分析纯),天津市协和昊鹏色谱科技有限公司;青鲜素(食品级),广州市安心生物制品有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)标准品,Sigma公司。仪器与设备:UV-7502 PC紫外可见分光光度计,上海欣茂仪器有限公司;TGL-20M台式高速冷冻离心机,长沙迈佳森仪器设备有限公司;SJQJ-600实验冰箱,北京双杰保鲜设备技术开发有限公司;TA-XT2质构分析仪,英国Stable Micro Systems公司。
1.2方法
1.2.1采后处理鱼腥草采后及时运回实验室,清洗干净,选择成熟度均一、无病虫害、无机械损伤的鱼腥草。按1 500 g/袋放入实验配置好的溶液中浸泡5 min,取出晾干后在冰箱中预冷12 h,然后用黑色聚乙烯塑料袋包装,于冰箱(1~5 ℃)贮藏,每个处理3次重复。贮藏过程中按1.2.3定期测定各项生理指标,并观察贮藏效果。
1.2.2保鲜剂配制处理组A:不添加任何保鲜剂;处理组B:青鲜素0.1%+柠檬酸0.2%+二氧化氯0.002%;处理组C:赤霉素0.004%+柠檬酸0.2%+二氧化氯0.002%;处理组D:青鲜素0.1%+柠檬酸0.2%+亚硫酸钠0.005%;处理组E:赤霉素0.004%+柠檬酸0.2%+亚硫酸钠0.005%。各处理组各成分含量均为质量分数,下同。
1.2.3测定指标与方法失重率:失重率=贮后鱼腥草的重量/贮前鱼腥草的重量×100%。呼吸强度的测定:采用静止法[6]。过氧化物酶活性测定:采用愈创木酚比色法[6]。多酚氧化酶活性测定:采用邻苯二酚比色法[6]。总黄酮含量的测定:采用铝盐比色法[7]。质构特性测定:用剪切力表示,越小越好。甲基正壬酮含量的测定:参照2005版中国药典规定的方法,取干鱼腥草25 g于500 mL烧瓶中,加水300 mL,摇匀混合后,连接挥发油测定器。自测定器上端加水使液体充满刻度部分并溢入烧瓶时为止,再用移液管加入乙酸乙酯5 mL,连接回流冷凝管,加热至沸腾,并保持微沸5 h,停止加热,放置片刻,开启测定器下端的活塞,将水缓缓放出至乙酸乙酯层上端到达0刻度线上面5 mm处为止,放置1 h以上,再开启活塞使乙酸乙酯层流入到离心管中,加入0.5 g无水硫酸钠,4 000 r/min离心5 min,然后转移到刻度试管中定容到5 mL,气相色谱仪测定。DPPH清除率的测定[8]:①DPPH溶液的配制。准确称取DPPH试剂25.7 mg,用无水乙醇溶解定容至100 mL,得浓度为257μg/mL的DPPH贮备液,于棕色瓶中冷藏备用。准确吸取10 mL DPPH贮备液,用无水乙醇定容至100mL,得浓度为25.7 μg/mL的DPPH待测液。②DPPH清除率的测定步骤。首先在10 mL具塞试管中依次加入4.0 mL 25.7 μg/mL的DPPH溶液和1.0 mL无水乙醇,混匀,30 min后以无水乙醇为参比,在517 nm处测吸光值,记为A0;然后在10 mL具塞试管中依次加入4.0 mL无水乙醇和1.0 mL待测样液,混匀,30 min后以无水乙醇为参比,在517 nm处测吸光值,记为Ar;再在10mL具塞试管中依次加入4.0 mL 25.7 μg/mL的DPPH溶液和1.0 mL待测样液,混匀,30 min后以无水乙醇为参比,在517 nm处测吸光值,记为As;最后计算DPPH清除率(Y)。Y=[1-(As-Ar)/A0]×100%。③样液制备。准确称取鱼腥草60 g,并按鱼腥草和水质量比1∶2加水打浆,准确称取6.00g匀浆于100 mL三角瓶中,加入80%(V/V,下同)的乙醇20 mL于60 ℃水浴中回流提取4 h,然后过滤。滤液收集于50 mL容量瓶中,用80%的乙醇定容并充分摇匀为待测样液。按②描述的步骤测定。亚硫酸盐的测定:参照GB/T5009.34—2003第一法。
1.2.4数据分析采用Excel软件及统计分析软件SPSS12.0对实验数据进行分析。
2结果与分析
2.1冷藏对鱼腥草失重率的影响
由图1可知冷藏过程中鱼腥草失重率呈上升趋势,整个冷藏过程中鱼腥草失重較少,最高仅达到5.02%。统计分析表明,不同处理间鱼腥草失重率差异不显著(P=0.780),这可能是因为冷藏对鱼腥草失重有一定的抑制作用。但在前40 d,处理组E失重率较其他处理组低,可见赤霉素结合亚硫酸钠处理对鱼腥草贮藏过程中失重率有一定的影响。
2.2冷藏对鱼腥草呼吸强度的影响
呼吸作用是有机体生命活动的基本代谢过程,也是果蔬在采收后进行的最重要的生理活动之一。由图2可知,冷藏过程中鱼腥草呼吸强度呈先上升后下降的趋势,这可能是前期贮藏过程中温度的剧烈变化使呼吸强度升高,10 d以后温度相对稳定,呼吸强度变化不明显。统计分析表明,不同处理间鱼腥草呼吸强度差异不显著(P=0.203),这可能是因为冷藏使鱼腥草呼吸强度得到了很好地抑制。但在整个贮藏过程中处理组E呼吸强度较其他处理组略低,这说明赤霉素结合亚硫酸钠能较好地抑制鱼腥草呼吸强度的上升,这对于鱼腥草贮藏是非常有利的。
2.3冷藏对鱼腥草总黄酮含量的影响
由图3可知,冷藏条件下鱼腥草总黄酮含量先上升,到第40天达到高峰,然后缓慢下降。统计分析表明,不同处理间鱼腥草总黄酮含量差异显著(P=0.010),在整个贮藏过程中处理组E总黄酮含量一直高于其他组,而且总黄酮含量高峰推迟到第50天出现,峰值比对照高出0.022 g/(100g)。这说明赤霉素结合亚硫酸钠能较好地保持鱼腥草总黄酮含量,有利于贮藏结束后货架期的延长;同时冷藏也较好地保持了鱼腥草总黄酮含量,贮藏70 d后总黄酮含量整体比贮藏前高。
2.4冷藏对鱼腥草DPPH清除率的影响
DPPH清除率的高低反应了生物体内抗氧化物质含量的高低,它们之间呈正相关性[9]。由图4可知,DPPH清除率随着贮藏时间的延长呈先上升后下降的趋势,在第40天达到高峰,峰值比处理组A的高出3.66%。统计分析表明,不同处理间鱼腥草DPPH清除率差异极显著(P﹤0.01)。在整个冷藏过程中处理组E清除率一直处于较高的水平。因此,突出地显现赤霉素结合亚硫酸钠对保持鱼腥草中抗氧化物质效果显著,而且冷藏条件下各处理组DPPH清除率也都保持了较好的水平。
2.5冷藏对鱼腥草过氧化物酶活性的影响
由图5可知,过氧化物酶活性在前期较低,在第40天时到达活性高峰。统计分析表明,不同处理间过氧化物酶活性差异极显著(P﹤0.01)。在整个冷藏过程中处理组E过氧化物酶活性一直低于其他处理组,说明赤霉素结合亚硫酸钠对鱼腥草贮藏过程中抗逆境胁迫起到了一定的促进作用,同时冷藏对整个贮藏过程鱼腥草褐变老化都有一定的保护作用。
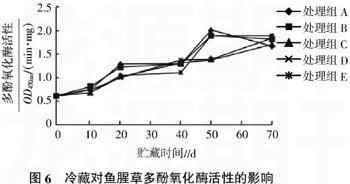
2.6冷藏对鱼腥草多酚氧化酶活性的影响
由图6可知,多酚氧化酶活性在整个贮藏过程中呈现先上升后下降的趋势,在第50天达到活性高峰,但活性在整个贮藏过程中变化不大,这同李建芳等[10]的研究相似。统计分析表明,不同处理间多酚氧化酶活性差异不显著(P=0.112)。在贮藏40 d之前处理组E多酚氧化酶活性较其他处理组低,但整个贮藏过程中多酚氧化酶活性变化较小。说明赤霉素结合亚硫酸钠在鱼腥草贮藏过程中对抑制鱼腥草组织褐变有一定的效果,但低温对鱼腥草活性影响较小。
2.7冷藏对鱼腥草质构特性的影响
质构分析法(Texture profile analysis,TPA)是近年来发展起来的一种新型仪器测试方法,其原理是利用力学测试方法来模拟人的两次咀嚼动作记录力和时间的关系,从中找出与人的感官评价对应的参数。徐志斌等[11]采用质构分析法对杨梅果实采摘后的品质变化规律进行研究发现,硬度、凝聚性、回复性和咀嚼性之间具有较高的相关性和相同的变化趋势,可以采用其中任意一个参数来表征杨梅果实的品质。因此,试验采用剪切力对鱼腥草感官进行了评价。由图7可知,鱼腥草在贮藏过程中剪切力在前期变化缓慢,在第40天时迅速升高,然后变化缓慢。统计分析表明,各处理间差异显著(P=0.024),这可能与冷藏能较好地保持鱼腥草的品质有关。贮藏70 d后基本没有腐烂,质地鲜脆,具有较好的口感。
2.8冷藏对鱼腥草甲基正壬酮含量的影响
由表1可知,甲基正壬酮含量贮藏后比贮藏前略高,这可能与鱼腥草采收后有后熟现象有关。比较贮藏后各处理组甲基正壬酮含量可知,处理组E甲基正壬酮含量最高,达到了0.574 mg/g,比处理组A高了0.166 mg/g,而处理组D含量也相对较高。这说明冷藏结合防腐剂亚硫酸钠处理很好地保持了鱼腥草甲基正壬酮含量,低温对鱼腥草甲基正壬酮含量的保持也有促进作用。
3讨论
冷藏可以极大地降低果实失重和腐烂的发生,显著延长果蔬的贮藏期,其中对酶活性也有较大的影响。据研究冷藏能明显抑制黄藤笋贮藏过程中过氧化物酶和多酚氧化酶活性,延缓黄藤笋采后的酶促褐变及衰老过程,是一种有效的贮藏保鲜方法[12],该研究结果同其相一致。呼吸作用是植物性食品变质的主要原因,谢培荣等[13]研究木洞杨梅采后生理与贮藏特性的影响,发现低温贮藏明显抑制果实贮藏过程中呼吸强度的增加。该研究通过冷藏抑制鱼腥草呼吸强度较明显。赤霉素是一种常用的植物生长促进剂,可延缓果实成熟,或使未成熟果实采收后在贮藏与运输期间延缓成熟;亚硫酸钠是一种常用的保鲜剂,它在极小浓度下能大大抑制酶的活性,从而在很大程度上抑制酶促褐变[14]。研究表明,冷藏能很好地保持鱼腥草品质,贮藏70 d基本无腐烂,口感鲜脆,失重较低,总黄酮、甲基正壬酮含量及DPPH清除率都处于较高的水平;同时降低了呼吸强度,抑制过氧化物酶和多酚氧化酶活性的上升。经测定二氧化硫残留量处理组D和E分别为0.374 mg/kg、1.406 mg/kg,在《食品添加剂使用卫生标准》允许的范围内,其中0.004%赤霉素、0.2%柠檬酸、0.005%亚硫酸纳结合低温处理效果最好。
参考文献:
[1] 陈灿,黄璜,王林辉,等. 鱼腥草研究利用现状与趋势[J]. 作物研究,2002(5):262-265.
[2] 胡汝晓,肖冰梅, 谭周进, 等. 鱼腥草的化学成分及其药理作用[J]. 中国药业,2008,17(8):23-24.
[3] 伍贤进,张飞艳,李胜华,等. 贮藏温度对鱼腥草地下茎保鲜效果的研究[J]. 怀化学院学报,2009,28(2):52-54.
[4] LEE C Y. Enzymatic oxidation of phenolic compounds in fruits[J]. American Chemical Society,1992,506:305-317.
[5] CHISARI M,BARBAGALLO R N,SPAGNA G. Characterization of polyphenol oxidase and peroxidase and influence on browning of cold stored strawberry fruit[J]. J Agric Food Chem,2007,
55(9):3469-3476.
[6] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.
[7] 叶春,阚建全,谭书明,等. 鱼腥草叶总黄酮的提取分离[J]. 农业工程学报,2008,24(10):227-231.
[8] 胡喜兰,韩照祥,陶莹,等. DPPH法测定17种植物的抗氧化活性[J]. 食品科技,2006,15(4):76-78.
[9] 郑德勇,安鑫南. 竹叶提取物清除DPPH自由基的测定方法[J]. 福建农林大学学报(自然科学版),2005,34(1):59-62.
[10] 李建芳,蒲彪,周枫.鱼腥草中POD和PPO特性的研究[J]. 中国食品学报,2006,6(4):72-75.
[11] 徐志斌,励建荣,陈青. 杨梅果实采摘后品质变化规律的TPA表征[J]. 食品研究与开发,2009,30(2):114-117.
[12] 赵霞,郑谊,黄雪梅,等. 低温贮藏对黄藤笋3种酶活性的影响[J]. 食品与发酵工业,2009,35(9):198-200.
[13] 谢培荣,黄志乾,欧阳菊英. 低温贮藏对木洞杨梅采后生理与贮藏特性的影响[J]. 中国农学通报,2009,25(18):118-121.
[14] 黄秀珍. 莲藕贮运的保鲜技术[J].食品工业科技,1999,20(2):63.

