两步水解酶法制备大豆异黄酮苷元初探
钱丽丽 左 锋 张爱武 张永忠
(黑龙江八一农垦大学食品学院1,大庆 163319)
(东北农业大学理学院2,哈尔滨 150030)
(国家教育部大豆生物学重点实验室3,哈尔滨 150030)
两步水解酶法制备大豆异黄酮苷元初探
钱丽丽1左 锋1张爱武1张永忠2,3
(黑龙江八一农垦大学食品学院1,大庆 163319)
(东北农业大学理学院2,哈尔滨 150030)
(国家教育部大豆生物学重点实验室3,哈尔滨 150030)
利用二步水解法制备大豆异黄酮苷元。经弱碱水解丙二酰基大豆异黄酮为糖苷型大豆异黄酮,再经果胶酶进一步水解获得富含苷元的大豆异黄酮。采用单因素试验和正交试验,得到果胶酶制备大豆异黄酮苷元的较优工艺条件:果胶酶水解时间 20 min,水解温度 47.5℃,水解 pH值 4.2,酶 -底物质量比为0.80%。苷元水解得率为 87.37%。
果胶酶 染料木黄酮 黄豆苷元
随着人类对大豆异黄酮的生物学意义的不断研究,大豆异黄酮苷元的生理作用[1-3]和人体吸收形式更加明确化,从而国内学者越来越多关注大豆异黄酮苷元制备的研究,目前已见研究中的葡萄糖苷酶水解制备苷元研究[4-5],但由于此种酶尚未商业化,因此制约了大豆异黄酮苷元制备的工业化,试验首次应用果胶酶水解糖苷型大豆异黄酮制备大豆异黄酮苷元。大豆中的大豆异黄酮主要以糖苷形式存在,其中丙二酰基型大豆异黄酮占总的大豆异黄酮含量的60%之多。因此制备富含苷元形式的大豆异黄酮需要对糖苷形式的大豆异黄酮进行水解。水解分为两步,第一步是将丙二酰基型大豆异黄酮水解转化为葡萄糖苷型大豆异黄酮,第二步是将葡萄糖苷型大豆异黄酮水解成大豆异黄酮苷元,以最大限度获得高含量的大豆异黄酮苷元。对丙二酰基型大豆异黄酮水解制备葡萄糖苷型大豆异黄酮已进行研究[6],而对于糖苷型到苷元型大豆异黄酮的转化采取果胶酶水解法制备大豆异黄酮苷元,试验在前期的基础上进行第二步酶水解法,通过单因素和正交试验确定较优工艺条件,最大限度获得富含苷元大豆异黄酮,为解决酶法制备高活性大豆异黄酮的工业化提供理论依据。
1 材料与方法
1.1 材料与仪器设备
黄豆苷 (Daidzin,D)、黄豆苷元 (Daidzein,De)、染料木苷 (Genistin,G)、染料木黄酮 (Genistein,Ge):Sigma公司。果胶酶:杰诺生物酶有限公司 (经测定酶比活力为:29 812 U/mg)。豆粕 (东农 32):东北农业大学赠送。30%大豆异黄酮粉:哈高科赠送。试验所用甲醇为色谱级,其余试剂为分析纯。
CX-500型超声波清洗机:北京医疗设备二厂;LG10-2.4A型高速离心机:北京医用离心机厂;H.H.S 21-2R型电热恒温水浴锅:上海医疗器械五厂;ZFQ85A型旋转蒸发器上海医械专机厂;P680戴安高效液相色谱仪:美国戴安公司。
1.2 方法
1.2.1 大豆异黄酮含量测定
高效液相分析条件:
流动相:甲醇 ∶乙酸 (0.5%)=40∶60(体积比 ),色谱柱:Nova-Pak C18(3.9×150mm),柱温:50℃,流速:1.0 mL/min,检测波长:254 nm,进样量:10μL。
根据标准品染料木黄酮、黄豆苷元、染料木苷和黄豆苷各自性质不同,经紫外检测器测定,样品与标准品比较,以保留时间定性、峰面积定量、外标法计算。
果胶酶水解制得大豆异黄酮苷元得率的测定:

1.2.2 大豆异黄酮提取液的制备
采用脱脂豆粕作为原料,称量脱脂豆粕 (过 40目筛)1.0 g,80%乙醇浸提剂 10 mL,60℃水浴振荡3 h,调等电点 pH 4.5,3 000 r/min离心 10 min,上清液为大豆异黄酮提取液。
1.2.3 一步弱碱水解丙二酰基大豆异黄酮制备富含糖苷型大豆异黄酮
从脱脂豆粕中大豆异黄酮提取液,加入稀碱液调 pH 11.0,于 65℃水浴振荡 1 h,此过程可将丙二酰基型大豆异黄酮转化为糖苷型大豆异黄酮转化率达 90%以上。
1.2.4 果胶酶水解糖苷型大豆异黄酮为苷元型大豆异黄酮的工艺路线
用果胶酶在适合条件下进行大豆异黄酮酶水解的研究,以酶水解后大豆异黄酮苷元含量增加为指标判定酶的选择依据,果胶酶水解工艺如下:
大豆异黄酮提取液→弱碱水解[5]→旋转蒸发仪蒸去乙醇→加入醋酸盐缓冲液→果胶酶解→酶灭活→冷却→乙酸乙酯萃取→旋转蒸发仪蒸去乙酸乙酯→丙酮溶解→离心→上清液→蒸去丙酮→乙醇溶解定容→膜过滤→HPLC测定大豆异黄酮各组分含量。
以下试验均做 3次重复,试验结果以平均值进行统计。
1.2.5 果胶酶单因素试验
1.2.5.1 时间对果胶酶水解大豆异黄酮糖苷的影响
按 1.2.2和 1.2.3方法制备获得富含糖苷型大豆异黄酮制备液,旋转蒸发除去乙醇,醋酸 -醋酸钠溶液调 pH至 4.0缓冲液 100 mL,加酶量按酶 -底物质量比为 0.8%计算,在 45℃下分别水浴振荡水解15、30、45、60、120 min和过夜。经 HPLC检测大豆异黄酮苷元水解得率为指标,确定水解时间。
1.2.5.2 温度对果胶酶水解大豆异黄酮糖苷的影响
按 1.2.5.1方法分别在 40、45、50、55和 60℃下水浴振荡水解 30 min。经 HPLC检测大豆异黄酮苷元水解得率为指标,确定水解温度。
1.2.5.3 pH对酶水解得率的影响
按 1.2.5.1方法分别用醋酸 -醋酸钠溶液调 pH 3.0、pH 3.5、pH 4.0、pH 4.5、pH 5.0,加酶 -底物质量比为 0.8%,在 50℃下水浴振荡水解 30 min。经HPLC检测大豆异黄酮苷元水解得率为指标,确定水解 pH值。
1.2.5.4 不同酶 -底物浓度比对酶水解得率的影响
按 1.2.5.1方法分别加酶 -底物质量比为0.0%、0.2%、0.4%、0.6%、0.8%、1.0%、1.2%,在 50℃下水浴振荡水解 30 min。经 HPLC检测大豆异黄酮苷元水解得率为指标,确定水解酶 -底物质量比。
1.2.6 果胶酶正交试验确定酶水解条件
正交试验因素水平表见表 1。
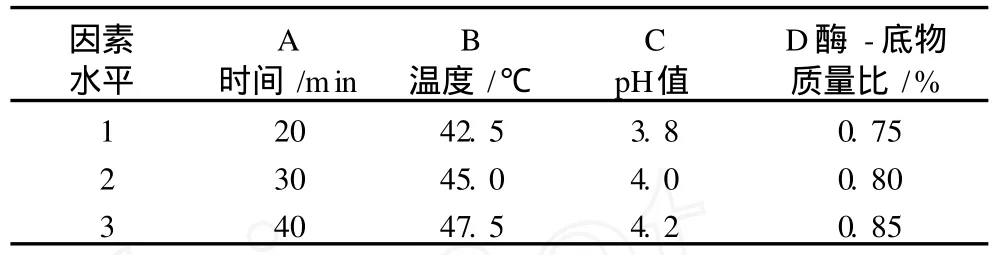
表 1 正交试验因素水平表
2 果胶酶水解糖苷型大豆异黄酮为苷元型大豆异黄酮的研究
2.1 果胶酶单因素试验
2.1.1 时间对果胶酶水解得率的影响
由图 1可知,果胶酶水解时间起初随着时间的延长,苷元水解得率迅速上升,在 30 min时水解苷元得率最高,随着时间的延长,水解得率降低后稍有增高,这主要是豆粕自身葡萄糖苷酶也参与了水解的结果。

图 1 果胶酶水解时间对大豆异黄酮苷元水解得率的影响
2.1.2 不同果胶酶 -底物质量比对酶水解得率的影响
由图 2可知,随着添加果胶酶 -底物质量比不断增加,苷元水解得率也不断迅速增加,当增加到0.8%时大豆异黄酮苷元水解得率较高。
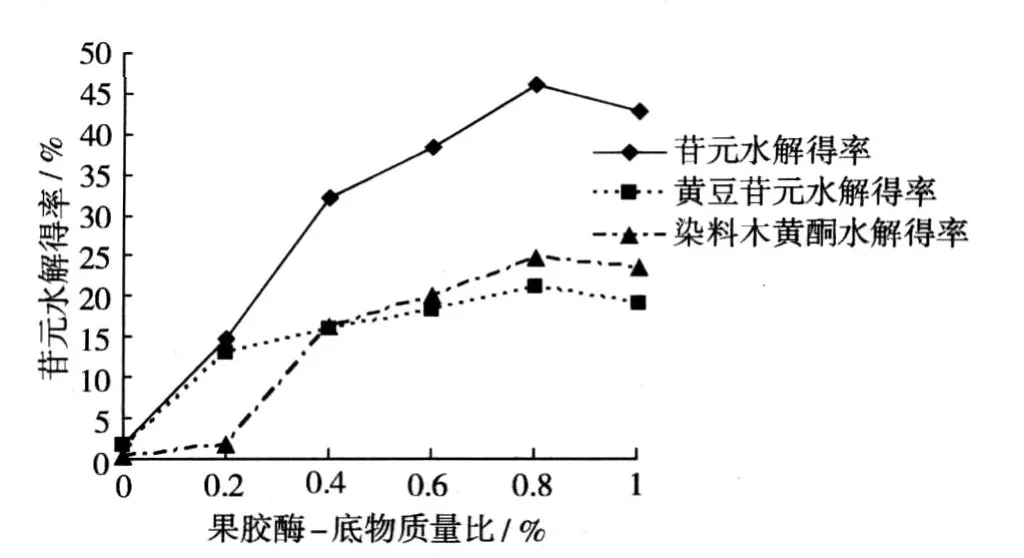
图 2 果胶酶不同酶 -底物质量比对大豆异黄酮苷元水解得率的影响
2.1.3 pH对果胶酶水解得率的影响
由图 3可知,pH值为 4.0时,大豆异黄酮大豆异黄酮水解程度最大,苷元的水解得率最高。pH在3.5时对果胶酶的水解作用起到一定的抑制。

图 3 pH对果胶酶水解大豆异黄酮苷元水解得率的影响
2.1.4 温度对果胶酶水解得率的影响
由图 4可以看到,温度对酶水解大豆异黄酮较为敏感,当温度在 45℃果胶酶酶比活力最大,水解得率也最高。大于 50℃后苷元水解得率迅速减小,与温度对果胶酶的比活力有关。

图 4 温度对果胶酶水解大豆异黄酮苷元得率的影响
2.2 果胶酶正交试验
在各种试验单因素条件下,选择各种酶影响因素的最佳条件,制定正交试验方案,结果见表 2。
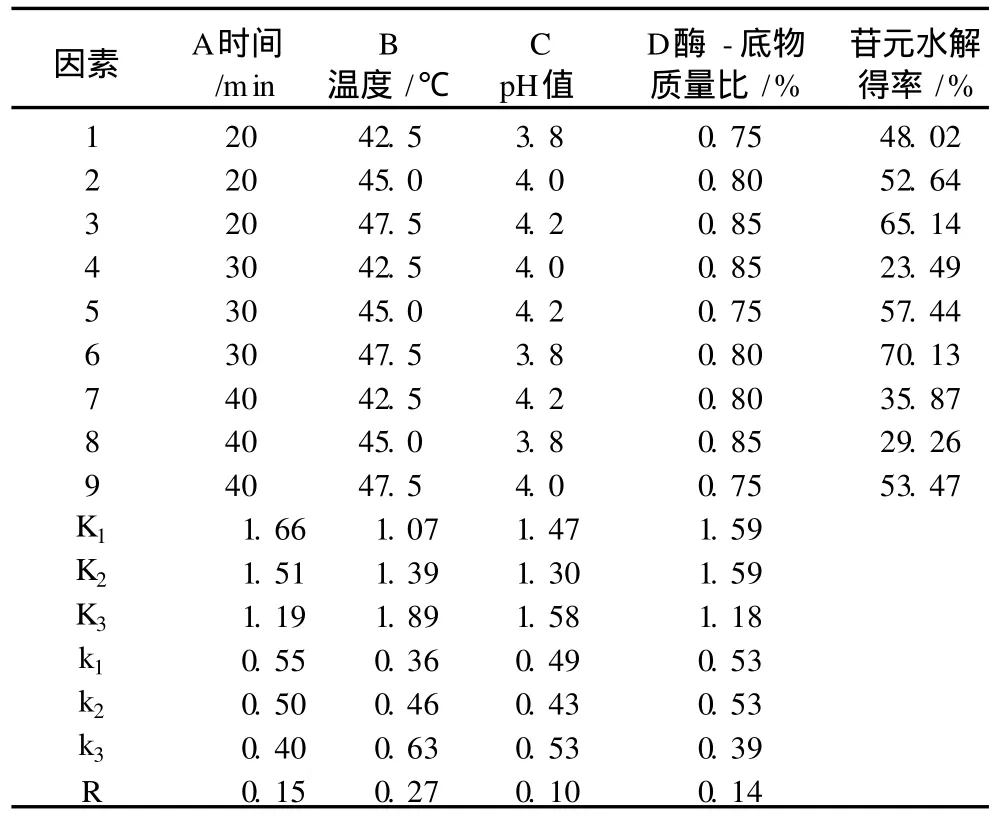
表 2 正交试验方案及结果
由极差分析结果可以看出影响果胶酶水解效率的主次因素依次为B>A>D>C。最佳水解条件为A1B3C3D2,即果胶酶水解时间 20 min,水解温度47.5℃,水解 pH值 4.2,酶 -底物质量比为 0.80%。
2.3 二步法水解制备富含苷元大豆异黄酮粉
利用上述较优条件制备富含苷元的大豆异黄酮粉,采用豆粕和 30%的大豆异黄酮粉为原料,在弱碱条件下进行丙二酰基型大豆异黄酮到糖苷型大豆异黄酮的转化,再进行工业化酶果胶酶的水解,多次萃取,回收溶剂干燥后得到富含苷元的大豆异黄酮。经 HPLC检测苷元含量及产率见表 3。水解前后样品色谱图见图 5~图 7。

表 3 二步法水解制备大豆异黄酮苷元
由表 3可以看出,果胶酶水解豆粕 10 g后得到黄豆苷元为 1.15 mg,染料木黄酮为 2.88 mg。水解30%异黄酮粉得到黄豆苷元为 112 mg,染料木黄酮为97.7 mg。
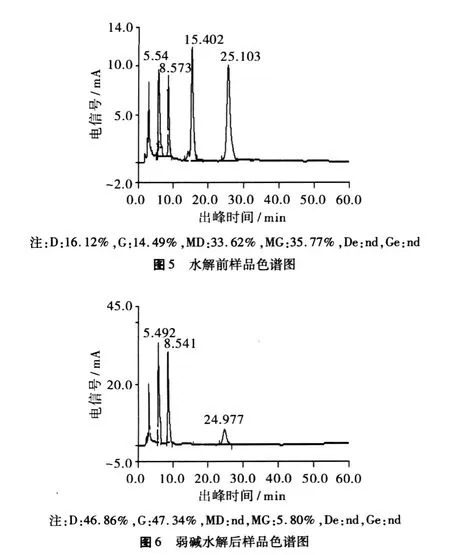
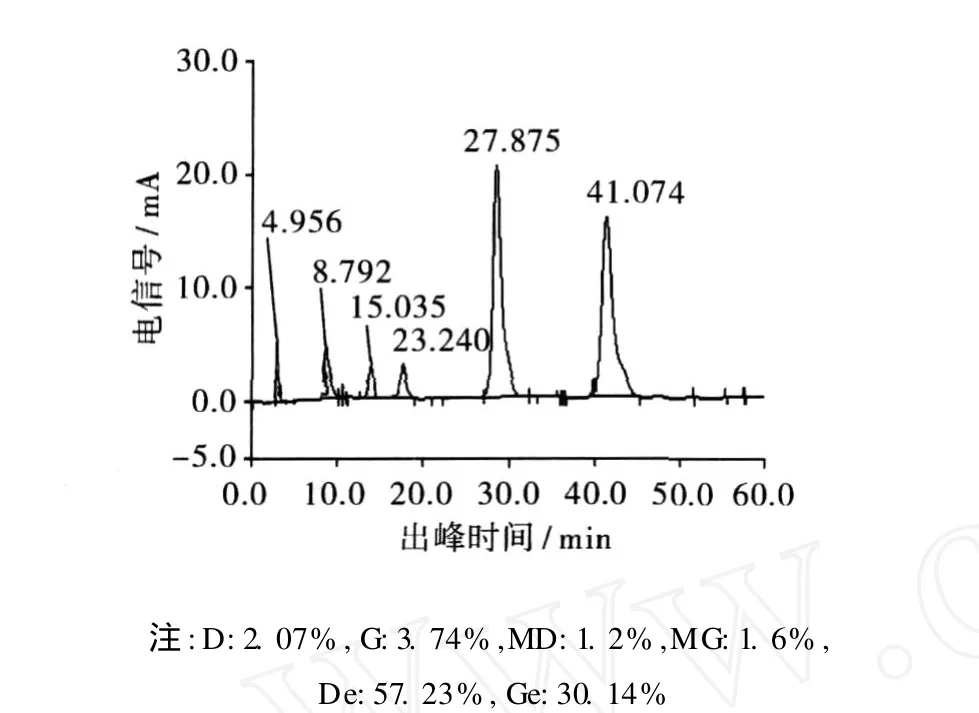
图 7 果胶酶水解后样品色谱图
从图 5~图 7可见,由峰出现的先后顺序检测物质依次为:溶剂峰、黄豆苷 D、染料木苷 G、丙二酰基黄豆苷MD、丙二酰基染料木苷 MG、黄豆苷元 De、染料木黄酮 Ge,经弱碱水解后MD、MG峰基本消失而转化为黄豆苷和染料木苷,该部分内容已在作者前期研究文献中加以研究,在此基础上进行果胶酶水解,可见在果胶酶水解时间 20 min,水解温度 47.5℃,水解 pH值 4.2,酶 -底物质量比为0.80%条件下,水解后黄豆苷元 De和染料木黄酮 Ge峰明显增加,水解后苷元水解得率达到87.37%,黄豆苷和染料木苷峰明显减小,说明果胶酶水解糖苷键效果明显。
3 结论
在前期弱碱水解丙二酰基型大豆异黄酮的基础上,通过不同酶制备富含苷元的大豆异黄酮中,初步确认果胶酶具有水解制备大豆异黄酮苷元的作用,由单因素试验和正交试验得出采用果胶酶水解糖苷形式大豆异黄酮为苷元形式大豆异黄酮较优条件为:果胶酶水解时间 20 min,水解温度 47.5℃,水解pH值 4.2,酶 -底物质量比为 0.80%。通过二步法制得富含苷元形式的大豆异黄酮。脱脂豆粕产品产率为 0.67%,总苷元质量分数为 6.03%;30%大豆异黄酮粉获得产品产率为 18.6%,总苷元质量分数为22.56%。
[1]张永忠,孙艳梅.大豆异黄酮研究中的名词术语[J].中国粮油学报,2004(4):46-49
[2]Kritz-Silverstein D and Goodman-Gruen DL.Usual dietary isoflavone intake,bone mineral density,and bone metabolism in Postmenopausal Women.Womens Health Gend.Based Med.2002,11(1),69-78
[3]Ghosh P and Fenner GP.I mproved method for gas chromato2 graphic analysis of genistein and daidzein from soybean(gly2 cine max)seeds.Agric.Food Chem,1999,47(9)3455-3456
[4]孙艳梅,张永忠.大豆 -葡萄糖苷酶水解大豆异黄酮糖苷的研究[J].中国粮油学报,2006,21(2):86-89
[5]许晶,孙艳梅.里氏木霉 -葡萄糖苷酶水解大豆异黄酮糖苷的工艺研究[J].中国粮油学报,2009,24(3):31-34
[6]张爱武,张永忠,钱丽丽,等.弱碱水解丙二酰基型大豆异黄酮的研究[J].中国食品工业,2006(12):52-53.
Transfor ming Soybean IsoflavonesAglycon by Enzyme in T wo-Step Hydrolysis
Qian Lili1Zuo Feng1Zhang Aiwu1Zhang Yongzhong2,3
(College of Food Science,August-firstLand Reclaim University1,Daqing 163319)
(College of Science,ScienceNortheastAgricultureUniversity2,KeyLaboratory of Soybean Biology ofNational Ministry of Education3,Harbin 150030)
Aglycon preparation of soybean isoflavones by two hydrolysis processwas studied.Transformingmal2 onylisoflavones to glucosides by alkalescent hydrolysis,then soybean isoflavones aglycon wasobtained by further pecti2 nase hydrolysis.Through the single factor experiment and orthogonal experiment,the following best condition of pecti2 nase hydrolysiswas obtained:enzymatic hydrolysis time 20 min,temperature 47.5℃,pH 4.2,and enzyme dosage 0.80%.The aglycon hydrolysis rate was 87.37%.
pectinase,genistein,aglycon
TS218
A
1003-0174(2011)02-0014-04
黑龙江省“十一五”重大科技攻关专项大豆综合加工关键技术研究与开发(GA06B402-4)
2010-02-06
钱丽丽,女,1979年出生,讲师,天然保健功能因子开发
张永忠,男,1953年出生,教授,食品化学

