大孔树脂吸附薯蔓黄酮条件优化及其清除氧自由基能力
李颖畅 马 勇 樊 严 刘丽萍
(渤海大学生物与食品科学学院1,锦州 121000)
(锦州农业科学研究院生物技术所2,锦州 121000)
大孔树脂吸附薯蔓黄酮条件优化及其清除氧自由基能力
李颖畅1马 勇1樊 严2刘丽萍1
(渤海大学生物与食品科学学院1,锦州 121000)
(锦州农业科学研究院生物技术所2,锦州 121000)
比较了 7种大孔树脂对薯蔓黄酮的吸附和解吸效果,研究了 HPD-600大孔树脂对薯蔓黄酮的纯化工艺参数及其对氧自由基的清除能力。结果表明,HPD-600大孔树脂是纯化薯蔓黄酮比较好的树脂;薯蔓黄酮在 HPD-600树脂上的吸附平衡时间为 3.5 h,解吸平衡时间为 2.0 h;吸附的最适质量浓度为6.08 mg/L;解吸时宜选用体积分数 60%乙醇溶液。该工艺生产的黄酮产品为黄色粉末,回收率为 81.36%,纯度为 77.58%。薯蔓黄酮具有清除氧自由基的能力,清除羟自由基的 I C50为 314.79μg/mL,清除超氧阴离子的 I C50为 326.92μg/mL。
薯蔓黄酮 大孔树脂 吸附 氧自由基
甘薯为旋花科甘薯属植物,薯蔓 (通称红薯藤,即甘薯地上部分的叶、柄、藤)资源量巨大,营养丰富,但目前对其缺乏开发利用,一般都作为废弃物抛弃,造成浪费和污染。薯蔓中不仅含有蛋白质、氨基酸、胡萝卜素、维生素、矿物质,而且富含黄酮类化合物。黄酮类化合物具有防治心血管疾病、抗氧化、抗肿瘤、抗病毒、提高免疫力等作用[1]。专家和学者非常重视黄酮类化合物,并在积极寻找廉价、高效的黄酮资源[2-4]。目前对薯蔓黄酮的研究主要集中在提取和生理功能方面[5-6],对薯蔓黄酮的纯化研究较少。大孔吸附树脂是近 10年来发展起来的一类有机高分子聚合物吸附剂,具有吸附容量大、吸附速度快、选择性好、再生简便等优点,因而被广泛用于天然产物的分离纯化[7]。本文选用 7种不同类型大孔吸附树脂对薯蔓黄酮粗提物进行吸附解吸,从中筛选出较为适合薯蔓黄酮分离纯化的树脂,优化大孔树脂分离纯化薯蔓黄酮的工艺,并通过体外化学模拟研究其对氧自由基的清除作用,旨在变“废”为宝,为充分高效利用薯蔓资源以及提高甘薯附加值提供理论依据。
1 材料与方法
1.1 材料与仪器
薯蔓:辽宁省锦州市农业科学研究院,10月份采收;芦丁 (生化试剂):中国药品生物制品检定所;乙醇:北京化学试剂公司;盐酸、氢氧化钠、柠檬酸、柠檬酸钠、石油醚:沈阳化学试剂厂;亚硝酸钠、硝酸铝、水杨酸、硫酸亚铁、过氧化氢、邻苯三酚、三羟基氨基甲烷 (Tris)、乙二氨四乙酸二钠:国药集团化学试剂有限公司;S-8:天津南开大学化工厂;HPD-100、HPD-450、HPD-600:河北沧州宝恩化工有限公司 ;AB-8、DA-201、DM-301:天津海光有限公司。
7200型可见分光光度计:上海尤尼柯有限公司;UV-1600型紫外可见分光光度计:北京瑞利分析仪器公司;RE-52型旋转蒸发仪:上海博通经贸有限公司;SHZ-III B型循环水真空泵:上海华琦科学仪器有限公司;HZQ-F全温振荡培养箱:哈尔滨市东联电子技术开发有限公司;DZF-6050型真空干燥箱:上海精宏仪器设备有限公司。
1.2 试验方法
1.2.1 薯蔓黄酮粗提物的制备
取一定量薯蔓 60℃烘干,粉碎后过 40目筛,用体积分数 60%乙醇溶液按 1∶20(g/mL)的比例混合均匀,于 50℃下浸提 2 h后抽滤,收集滤液,50℃减压浓缩,经石油醚脱脂。
1.2.2 工作曲线回归方程的建立
精密称取芦丁对照品 200 mg,用体积分数 70%乙醇溶解,定容至 100 mL容量瓶中。精密移取12.5 mL芦丁液于 50 mL容量瓶中,用蒸馏水定容,得到 0.5 mg/mL标准溶液。吸取标准溶液 0.0、0.8、1.6、2.4、3.2、4.0 mL,分别置于 25mL容量瓶中 ,加质量分数 5%NaNO2溶液 1 mL,放置 6 min后,加质量分数 10%硝酸铝溶液 1 mL,放置 6 min,再加质量分数 4%NaOH 10 mL,加蒸馏水至刻度,摇匀,放置15 min,进行全波长扫描,在 500 nm处有最大吸收波长。以测定结果得芦丁浓度与吸光度的标准曲线:Y=10.93X-0.006(X:浓度,mg/mL;Y:吸光值),R=0.999 4。
1.2.3 最佳树脂类型的筛选
树脂预处理:7种大孔树脂分别用无水乙醇浸泡24 h,充分溶胀,用无水乙醇淋洗至洗出液加适量水无白色浑浊现象为止,再用蒸馏水洗至无醇,吸干树脂中水分。
树脂吸附率和解吸率的测定:准确称取预处理大孔树脂 2 g,置于 100 mL三角瓶中。加入 50 mL一定浓度黄酮溶液,置振荡器上 30℃、110 r/min振荡吸附 24 h后,测定黄酮溶液的浓度。用蒸馏水洗去残余黄酮后吸干水分,然后加入体积分数 60%乙醇25 mL,置振荡器上于 30℃、110 r/min下振荡 24 h,充分解吸后过滤,测定滤液黄酮浓度。
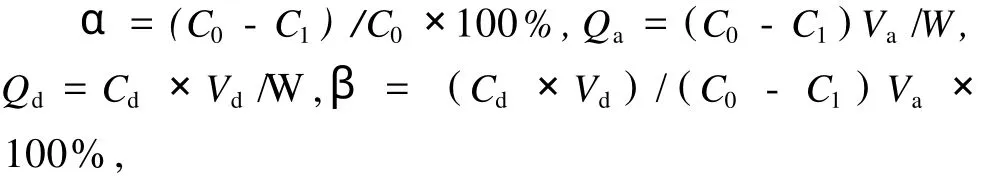
式中:α为吸附率/%;C0为黄酮溶液初始浓度/mg/mL;C1为吸附平衡后黄酮溶液浓度/mg/mL;Qa为吸附量/mg/g;Va为黄酮溶液体积/mL;W为树脂质量/g;Qd为解吸量,mg/g;Cd为解吸液浓度,mg/mL;Vd为解吸液体积,mL;β为解吸率 /%。
1.2.4 薯蔓黄酮在 HPD-600树脂上吸附平衡时间的测定
准确称取已预处理的大孔树脂 2.00 g.置于100 mL三角瓶中。加入 50 mL黄酮溶液,置振荡器上于 30℃、110 r/min下振荡,每隔 30 min测定一次吸附量,计算树脂对薯蔓黄酮吸附量与时间的关系。
1.2.5 薯蔓黄酮在 HPD-600树脂上解吸平衡时间的测定
称取吸附薯蔓黄酮饱和树脂 2.00 g,加入体积分数 60%乙醇溶液 25 mL,置振荡器上于 30℃、110 r/min下振荡,每 30 min测定一次解吸量,计算树脂对薯蔓黄酮解吸量与时间的关系。
1.2.6 薯蔓黄酮浓度对 HPD-600树脂吸附的影响
准确称取预处理的大孔树脂若干份,每份2.00 g,置于 100 mL三角瓶中,加入不同质量浓度的黄酮溶液各 50 mL,置于振荡器上 110 r/min下振荡4.5 h,待吸附平衡后测定溶液的平衡质量浓度,并计算吸附率,吸附量。
1.2.7 乙醇浓度对 HPD-600树脂解吸的影响
分别取吸附薯蔓黄酮饱和的树脂 2 g,分别加入体积分数为 20%、40%、60%、70%、80%、90%的乙醇溶液 25 mL,30℃、110 r/min下振荡 2.0 h,测定洗脱液中黄酮溶液浓度,计算解吸量。
1.2.8 薯蔓黄酮回收率和纯度测定[7]
将一定浓度的 50 mL粗提液注入盛有 2.00 g树脂的三角瓶中,置振荡器 110 r/min下振荡 4 h,然后测定上清液的浓度 C1,用去离子水洗至流出液基本无色时,加入 25 mL的洗脱剂,收集洗脱液,检测其浓度,然后将洗脱液经旋转蒸发浓缩,真空干燥,称量质量,计算后可得黄酮纯度与回收率。
纯度 =(X×V/G)×100%
回收率 =(X×V)/(X0×V0)×100%
式中:X为洗脱液中黄酮质量浓度/mg/mL;V为洗脱液体积,mL;X0为黄酮液初始质量浓度,mg/mL;V0为加入的黄酮液体积 /mL;G为洗脱液浓缩烘干后的固形物质量 /mg。
1.2.9 清除羟自由基 (·OH)的测定[8-9]
按照 Smirnoff(1989)的方法 (有改动)。利用H2O2与 Fe2+反应产生·OH,在体系内加入水杨酸捕捉并产生有色物质,该物质在 510 nm下有最大吸收。反应体系中含 8.8 mmol/L H2O21 mL,10 mmol/L FeS O41 mL,10 mmol/L水杨酸 -乙醇 1 mL,分别加入不同浓度薯蔓黄酮溶液 1 mL。最后加 H2O2启动反应,37℃反应 0.5 h,以蒸馏水作参比,在 510 nm下测定各浓度的吸光度。考虑黄酮本身的吸光值,以10 mmol/L FeSO41 mL,10 mmol/L水杨酸 -乙醇1 mL,不同浓度的薯蔓黄酮溶液 1 mL和 1 mL蒸馏水作为黄酮的本底值,抗坏血酸作阳性对照。清除率计算公式:
清除率 =[A0-(A1-A2)]/A0×100%
式中:A0为对照液的吸光度,A1为加入黄酮溶液后的吸光度,A2为不加显色剂 H2O2黄酮溶液的吸光度。
1.2.10 清除超氧阴离子自由基 (O2-·)的测定[9]
1.2.1 0.1 邻苯三酚自氧化的测定
取 4.5 mLpH 8.2的 50 mmol/L Tris-HC1缓冲液,4.2 mL蒸馏水,混匀后在 25℃恒温水浴中保温20 min后,取出后立即加入在 25℃预热过的3 mmol/L邻苯三酚溶液 0.3 mL(以 10 mmol/L HCl配制,空白管用 10 mmol/L HCl代替邻苯三酚的 HCl溶液),迅速摇匀后倒入比色杯,每隔 0.5 min在320 nm处测定溶液的吸光度,计算线性范围内每分钟吸光度的增加值。
1.2.1 0.2 样品活性测定
在加入邻苯三酚前,先分别加入不同浓度的黄酮溶液 0.9 mL,蒸馏水减少,然后按 1.2.10.1的方法操作,抗坏血酸作阳性对照,计算清除率。
清除率 =(△A0-△A)/△A0×100%
式中:△A0为邻苯三酚自氧化速率;△A为加入薯蔓黄酮后邻苯三酚的自氧化速率,单位均为吸光度每分钟的增加值。
2 结果与分析
2.1 大孔树脂对薯蔓黄酮吸附和解吸特性比较
大孔树脂由于极性、孔径、比表面积、孔容等不同,故理化性质存在差异,影响其吸附分离的效果。从表 1可见,不同类型的树脂对薯蔓黄酮的吸附程度不同,吸附率比较高的是极性 S-8、HPD-600、非极性 HPD-100和 DM301,而解吸率比较好的是HPD-450、HPD-600、DA-201,综合吸附率和解吸率两个参数,认为 HPD-600型树脂是纯化薯蔓黄酮比较好的吸附树脂,这是因为薯蔓黄酮是一种弱极性物质,在 HPD-600极性柱上更容易吸附,同时可能是因为比表面积较大的原因,也较容易洗脱,纯化后总黄酮含量较高,故以下试验重点考察 HPD-600型大孔树脂对薯蔓黄酮的纯化效果。

表 1 不同大孔树脂对薯蔓黄酮静态吸附和解吸性能
2.2 薯蔓黄酮在 HPD-600大孔树脂上的吸附动力学曲线
从图 1可知,在开始的一段时间内,HPD-600树脂的吸附量在逐渐增加,随着时间的延长,吸附量逐渐达到饱和。当吸附时间达到 3.5 h以后,HPD-600树脂对薯蔓黄酮的吸附量与 3.5 h时的吸附量差异不显著,黄酮吸附量增加很少,吸附基本达到平衡,因此 HPD-600大孔树脂对薯蔓黄酮的吸附时间为3.5 h。

2.3 薯蔓黄酮在 HPD-600大孔树脂上的解吸动力学曲线
从图 2可知,在开始的一段时间内,薯蔓黄酮的解吸量在逐渐增加;当解吸时间达到 2.0 h时,解吸基本达到平衡,2.0 h以后 HPD-600树脂对黄酮的解吸量与 2.0 h时的解吸量无显著差异,因此 HPD-600大孔树脂对薯蔓黄酮的解吸时间为 2.0 h。
2.4 薯蔓黄酮浓度对 HPD-600大孔树脂吸附的影响

图 3 薯蔓黄酮质量浓度对吸附的影响
从图 3可知,随着黄酮溶液质量浓度的增加,大孔吸附树脂对黄酮的吸附率降低,吸附量逐渐增加。不同浓度的薯蔓黄酮吸附率差异显著。浓度为 8.20和 10.30 mg/mL黄酮的吸附量差异不显著,说明质量浓度为 8.20 mg/mL时,黄酮吸附量已接近饱和。质量浓度为 6.08 mg/mL、8.20 mg/mL的薯蔓黄酮溶液,吸附量的增加率差异显著,从节约树脂和黄酮溶液的角度考虑,最适的质量浓度为 6.08 mg/mL。
2.5 乙醇浓度对 HPD-600大孔树脂解吸的影响
洗脱剂具有使大孔树脂溶胀,减弱被吸附物质与树脂之间吸附力的作用,并可溶解被吸附物质。由图 4可知,乙醇浓度对 HPD-600大孔树脂纯化薯蔓黄酮有较大的影响,随着乙醇浓度的增加,薯蔓黄酮解吸量增加。乙醇体积分数为 20%、40%时,黄酮解吸量相对较低,不能将吸附的黄酮完全解吸。乙醇体积分数为 60%、70%、80%时黄酮解吸量比较高,三者之间无显著差异。乙醇体积分数为 90%时黄酮解吸量略有降低,可能乙醇浓度高使一些杂质一起洗脱下来,致使醇溶液中黄酮含量降低。从节约试剂用量和黄酮纯度考虑,宜选用体积分数 60%乙醇溶液作为解吸液。

图 4 乙醇浓度对薯蔓黄酮解吸的影响
2.6 薯蔓黄酮回收率和纯度的测定
经 HPD-600大孔树脂纯化后的薯蔓黄酮为黄色粉末,采用 1.2.8计算方法对其回收率和纯度进行测定,所得的结果如表 2所示:薯蔓黄酮的回收率为 81.36%,纯度为 77.58%。

表 2 薯蔓黄酮回收率和纯度
2.7 薯蔓黄酮清除羟基自由基能力
羟基自由基是活性氧中最活泼的自由基,也是毒性最大的自由基[10]。它几乎能与活细胞中任何生物大分子反应,且反应速度极快。薯蔓黄酮具有供氢能力,H与自由基结合,使之还原为惰性化合物或是稳定的自由基,从而可以清除机体内过多的有害自由基。由图 5可见,在一定浓度范围内,随黄酮浓度的增大,对羟基自由基的清除率增强,薯蔓黄酮的I C50为 314.79μg/mL。抗坏血酸对羟基自由基的清除能力略好于薯蔓黄酮,抗坏血酸 I C50为 46.29μg/mL(图6)。

2.8 薯蔓黄酮清除超氧阴离子自由基能力
超氧阴离子自由基是基态氧接受一个电子产生的第一个氧自由基,可以经过一系列反应生成其他的氧自由基,因此对于超氧阴离子自由基的清除具有重要意义[11]。由图 7~图 8可知,薯蔓黄酮具有清除O2·-的作用,随着黄酮浓度的增加,对超氧阴离子自由基的清除率也随之提高,但薯蔓黄酮对的清除作用不如抗坏血酸,薯蔓黄酮的 IC50为326.92μg/mL,抗坏血酸 IC50为 34.45μg/mL。

图 7 薯蔓黄酮对超氧阴离子的清除能力

图 8 抗坏血酸对超氧阴离子的清除能力
3 结论
3.1 通过对 7种大孔树脂的静态吸附研究,发现HPD-600型大孔树脂是一种比较理想的树脂,吸附率大,解吸率高,较适合薯蔓中黄酮类成分的纯化。3.2 HPD-600大孔树脂对薯蔓黄酮的吸附平衡时间为 3.5 h,解吸平衡时间为 2.0 h,吸附最适质量浓度为 6.08 mg/mL,用 60%乙醇溶液作为解吸液。经纯化后的蓝莓叶黄酮为黄色粉末,回收率为81.36%,纯度为 77.58%。
3.3 薯蔓黄酮具有清除氧自由基的能力,但清除羟基自由基、超氧阴离子自由基能力不如抗坏血酸;清除羟基自由基的 I C50为 314.79μg/mL,清除超氧阴离子自由基的 I C50为 326.92μg/mL。
[1]曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247
[2]Chung H S,ChangL C,Lee S K,et al.Flavonoid constituents of chorizanthe diffusa with potential cancer chemopreventive activity[J].Agric.Food Chem.,1999,47(1):36-41
[3]易建华,朱振宝.芹菜黄酮在 LSA-10树脂上的吸附特性[J].农业工程学报,2008,24(9):258-262
[4]王芳,励建荣,蒋跃明.桑叶黄酮的提取纯化及对油脂抗氧化活性的研究[J].中国粮油学报,2006,21(4):106-111
[5]罗丽萍,高荫榆,夏冬华,等.薯蔓黄酮对 SD大鼠降血脂作用研究[J].食品科学,2005,26(1):211-215
[6]洪雪娥,高荫榆,罗丽萍,等.薯蔓黄酮的抗疲劳作用 [J].食品科学,2006,27(2):256-258
[7]刘斌,石任兵.应用大孔树脂吸附分离技术制备蒲黄总黄酮的研究[J].北京中医药大学学报,2002,25(4):25-28
[8]吕晓玲,孙晓侠,姚秀玲.采用荧光化学发光法分析紫甘薯花色苷产品的抗氧化作用[J].食品与发酵工业,2005,31(9):53-55
[9]吕晓玲,孔德莉,姚秀玲,等.采用荧光化学发光法研究甜菜红色素的抗氧化作用 [J].食品与发酵工业,2006,32(10):70-73
[10]曹炜,尉亚辉,郭斌.用化学发光法研究蜂胶对氧自由基的清除作用[J].光子学报,2002,31(2):162-164
[11]Takuo Nakano,Kayo Nakano.Extraction of glycosaminogly2 can peptide from bovine nasal cartilage with 0.1M sodium acetate[J].Agric.Food Chem.,1998,46(2):772-778.
Adsorption Opti mization ofMacroporous Resin to Flavonoids from Sweet Potato Vines and Scavening Ability to Oxygen Free Radicals
Li Yingchang1Ma Yong1Fan Yan2Liu Liping1
(College ofBiology and Food Science,BohaiUniversity1,Jinzhou 121000)
(Institute ofBiological Technology,Jin Zhou Academy ofAgricultural Science2,Jinzhou 121000)
The characteristicsof adsorption and desorption of seven kindsofmacroporous resins to flavonoids from s weet potato vines were studied.The opti mum industrial parameters of purifying the flavonoids by macroporous resin were deter mined.The scavenging ability on oxygen free radicals of the flavonoids was evaluated.Results:HPD-600 macroporous resin is the suitable resin for purifying flavonoids from s weet potato vines,adsorption equilibrium time is 3.5 h,desorption equilibrium time is2.0 h,optimal concentration of flavonoids is6.08mg/mL,and 60%ethanol is the suitable solution for desorption of flavonoids.The product is yellow powderwith purity of 77.58%,and the desorption rate is 81.36%.The flavonoids from s weet potato vines possess scavenging ability on oxygen free radicals,the I C50of scavenging hydroxyl free radicals and superoxide anions are 314.79 and 326.92μg/mL,respectively.
flavoniods from sweet potato vines,macroporous resin,adsorption,oxygen free radicals
TS201
A
1003-0174(2011)02-0103-05
2010-01-29
李颖畅,女,1973年出生,副教授,博士,天然产物的功效成分

