热老化对柞蚕丝蛋白二级结构的影响
李欢欢,傅吉全
(北京服装学院 材料科学与工程学院,北京 100029)
热老化对柞蚕丝蛋白二级结构的影响
李欢欢,傅吉全
(北京服装学院 材料科学与工程学院,北京 100029)
利用ATR-FTIR光谱技术和红外光谱去卷积拟合计算蛋白质二级结构百分含量,研究热老化对柞蚕丝纤维二级结构的影响,并用XRD技术分析测定了老化后柞蚕丝的结晶度。结果表明:一定温度下,随着老化时间的延长,柞蚕丝β-sheet结构的相对百分含量下降,而α-helix结构和Random结构的相对百分含量上升;老化温度越高,柞蚕丝破坏的速度越快,β-sheet结构的相对百分含量下降得也越快,结晶度下降得也更加明显。
柞蚕丝;热老化;傅里叶红外光谱;二级结构
柞蚕丝是中国特有的天然纺织原料,它是一种天然蛋白质纤维,容易受酸、碱、光、热等环境因素的影响而老化,导致柞蚕丝产品很难长期保存。因此,对柞蚕丝纤维老化过程的研究,是防止和延缓其老化的理论基础,对柞蚕丝的保护有着重要的意义。
目前很多学者从力学性能、黄变和结晶度的角度,定性分析了环境温度的升高对于蚕丝纤维的老化影响:周静洁等[1]通过热老化对桑蚕丝力学性能和结晶度的影响研究,证明了热老化会使桑蚕丝黄变失重,力学性能下降,并且在一定时间内会破坏其结晶区;武宜鸣等[2]通过热老化对天蚕丝的影响研究,进一步证明,热老化是先发生在天蚕丝纤维非结晶区而后进入结晶区的。但对于柞蚕丝纤维经热老化后其丝蛋白二级结构的变化研究,国内鲜有报道。本研究借鉴计算机拟合技术,通过红外光谱分析,半定量讨论了环境温度升高对柞蚕丝蛋白二级结构的影响。
研究丝纤维蛋白二级结构在老化过程中的变化,红外光谱和X射线衍射光谱是2种有效手段,也是目前研究最为广泛采用的方法。其中,X射线衍射光谱可以通过结晶度指数评估老化过程,而红外光谱,随着20世纪80年代末期Susi[3]和Byler[4]将红外光谱的二阶导数理论应用于蛋白质二级结构的研究,之后又将去卷积的方法应用于蛋白质二级结构分析,使得红外光谱开始进入了定量化分析阶段。90年代末,Giuliano等[5]用红外光谱分析得出一定温度条件下,柞蚕丝丝素膜蛋白的二级结构发生从Random结构到β-sheet结构的转变。最近,陈华锋等[6]利用二阶导数法研究了古代丝绸蛋白质的二级结构,半定量分析了古代丝绸和现代丝绸中丝蛋白β-sheet结构和Random结构百分含量的区别。由此可见,红外二阶导数技术可以半定量分析二级结构的含量,为了解蚕丝蛋白二级结构提供了很好的技术基础,可以更深入地研究蚕丝的老化机理。
1 试 验
1.1 材料及仪器设备
材料:市售脱胶白色柞蚕丝。
仪器设备:DHG-9203A型电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);傅里叶变换红外光谱仪(美国尼高力Nicolet iS10型,smart–ITR附件),扫描范围4 000~500 cm-1,以波数为横坐标,以吸光度为纵坐标,分辨率为4 cm-1,扫描次数为64次;X射线粉末衍射仪(理学D/max-rb和飞利浦X’Pert MDP型),Cu靶,管压40 kV,管流50 mA,λ=1.540 6 nm),测试衍射角范围为:5°~45°,扫描步长0.02(°)/s,扫描速度6(°)/min。
1.2 样品制备过程
在鼓风烘箱中,将柞蚕丝在80,110,140,170,200 ℃条件下烘干24 h,取出分析。重新调节烘箱温度,将柞蚕丝在80 ℃的条件下,老化30 d。
2 结果分析
2.1 红外光谱定性分析
分子处于一定的能态下,分子本身在不停地运动,构成分子的原子相对于键的平衡位置在不断振动,当丝纤维试样受到红外光的照射时,丝纤维分子吸收一部分能量转变为振动能和转动能,从而产生了分子的跃迁,引起分子偶极矩的变化,使得谱带上某些波长的红外光强度发生变化,得到红外吸收光谱[7]。
很多学者对蚕丝的红外光谱进行了相关研究,使得柞蚕丝的各个红外吸收峰有了较明确的归属。目前比较统一的说法为:柞蚕丝在3 300~3 290 cm-1处有—NH伸缩振动所产生的特征吸收,主要代表没有形成氢键的自由的—NH的振动,为较强的—OH吸收峰;1 575~1 480 cm-1处有—NH变形振动所产生的特征吸收谱带,主要代表形成氢键的—NH的振动,为酰胺Ⅱ带特征峰;1 690~1 600 cm-1处有C=O伸缩振动所产生的特征吸收谱带,为酰胺Ⅰ带特征峰;1 301~1 229 cm-1处有—CN和—NH的伸缩、弯曲振动所产生的吸收谱带,为酰胺Ⅲ带特征峰[8-9]。
将柞蚕丝纤维原样和热老化处理后的样品分别做红外分析。图1为柞蚕丝未老化样品和经过80 ℃热老化处理后的样品出现主要信号峰波数范围内的红外谱图。图2为柞蚕丝在不同温度下老化24 h,样品出现主要信号峰波数范围内的红外谱图。从图中可以看出,随老化时间延长,3 272 cm-1吸收峰和1 513 cm-1(酰胺Ⅱ带)吸收峰强度有所下降;而柞蚕丝的特征吸收谱带964 cm-1吸收峰的强度也有所下降;同时代表酪氨酸的酚羟基的振动吸收峰1 167 cm-1的强度变小,说明酪氨酸等大分子侧基与主链切断,有资料显示[10],酪氨酸侧基的变化是造成柞蚕丝纤维黄变的主要原因;酰胺Ⅴ带代表N—H弯曲振动的690 cm-1处的红外吸收峰,吸收峰面积变宽。随老化温度升高,红外信号峰也会出现上述变化。以上数据与文献中的描述大致相符[11],说明热老化到一定程度已经使得大分子链与主链断裂[12],自由的—NH增加,而形成氢键的—NH减少,导致其黄变,并且结晶区部分遭到破坏。

图1 柞蚕丝80 ℃老化样品随时间变化红外光谱Fig.1 Infrared spectrum of the samples at 80 ℃with time change

图2 柞蚕丝热老化24 h样品随温度变化红外光谱Fig.2 Infrared spectrum of the 24 h thermal aging samples with temperature change
从以上可以定性地看出,柞蚕丝随环境温度升高而老化,但是具体丝纤维的结构发生了哪些变化还不得而知,为了进一步地探讨柞蚕丝在热老化过程中二级结构的变化,需要对其红外谱图做进一步分析。
2.2 二级结构分析
目前用于红外谱图分析二级结构的方法,主要有因数分析法(FA)、奇值分析法(SVD)、傅里叶去卷积法(FSD)、二阶导数法(SD)及曲线拟合[13]等,本研究主要应用了FSD、SD及曲线拟合法。首先将红外谱图利用傅里叶去卷积技术解析重叠峰,使得信号峰形变窄,并且保持峰的位置和面积不发生变化[14]。再利用OMNIC V8.0数据处理软件校正基线,最后采用ORIGIN 8.0数据处理软件选用Causse函数对二阶导数谱和傅里叶去卷积谱图进行曲线拟合,使得残差最小,并根据积分面积计算各二级结构的相对百分含量。
丝纤维的红外吸收光谱主要由一系列的酰胺带组成,其中酰胺Ⅰ(1 700~1 600 cm-1)为红外吸收强峰,对二级结构的研究最有影响,但是由于水在1 640 cm-1附近有较强的吸收峰,所以对其准确定量会造成很大的影响。而酰胺Ⅲ(1 330~1 220 cm-1)带虽然信号较弱,但是水在此吸收带没有吸收,并且二级结构的光谱性质特征明显[9]。因此本文主要研究了经热老化后,柞蚕丝纤维酰胺Ⅲ带的分子构象变化。
将老化处理后样品的红外吸收谱图酰胺Ⅲ带去卷积,并且根据二阶导数的峰位置对去卷积谱进行高斯拟合,结果如图3、图4所示。由于1 218 cm-1和1 340 cm-1分别对应较强的峰位置,为使拟合相对准确,选取拟合范围1 340~1 190 cm-1,将此二峰一并拟合,但是计算丝纤维蛋白质二级结构时不计入此峰[15]。

图3 80 ℃条件下酰胺Ⅲ带Guassian拟合结果Fig.3 Gaussian fi tting chart of silk amide Ⅲ at 80 ℃

图4 不同温度下酰胺Ⅲ带Guassian拟合结果Fig.4 Gaussian fi tting chart of silk amide Ⅲ at different temperatures
柞蚕丝经80 ℃条件下老化的红外谱图拟合结果为图3所示。从图3可以看出,在酰胺Ⅲ带中,随着老化时间延长,归属于β-sheet结构的1 235cm-1[16]峰,拟合后吸收峰的面积逐渐减小,并且峰的位置有向大波数移动的趋势;归属于Random结构的1 260 cm-1峰,拟合后吸收峰的面积逐渐变大;归属于α-helix结构的1 305 cm-1峰,拟合后吸收峰的强度有所增大。图4为柞蚕丝在24 h内随温度升高,酰胺Ⅲ带内归属于不同结构的吸收峰的拟合结果。从图4可以看出,在80 ℃和110 ℃的条件下,归属于各个结构的吸收峰的面积未发生明显变化,也未发生峰位置的明显移动;但是当温度继续升高(140 ℃以上)的时候,β-sheet结构的归属峰面积明显下降,而相对的Random结构的归属峰的面积开始变大,α-helix结构的归属峰强度也开始变大。
经老化处理后的丝纤维二级结构百分含量的具体变化见表1/表2。表1为80 ℃条件下柞蚕丝被老化后各结构百分含量的变化,从表1可以看出,柞蚕丝的β-sheet结构相对百分含量由于热老化的影响而下降,α-helix结构和Random结构相对百分含量相对升高。在老化10 d之后,变化开始明显。从拟合数据可以看出随着老化时间延长,热老化作用逐渐开始破坏β-sheet结构,断裂分子间的氢键,将β-sheet结构分解破坏成Random结构和α-helix结构,使得β-sheet结构的相对百分含量发生下降,Random结构的相对百分含量发生明显上升。而且在老化前期,β-sheet结构的相对百分含量变化并不明显,说明在热老化初期,主要破坏排列不整齐结构疏松非结晶区,并未进攻到以β-sheet结构为主的结晶区[17]。由表2可见,在同样的老化时间内(24 h),140 ℃以上就会导致β-sheet结构的百分含量明显下降,Random结构的百分含量明显上升。将表1和表2中的β-sheet结构百分含量的变化数据进行综合比较后发现,当温度达到200 ℃的时候,24 h就已经开始破坏结晶区,导致β-sheet结构相对百分含量明显下降,破坏程度与柞蚕丝在80℃条件下老化30 d相似。说明热老化温度越高,柞蚕丝的老化速度越快,破坏结晶区的能力越强,导致其β-sheet结构相对百分含量下降得也越快。
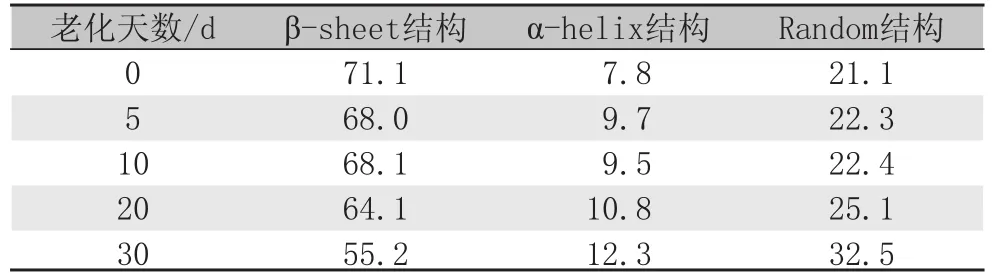
表1 80℃热老化柞蚕丝蛋白二级结构相对百分含量 %Tab.1 Percentages content of thermal aging tussah silk protein at 80 ℃

表2 热老化24 h柞蚕丝蛋白二级结构相对百分含量 %Tab.2 Percentages content of 24 h thermal aging tussah silk protein
通过FTIR二级结构分析可以看出,在一定的温度范围内,热老化会导致柞蚕丝β-sheet结构的百分含量下降,随时间延长,这种破坏更加明显。由于β-sheet结构在很大程度上组成了蚕丝纤维蛋白的结晶区域[18],那么若β-sheet结构的百分含量会发生变化,丝纤维的结晶度也会发生相应变化。
柞蚕丝在80 ℃条件下,随时间变化的XRD谱图如图4所示。从图4可以看出,柞蚕丝纤维蛋白特征衍射峰2θ=17.1,20.4, 24.5和34.4的吸收峰[19],随老化时间延长未发生明显变化,说明蚕丝蛋白的结晶种类未发生变化。但是,蚕丝纤维的特征吸收峰强度随时间延长发生了变化,说明样品的结晶度大小发生了变化。经过D/Max图形处理系统分峰后,柞蚕丝80 ℃老化样品结晶度分别为:41.9%(未老化),41.5%(5 d),40.7%(10 d),36.3%(20 d),30.9%(30 d)。表明随老化时间延长结晶度下降,在老化初期结晶度变化并不明显,10 d之后,柞蚕丝样品的结晶度开始比较明显地下降,说明热老化已经侵入到结晶区了。结晶度在10 d之后发生明显下降,说明β-sheet结构的百分含量也会下降,这与以上FTIR分析二级结构的结构是相符的。

图4 柞蚕丝80 ℃老化样品随时间变化XRD谱图Fig.4 X-ray diffraction patterns of the samples at 80 ℃ with time change
3 结 语
利用红外光谱技术分析了柞蚕丝热老化样品的二级结构变化,并且对部分样品进行了结晶度分析。结果表明在一定温度下,老化时间延长会导致柞蚕丝蛋白β-sheet结构的相对百分含量下降,而Random结构和α-helix结构的相对百分含量上升,经结晶度分析发现,上述变化在结晶度发生大幅度下降时表现得更明显;在一定时间内,老化温度越高,β-sheet结构的相对百分含量下降越明显,对蚕丝结构破坏的速度越快,破坏程度越大。
[1] 周静洁,林红,陈宇岳,等.热处理对桑蚕丝纤维结构与性能的影响[J].南通大学学报:自然科学版,2007,6(1):55-61.
[2] 武宜呜,安琳,朱文俊.热处理对天蚕丝结构与性能的影响[J].国际纺织导报,2010(1):26-28.
[3] SUSI H, BYLER D M.Protein structure by fourier transform infrared spectroscopy:second derivative spectra[J].Biochem Biophys Res Commun .1983, 115(1): 391-397.
[4] BYLER D M. SUSI H.Examination of the secondary structure of proteins by deconvolved FTIR spectra[J].Biopolymers.1986, 25(2): 469-487.
[5] GIULIANO F, PATRIZIA M, MASANOBU N. Structure and molecular conformation of tussah silk fi broin fi lms[J].Journal of Applied Polymer Science ,1997(35): 841-847.
[6] 陈华锋,龚德才,刘博.二阶导数二阶导数红外光谱分析辽代丝绸的降解特征[J].丝绸,2011,48(1):1-4.
[7] 王炳强.仪器分析-光谱与电化学分析技术[M].北京:化学工业出版社,2010:19-32.
[8] 高红艳,许强,杨志怀.FT-IR在研究蛋白质二级结构中的应用[J].宝鸡文理学院学报:自然科学版,2009,29(3):47-53.
[9] 周文,陈新,邵正中.红外和拉曼光谱用于对丝蛋白构象的研究[J].化学进展,2006,18(11):1514-1522.
[10] 郑今欢,邵建中,刘今强.蚕丝丝素纤维中氨基酸在丝素纤维的径向分布研究[J].高分子学报,2002(6):818-823.
[11] 张晓梅,原思训.老化丝织品的红外光谱分析研究[J].光谱学与光谱分析,2004,24(12):1528-1532.
[12] 张晓梅,黄洁,原思训.丝织品在老化过程中及老化后在水、乙醇、丙酮中的失重行为[J].文物保护与考古科学,2004,16(1):13-20.
[13] 卢雁,张玮玮,王公轲.FTIR用于变性蛋白质二级结构的研究进展[J].光谱学与光谱分析,2008,28(1):88-93.
[14] 张聚华,傅吉全,李秀艳.柞蚕丝织物水解老化过程的结构分析[J].北京服装学院学报:自然科学版,2010,31(2):28-35.
[15] GRIEBENOWA K, SHIOYA M. Characterization of microvoids in mulberry and tussah silk fibers using stannic acid treatment [J]. Journal of Applied Polymer Science ,1999(73):363-367.
[16] BYLER D, BROUILLETTE J.Quantitative studies of protein structure by FTIR spectra deconvolution and curve- fi tting[J].Spectroscopy, 1986,1(3):29-32.
[17] 王芳芳,傅吉全.柞蚕丝纤维人工加速老化损失研究[J].北京服装学院:自然科学版,2009,29(4):38-43.
[18] ZHOU C Z, CONFALONIER F, JACQUET M. Silk fi broin:structural implications of a remarkable amino acid sequence [J].Proteins,2001(4): 119-122.
[19] 张晓梅,原思训.利用X射线衍射光谱研究丝织品的老化[J].文物保护与考古科学,2010,30(1):262-265.
Effects of heat aging on the secondary structure of tussah silk protein
LI Huan-huan, FU Ji-quan
(School of Materials Science & Engineering, Beijing Institute of Fashion Technology, Beijing 10029, China)
With the technology of ATR-FTIR spectroscopy and the approaches of Fourier self-deconvolution fitting to calculate quantitatively the percentage of the secondary structure of protein, the effects of heat aging on the secondary structure of tussah silk protein was investigated in this paper, combined with the analysis of the crystallinity of tussah silk by X-ray diffraction. The results showed that: under certain temperature, the β-sheet structure of silk percentage content will decrease, while the percentage content of α-helix structure and Random structure will increase, with the prolonged aging; the higher of temperature, the faster of decrease of β-sheet structure percentage content, and the more obvious decline in crystallinity will occur.
Tussah silk; Heat aging; Fourier transform infrared spectroscopy; Secondary structure
TS102.332
A
1001-7003(2011)11-0008-04
2011-07-10;
2011-09-28
北京市教育委员会资金支持项目(KM20080012003)
李欢欢(1987- ),女,硕士研究生,研究方向为丝织品老化机理。通讯作者:傅吉全,教授,fujq010@sina.com。

