黑色素细胞与骨髓间充质干细胞复合构建组织工程化皮肤
宋可新,乔 群,刘大庆,王晓军,赵 茹,刘志飞,裴雪涛
1中国医学科学院 北京协和医学院 北京协和医院整形外科,北京100032
2军事医学科学院 野战输血研究所干细胞与再生医学研究室,北京100850
皮肤缺损创面修复是整形外科临床常见问题之一,组织工程皮肤的研发和应用为皮肤缺损修复提供了新的治疗策略。目前已有组织工程化的真皮和全层皮肤等产品上市,然而这些人工皮肤仅发挥遮盖创面和加速愈合的功能,无法起到色素调节、毛发生长、分泌汗液等重要功能。正常皮肤中含有黑色素细胞,它对于调节皮肤色泽以及防止紫外线照射引起细胞损伤起着重要作用。本研究在前期以骨髓间充质干细胞 (bone marrow mesenchymal stem cells,BMSCs)为种子细胞构建组织工程全层皮肤的研究基础[1]上,将黑色素细胞与BMSCs以适合的比例混合培养,并利用I型胶原膜为支架材料,构建含有色素细胞的组织工程化皮肤,以期为研发具有色素功能的组织工程化皮肤提供理论依据。
材料和方法
人黑色素细胞的分离、培养、传代及鉴定无菌条件下取包皮环切术后包皮组织 (标本由北京协和医院皮肤科激光中心提供,经患者知情同意,由北京协和医院伦理委员会审批通过),置于培养皿中,加入5 ml 2.5 g/L dispase酶中,4℃过夜后,仔细分离表皮、真皮层,剪碎表皮,加入5~10 ml 0.25%胰酶/0.02%EDTA,常温下用吸管反复吹打5 min;加入含有10%胎牛血清的L-DMEM,1200 r/min(r=17.01 cm)离心5 min,弃上清;PBS重悬,过200目筛网,1200 r/min(r=17.01 cm)离心5 min,弃上清;黑色素细胞完全培养基重悬,以5×105个细胞/ml接种于25 cm2培养瓶中,在37℃、5%CO2饱和湿度条件下培养;48~72 h后换液,加入黑色素细胞完全培养基 (HMGS-2+M254培养基,美国Cascade公司)继续培养,细胞培养至80%融合时,采用0.125%胰蛋白酶/0.01%EDTA消化传代。通过S-100蛋白的免疫组织化学染色及透射电镜观察对获取的黑色素细胞进行鉴定[2]。
BMSCs的分离、纯化、扩增与鉴定无菌条件下直接抽取健康志愿者骨髓 (捐献者均签署知情同意书,并经北京协和医院伦理委员会批准),BMSCs的分离、纯化及扩增参照侯玲玲等[3]的方法进行。采用S-100蛋白免疫组织化学染色进行鉴定。
混和细胞培养基的筛选
不同培养基对黑色素细胞增殖的影响:取长势良好的第3代黑色素细胞,0.125%胰蛋白酶/0.01%EDTA消化,1200 r/min(r=17.01 cm)离心5 min;PBS洗涤1次,1200 r/min(r=17.01 cm)离心5 min。分别用3组不同的培养基 (黑色素细胞完全培养基、BMSCs完全培养基、表皮细胞培养基)重悬细胞沉淀、计数,并调整细胞浓度为1.5×104个/ml。以每孔1.5×103个细胞接种于96孔板内,每板接种3组,每组8孔,并另设1个对照孔;分别用3组不同培养基在37℃、5%CO2饱和湿度条件下培养。分别于接种后第1~4天的相同时间取出1个孔板,观察细胞形态,换液后在每孔内加入10 μl细胞计数试剂盒-8(cell counting kit-8,CCK-8)试剂,将孔板放入孵箱中继续培养3.5 h。取出孔板,用酶标仪在450 nm波长处测定吸光度,参比波长为655 nm;计算平均吸光度值及标准差,绘制细胞增殖曲线。
不同培养基对BMSCs增殖的影响:取长势良好的第3代BMSCs,0.25%胰蛋白酶/0.02%EDTA消化,1200 r/min(r=17.01 cm)离心5 min,按照以上方法绘制细胞增殖曲线。
体外构建组织工程化皮肤,修复裸鼠创面
胶原膜的制备:取新鲜牛肌腱,按He等[1]的方法制备胶原膜。
黑色素细胞、BMSCs与胶原膜复合体外构建组织工程化皮肤:(1)将制备的胶原膜剪成直径2 cm大小,置于24孔板中进行钴源照射灭菌。(2)用含有10%FBS的DMEM培养液 (完全培养液)浸泡72 h,每天换液,并测量pH值至7.2~7.4为止。(3)消化第3代BMSCs,用BMSCs完全培养基重悬细胞,制成1×107个/ml的细胞悬液;取200 μl该浓度细胞悬液缓慢加到无菌胶原膜表面,在37℃、5%CO2饱和湿度条件下孵育4 h;待细胞紧密贴附在胶原膜表面,再加入1 ml完全培养液继续培养过夜。(4)消化第3代黑色素细胞,用黑色素细胞完全培养基重悬细胞,制成1×106个/ml的细胞悬液,按每5×106个细胞加入终浓度为5 μg/ml的DAPI,37℃孵育30 min,PBS反复洗涤,以去除未结合的DAPI荧光染料,即对黑色素细胞进行细胞核标记;吸出前一天24孔板中的BMSCs完全培养基,取200 μl该浓度细胞悬液缓慢加到无菌胶原膜表面,在37℃、5%CO2饱和湿度条件下孵育4 h;待细胞紧密贴附在胶原膜表面,再加入1 ml完全培养液继续培养过夜。
黑色素细胞、BMSCs在胶原膜上生长情况的电镜观察:用单纯黑色素细胞及BMSCs构建好的组织工程化皮肤在37℃、5%CO2饱和湿度条件下培养2 d后,用3%戊二醛固定后,经过脱水、环氧树脂浸透及包埋,进行修块、定位,制备成超薄切片后行扫描电镜观察。
组织工程化皮肤的免疫组织化学染色:取用单纯黑色素细胞及BMSCs构建好的组织工程化皮肤,在37℃、5%CO2饱和湿度条件下培养2 d后,切成0.5 mm×0.5 mm大小,OCT包埋剂浸没组织,置于-23℃ 恒冷冰冻切片机内,制成10 μm冰冻切片,然后进行S-100蛋白的免疫组织化学染色。
动物移植实验:将27只雄性CD1裸鼠 [北京维通利华实验动物技术有限公司、体重 (22±2)g]用3.5%水合氯醛麻醉后,于背部切取全层皮肤形成直径1.5 cm的圆形皮肤缺损创面,然后随机分为3组:(1)实验组:采用黑色素细胞和BMSCs混和与胶原膜复合构建的组织工程化皮肤修复皮肤缺损;(2)阳性对照组:单纯采用黑色素细胞与胶原膜复合构建的组织工程化皮肤修复皮肤缺损;(3)阴性对照组:单纯采用BMSCs与胶原膜复合构建的组织工程化皮肤修复皮肤缺损。术后外敷无菌纱布,用打包法进行缝合固定后单笼饲养。分别在创面修复术后第1、2、3周,每组随机抽取3只裸鼠切取创面中央直径0.5 cm范围的皮肤,分别进行透射电镜、免疫荧光、组织学检测。
结 果
人黑色素细胞的分离、培养、传代及鉴定结果原代细胞接种4 h后,可见细胞贴壁伸展,大部分细胞呈短梭型或卵圆形,第3天可见部分细胞呈典型的树突状,随培养时间的延长突起更加明显,并由多树突状向两极细长的长梭形发展,此时细胞密集,类似雪旺氏细胞 (图1A)。S-100蛋白免疫组织化学染色结果显示,人黑色素细胞的细胞核与细胞浆均呈棕褐色,细胞核染色更为明显 (图1B)。透射电镜观察细胞内除有内质网、线粒体、高尔基体等细胞器外,尚有特征性的黑色素小体 (图1C)。
BMSCs的S-100蛋白免疫组织化学染色结果可见BMSCs的胞浆和胞核无明显棕褐色染色,与阴性对照细胞 (成纤维细胞)和阴性对照试剂 (PBS)的结果相一致,是阴性结果,而与阳性对照细胞(黑色素细胞)的阳性结果明显不同 (图2)。
体外构建组织工程化皮肤的情况细胞悬液滴到胶原膜表面后即刻观察,可见圆球状细胞与胶原膜表面纤维贴附或渗透到胶原膜空隙中 (图3)。扫描电镜可见在胶原膜上种植的黑色素细胞紧密贴附于胶原膜表面,充分伸展,呈两极细尖的长梭形生长,生长状态良好,BMSCs也呈长梭形生长 (图4A、B)。S-100蛋白免疫组织化学染色可见单纯胶原膜上没有细胞生长,没有染色,只能看到屈曲缠绕的胶原纤维;单纯黑色素细胞与胶原膜复合构成的组织工程化皮肤则可见胶原纤维上有大量的细胞吸附,并且大部分细胞呈棕褐色染色;黑色素细胞和BMSCs混和与胶原膜复合构成的组织工程化皮肤可见细胞密集分布,只有少部分细胞呈棕褐色染色,大部分细胞未被染色 (图4C、D)
创面修复后的组织学观察
大体标本观察:术后第1周,3组裸鼠皮肤创面均未愈合,为肉芽创面,结有少许血痂。术后第2周,各组创面均开始愈合,阳性对照组创面相对较大,结的痂皮较厚;实验组创面面积最小,中心有少许薄层血痂,颜色比周围正常皮肤略暗;阴性对照组创面愈合程度居中,结有少许血痂。术后第3周,各组创面均完全愈合,阳性对照组仍有少量薄层血痂;实验组创面形成完整的皮肤,颜色比周围略暗;阴性对照组亦形成完整皮肤,表皮较薄,颜色略红 (图5)。
DAPI标记黑色素细胞的示踪观察:术后第1周,实验组裸鼠背部术区皮肤做冰冻切片,于荧光显微镜下观察,可见带有DAPI标记的细胞分布于表皮深层,同时也可以看到胶原膜材料自发的荧光;术后第2周,仍可见带有DAPI标记的细胞分布于表皮深层 (图6)。
HE染色:在修复创面术后第3周,可见各组均形成完整的表皮结构,实验组和阴性对照组与阳性对照组相比,表皮增厚,表皮层结构清楚,可见分化明显的基底层、棘层、颗粒层、角质层,基底层细胞排列紧密;真皮层可见瘢痕组织形成,表现为中性粒细胞减少,成纤维细胞增多,胶原纤维增多且排列有序。实验组和阴性对照两组无明显差异;人正常皮肤表皮更厚,各层细胞排列更有序,并且钉突明显,而裸鼠自身皮肤表皮层较薄,无明显的各层细胞排列 (图7)。
S-100蛋白免疫组织化学染色:阳性对照组和实验组表皮层下有棕褐色带状分布的细胞,与人正常皮肤组的结果相一致;而以PBS代替一抗的表皮下均无棕褐色带状细胞分布;阴性对照组与裸鼠正常皮肤,无论是S-100蛋白还是PBS代替一抗均无棕褐色带状细胞分布,为阴性结果 (图8)。
透射电镜观察结果:组织工程化皮肤组可见表皮细胞分层排列良好,细胞质中存在大量张力细丝,细胞间有明显的桥粒连接;表皮基底层细胞、黑色素细胞与基底膜存在半桥粒连接,黑色素细胞中可以观察到黑色素小体;真皮层可见较多成纤维细胞,其细胞周围可见有大量的胶原形成和沉积 (图9)。
讨 论
皮肤是人体最大器官,具有复杂的组织结构,并且含有毛囊、汗腺、皮脂腺等附属器官,发挥着重要的屏障保护、调节体温、生发等生理作用,目前已经上市的各种组织工程皮肤产品还只是起到覆盖皮肤缺损创面和加速创面愈合的功效,多数只是暂时的皮肤组织替代物;不仅其所具有的外形、韧性和机械性能等明显低于天然皮肤,没有正常皮肤的毛囊、血管、汗腺及黑色素细胞和朗格罕氏细胞等成分,而且在功能上,如皮肤的屏障功能、免疫功能、物质交换及能量交换等方面仍距正常皮肤有较大差距。
在前期研究工作中,笔者以自体BMSCs为种子细胞,利用BMSCs良好的增殖能力和多向诱导分化潜能,并且以具有良好生物学相容性和理化性状的牛源性I型胶原膜为支架材料,在体外成功构建了基于自体成体干细胞为种子细胞的组织工程化皮肤,分别移植入裸鼠和小型猪皮肤缺损处后,一方面有效封闭创面,加速了皮肤缺损处的创面愈合,另一方面,可以在实验动物体内形成了具有表皮和真皮不同组织层次的接近正常皮肤的结构,为构建具有完美生物学功能的组织工程化皮肤奠定了良好的实验基础[1]。在此基础上,本研究将分离纯化的黑色素细胞作为种子细胞,通过在体外以一定的比例和BMSCs混合培养,一同接种到I型胶原膜上构建含有色素细胞的组织工程化皮肤。S-100蛋白免疫组织化学染色结果显示,以人上睑皮肤组织作为阳性细胞对照,可以发现其在表皮下呈棕褐色带状分布;以裸鼠表皮为阴性对照,则未发现表皮有这种棕褐色带状分布的细胞;而本研究构建的组织工程化皮肤中人黑色素细胞在裸鼠体内的生长分布情况与人上睑皮肤的黑色素细胞类似,也是在表皮下呈棕褐色带状分布,说明笔者构建的组织工程化皮肤中的黑色素细胞在裸鼠体内已经成活,而且其生长分布也是正常的。DAPI的荧光标记示踪结果证实,裸鼠体内的黑色素细胞来源于人。

图9 实验组术后第3周创面皮肤透射电镜观察Fig 9 Observation of the skin of experimental group under transmission electron microscope 3 weeks after implantation
人正常皮肤组织在电镜下观察,黑色素细胞呈圆形或卵圆形,细胞基底面借半桥粒连于基板,顶部长而不规则的突起伸入基底层和棘层细胞之间,但不与之形成桥粒。胞核小,常染色质丰富,粗面内质网、高尔基复合体发达,核蛋白丰富,线粒体粗大,微管、中间丝和微丝延伸入树状突起中。该细胞最大特征是胞质内含有很多黑色素小体,它是黑色素在细胞内存在的形态,呈圆形或卵圆形,含酪氨酸酶,参与黑色素的形成,也是黑色素细胞向角质形成细胞输送黑色素的供体。本研究构建的组织工程化皮肤中的黑色素细胞中可以观察到上述结构,能够看到黑色素小体,且黑色素细胞通过半桥粒与基底膜相连接,提示本研究构建的组织工程化皮肤参与了创面的皮肤修复过程,生长良好,并且形成了具有功能性的结构。
BMSCs是多能成体干细胞,能够向不同的中胚层细胞分化,包括成骨细胞、成软骨细胞和脂肪细胞。虽然有争论,但也有研究表明其可以跨胚层分化,向非中胚层起源的肝细胞和神经元细胞或是各种上皮细胞分化[4-7]。但是目前认为,BMSCs在修复组织的过程中,其改变组织微环境的能力可能比分化转移的能力发挥更大的作用[8]。BMSCs可以分泌许多细胞因子,产生很多机制,包括促进含有的内源性干细胞样前体细胞的增生和分化[9-10],加强受损细胞的再生,诱导血管再生[11-12],抑止炎症和免疫反应[13],减轻细胞凋亡[14],转移线粒体[15]等。故在本研究并未着重追踪BMSCs的分布和分化情况,而主要观察其在组织中的实际修复功能。HE染色的组织学观察结果显示,实验组和阴性细胞对照组表皮层更厚,表皮细胞排列更有序,说明了其在组织修复过程中的良好作用。由于本研究的重点在于黑色素细胞的检测,同时也因为笔者在前期实验已经观察其统计学意义[1],所以在本研究中未对创面修复的实际效果做统计学观察和处理。
综上,本研究结果显示,用黑色素细胞和BMSCs混和与胶原膜构建的组织工程化皮肤在体内可以有很好的修复效果。在实际的组织修复中,黑色素细胞和BMSCs之间并没有抑制作用,二者可以很好的共存而共同发挥各自的作用。
[1]He L,Nan X,Wang Y,et al.Full-thickness tissue engineered skin constructed with autogenic bone marrow mesenchymal stem cells [J].Sci China C Life Sci,2007,50(4):429-437.
[2]刘源,金岩,王新文,等.构建含黑色素细胞组织工程皮肤的研究 [J].中国修复重建外科杂志,2003,17(6):501-503.
[3]侯玲玲,曹华,白慈贤,等.人骨髓间充质干细胞体外扩增和向神经细胞定向诱导分化的实验研究 [J].自然科学进展,2002,12(3):277-281.
[4]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow [J].Nature,2002,418(6893):41-49.
[5]Kogler G,Sensken S,Airey JA,et al.A new human somatic stem cell from placental cord blood with intrinsic pluripotent differentiation potential[J].J Exp Med,2004,200(2):123-135.
[6]Nakagawa H,Akita S,Fukui M,et al.Human mesenchymal stem cells successfully improve skin-substitute wound healing [J].Br J Dermatol,2005,153(1):29-36.
[7]Fu X,Fang L,Li X,et al.Enhanced wound-healing quality with bone marrow mesenchymal stem cells autografting after skin injury[J].Wound Repair Regen,2006,14(3):325-335.
[8]Prockop DJ.“Stemness”does not explain the repair of many tissues by mesenchymal stem/multipotent stromal cells(MSCs)[J].Clin Pharmacol Ther,2007,82(3):241-243.
[9]Crigler L,Robey RC,Asawachaicham A,et al.Human mesenchymal stem cell subpopulations express a variety of neuro-regulatory molecules and promote neuronal cell survival and neuritogenesis [J].Exp Neurol,2006,198(1):54-64.
[10]Munoz JR,Stoutenger BR,Robinson AP,et al.Human stem/progenitor cells from bone marrow promote neurogenesis of endogenous neural stem cells in the hippocampus of mice[J].Proc Natl Acad Sci USA,2005,102(50):18171-18176.
[11]Shyu KG,Wang BW,Hung HF,et al.Mesenchymal stem cells are superior to angiogenic growth factor genes for improving myocardial performance in the mouse model of acute myocardial infarction [J].J Biomed Sci,2006,13(1):47-58.
[12]Zwezdaryk KJ,Coffelt SB,Figueroa YG,et al.Erythropoietin,a hypoxia-regulated factor,elicits a pro-angiogenic program in human mesenchymal stem cells [J].Exp Hematol,2007,35(4):640-652.
[13]Zappia E,Casazza S,Pedemonte E,et al.Mesenchymal stem cells ameliorate experimental autoimmune encephalo-myelitis inducing T-cell anergy [J].Blood,2005,106(5):1755-1761.
[14]Hung SC,Pochampally RR,Chen SC,et al.Angiogenic effects of human multipotent stromal cells conditioned medium activate the PI3K-Akt pathway in hypoxic endothelial cells to inhibit apoptosis,increase survival,and stimulate angiogenesis [J].Stem Cells,2007,25(9):2363-2370.
[15]Spees JL,Olson SD,Whitney MJ,et al.Mitochondrial transfer between cells can rescue aerobic respiration [J].Proc Natl Acad Sci USA,2006,103(5):1283-1288.

图1 人黑色素细胞的鉴定Fig 1 Identification of human melanocytes

图2 BMSCs S-100蛋白的免疫组织化学染色 (×100)Fig 2 S-100 immunohistochemical stainning of BMSCs(×100)
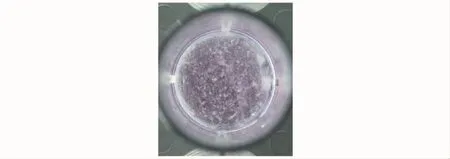
图3 黑色素细胞及BMSCs与胶原膜复合后的大体观察Fig 3 Gross observation of melanocytes and BMSCs on the collagen membrane

图4 黑色素细胞及BMSCs在胶原膜上生长观察Fig 4 Morphological observation of melanocytes and BMSCs on the collagen membrane
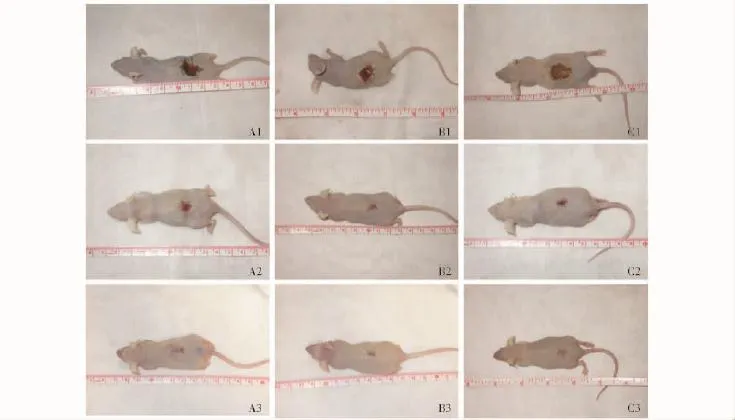
图5 裸鼠创面愈合的大体观察Fig 5 Gross observation of the nude mouse wound healing

图6 DAPI标记黑色素细胞的示踪观察 (×40)Fig 6 Tracing of DAPI-labeled melanocytes(×40)

图7 组织工程化皮肤修复皮肤缺损创面的HE染色 (×100)Fig 7 HE staining of the wound repaired by the tissue-engineered skin(×100)
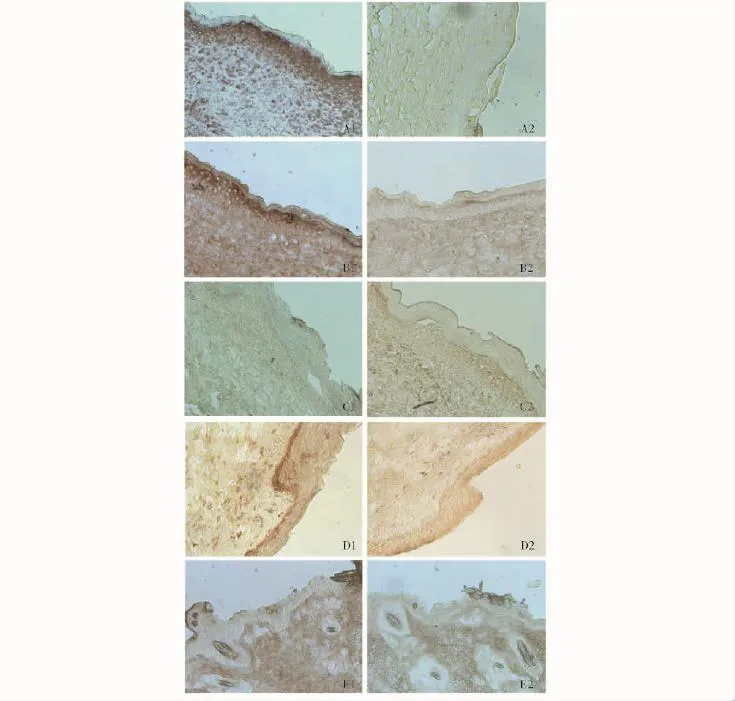
图8 组织工程化皮肤修复皮肤创面的S-100蛋白免疫组织化学染色 (×100)Fig 8 S-100 immunohistochemical staining of the wound repaired by the tissue-engineered skin(×100)

