雌激素制备大鼠子宫肌瘤动物模型
陈海刚,朱 兰,崔全才,郞景和,李 玢
中国医学科学院 北京协和医学院 北京协和医院 1妇产科 2病理科,北京100730
子宫肌瘤是女性生殖系统中最常见的一种良性肿瘤,多见于育龄女性,40~50岁妇女的发病率高达51%~60%,且呈逐年上升趋势,53%的妇女子宫切除的指征是子宫肌瘤[1]。但目前该病的病因和发病机制尚未清楚。子宫肌瘤动物模型的建立也处于研究阶段。本研究基于肌瘤对雌激素 (estrogen,E2)的高度敏感性以及E2在其发病机制中的重要地位[2-6],利用处于繁殖期的雌性大鼠,外源性给予E2,探讨不同剂量及给药周期对大鼠子宫肌瘤形成的影响,并与人子宫肌瘤进行病理组织学比较,探讨动物模型的最佳建立方法。
材料和方法
实验动物普通级 Sprague-Dawley大鼠60只(北京协和医院动物中心),雌性,未经生育交配,体重 (200±20)g。饲养条件:室温 (23±2)℃,相对湿度50%~70%,光照12 h,黑暗12 h,每笼5只。以清洁级维持鼠料和净化水饲养,自由饮水、自由摄食。所有动物抵达实验室后,驯化至少1周后用于实验。
E2诱导大鼠子宫肌瘤模型建立参照Fujii等[7]的方法建立E2诱导的大鼠子宫肌瘤模型。将60只大鼠随机分为3组,分别为200 μg模型组 (n=20),每只大鼠肌肉注射E2200 μg,每周2次;300 μg模型组(n=20),每只肌肉注射E2300 μg,每周2次;正常对照组 (n=20),肌肉注射生理盐水0.1 ml,每周2次。于实验8周和10周时分别处死动物每组各10只,将子宫完整剪下,观察子宫和肌瘤形态,计算肌瘤形成率和子宫脏器系数 (子宫重量/体重×100%),并将子宫固定于10%甲醛固定液中。
血清雌、孕激素水平分别于实验8周和10周于眶动脉取血1 ml,3000 r/min(r=10 cm)离心10 min分离血清,测定血清E2和孕激素 (progesterone,P)含量。
子宫病理组织学观察子宫组织经10%甲醛固定液固定48 h后以石蜡包埋,4 μm切片,HE染色。显微镜下观察染色切片,并与人子宫肌瘤病理切片进行比较。
子宫雌、孕激素受体表达免疫组织化学法测定子宫雌激素受体 (estrogen receptor,ER)及孕激素受体 (progesterone receptor,PR)的表达。抗ER多克隆抗体及抗PR多克隆抗体购自美国Santa Cruz公司,按试剂盒说明染色,组织切片中出现棕黄色颗粒着色即为ER和PR表达阳性。
统计学处理采用SPSS统计软件,结果以±s表示,两组间比较采用t检验,多组间比较采用F检验,定性资料采用χ2检验,P<0.05为差异有统计学意义。
结 果
不同给药剂量和周期对大鼠子宫肌瘤形成的影响对照组大鼠子宫质地均匀,未见结节或囊肿。两模型组大鼠于8周和10周时可见子宫形态改变、肌层增生,个别大鼠分角子宫可见肌壁间肌瘤、浆膜下肌瘤。200 μg组平均肌瘤形成率为30%,300 μg组平均肌瘤形成率为20%,均较对照组显著增加 (P<0.05)。不同剂量模型组8周及10周平均肌瘤形成率为25%。两模型组动物死亡率均为15%,高于对照组,但差异无统计学意义。不同剂量模型组10周的平均动物死亡率为30%,显著高于对照组 (P<0.05),而3组的8周动物死亡率皆为0。
E2对大鼠子宫重量和脏器系数的影响200 μg组大鼠的子宫重量和脏器系数与对照组相比差异无统计学意义。与对照组相比,300 μg组大鼠8周的子宫重量和脏器系数差异无统计学意义,但10周的子宫重量和脏器系数显著增加 (P<0.01)(表1)。
表1 雌激素对大鼠子宫重量和脏器系数的影响 (n=20,±s)Table 1 The changes in uterine weight and organ coefficient after estrogen injection(n=20,±s)
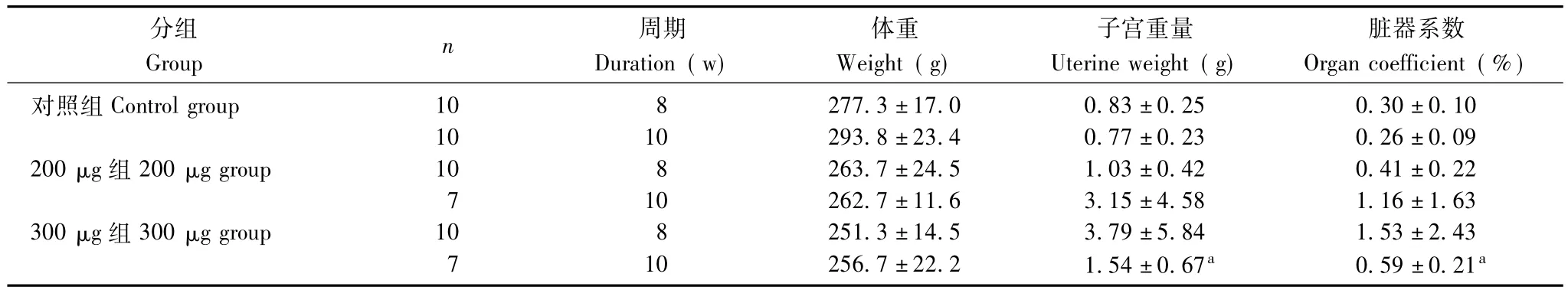
表1 雌激素对大鼠子宫重量和脏器系数的影响 (n=20,±s)Table 1 The changes in uterine weight and organ coefficient after estrogen injection(n=20,±s)
与对照组比较,aP<0.01aP<0.01 compared with control group
Group n 周期Duration(w)分组体重Weight(g)子宫重量Uterine weight(g)脏器系数Organ coefficient(%)对照组Control group 10 8 277.3±17.0 0.83±0.25 0.30±0.10 10 10 293.8±23.4 0.77±0.23 0.26±0.09 200 μg组 200 μg group 10 8 263.7±24.5 1.03±0.42 0.41±0.22 7 10 262.7±11.6 3.15±4.58 1.16±1.63 300 μg组 300 μg group 10 8 251.3±14.5 3.79±5.84 1.53±2.43 7 10 256.7±22.2 1.54±0.67a 0.59±0.21a
E2注射对大鼠血清E2、P水平的影响与对照组相比,两模型组的血清E2水平均显著升高 (P<0.01)。200 μg组的血清P水平与对照组相比差异无统计学意义 (P>0.05),而300 μg组的血清P水平显著低于对照组 (P<0.05)(表2)。
大鼠与人子宫肌瘤病理组织学特征对照组大鼠子宫肌壁厚度均匀,色泽淡红,未见结节或囊肿形成;模型组大鼠于8周和10周解剖时见明显增生,甚至出现肿块 (图1)。镜下观察似人的肌瘤表现 (图2)。
E2对大鼠子宫ER、PR表达的影响ER、PR
蛋白在子宫内膜组织、内膜下组织和肌层组织的胞浆内均可表达。免疫组化结果显示,所有标本均不同程度地表达ER、PR,阳性细胞表达部位均以细胞核着色为主。对照组子宫组织中,部分细胞胞浆内可见浅黄色ER、PR蛋白颗粒着色;两模型组子宫组织中大量细胞胞浆内均可见黄褐色的ER、PR蛋白颗粒着色,阳性细胞数明显多于对照组,且肌瘤组织中的阳性细胞数明显多于邻近正常平滑肌组织 (图3)。
讨 论
子宫肌瘤的发病原因复杂,目前普遍认为子宫肌瘤为性激素依赖性肿瘤,长期高水平卵巢激素的刺激是导致子宫肌瘤发生的重要致病因素[8]。本研究通过对雌性大鼠给予不同剂量和时间的E2,探讨通过E2给药建立子宫肌瘤动物模型的可行性。
本研究结果显示,模型组大部分大鼠的子宫均出现了较明显的平滑肌瘤样改变,并且在病理组织学上与人子宫肌瘤相似,而对照组大鼠的子宫在肉眼与镜下观察均无明显变化,提示模型建立成功。
本研究发现,外源性给予E2后,血清E2水平升高,子宫重量和脏器系数增加,部分大鼠形成子宫肌瘤,ER表达明显增强。此结果表明,子宫肌瘤具有明显的E2依赖性,E2可能是诱导子宫肌瘤形成的直接因素。
研究中分组给予大鼠 E2200 μg/只和 300 μg/只,200 μg组平均肌瘤形成率为30%,300 μg组平均肌瘤形成率为20%,差异无统计学意义。根据给药周期分析可见,给药8周和10周的肌瘤形成率均为25%,差异无统计学意义。此结果提示延长E2的作用时间或许并不能显著提高肌瘤形成率。在200~300 μg/只的给药剂量下,给药8周即可达到较好的肌瘤形成率。
在给药剂量为 200 μg/只和 300 μg/只时,10 周动物死亡率无差异,但高剂量组大鼠的死亡时间均早于低剂量组,提示E2诱导剂量可能与动物死亡率有关。这也可能是导致300 μg模型组肌瘤形成率低于200 μg模型组的原因。同时,10周时的动物死亡率显著高于8周,表明动物死亡率与E2给药周期可能存在正相关。综合评价,给药剂量为200 μg/只时可获得较好的存活率和肌瘤形成率。
由于肌瘤形成之前可能出现肌细胞肥大增生、胶原纤维增生活跃、子宫微小肌瘤等[9],仅通过病理组织学观察子宫肌瘤形成情况尚不能完全反映E2对子宫平滑肌细胞增生的促进作用,用子宫重量和脏器系数能够更加准确地评价E2的作用。数据分析可见,随着给药剂量增加、时间延长,大鼠子宫平滑肌细胞及纤维组织增生程度增加,子宫重量和脏器系数的增加均存在E2依赖性。
在E2连续给药后,大鼠体内E2水平持续升高,并且与给药时间和给药剂量都存在相关性。与之相反,P水平则呈下降趋势,考虑可能与体内性腺轴的反馈抑制有关。
E2是子宫肌瘤发生发展的主要因素,而目前关于P对子宫肌瘤的作用尚存在争议。部分观点认为,P能抑制子宫肌瘤生长,但近年来越来越多的研究发现P在肌瘤的发病中也起着重要作用[10]。大量临床实践证实,P能够抑制GnRH-a产生的E2不足和子宫肌瘤缩小的作用。应用P拮抗剂米非司酮可使肌瘤体积明显缩小[11],进一步说明了P在子宫肌瘤发病中具有重要作用。
表2 大鼠血清雌、孕激素水平 (n=20,±s)Table 2 The serum estrogen(E2)and progesterone(P)levels in the rats(n=20,±s)

表2 大鼠血清雌、孕激素水平 (n=20,±s)Table 2 The serum estrogen(E2)and progesterone(P)levels in the rats(n=20,±s)
与对照组比较,aP<0.05,bP<0.01aP <0.05,bP <0.01 compared with control group
Group n 周期Duration(w)分组E2P(pg/ml)(ng/ml)对照组Control group 10 8 110.94± 60.66 24.17±15.29 10 10 107.35± 48.11 19.56± 8.23 200 μg组 200 μg group 10 8 1068.87 ±201.98b 16.08 ±17.40 7 10 1204.33±159.06b 14.08± 6.53 300 μg组 300 μg group 10 8 1320.36 ±557.91b 10.07 ± 4.78a 7 10 1630.34±440.91b 11.25± 5.03a
本研究结果显示,给予外源性E2后,模型组动物在血清E2水平明显升高的同时,P水平降低;子宫增生、变形,并伴有肌瘤形成,模型组大鼠子宫组织中ER和PR的表达均明显强于对照组。说明外源性E2可抑制血清P水平,但可增强子宫PR的表达,与文献报道结果一致[12]。曾有研究报道[7],在模型开始建立时同时使用高剂量P和E2处理动物可抑制肌瘤形成。本研究结果进一步表明,血清中P的含量并非导致子宫肌瘤产生的必要因素,而局部组织中高浓度的ER、PR表达与子宫肌瘤的发生密切相关。
综上,使用性成熟的雌性大鼠,给予E2200 μg/只,2次/周,连续8周后可成功建立子宫肌瘤动物模型,其病理组织学特征与人子宫肌瘤相似,可用于子宫肌瘤发病机制研究和治疗药物筛选。
[1]Schwartz SM,Marshall LM,Baird DD.Epidemiologic contributions to understanding the etiology of uterine leiomyomata[J].Environ Health Perspect,2000,108 Suppl 5:821-827.
[2]Porter KB,Tsibris JC,Nicosia SV,et al.Estrogen-induced guinea pig model for uterine leiomyomas:do the ovaries protect[J]?Biol Reprod,1995,52(4):824-832.
[3]Walker CL,Hunter D,Everitt JI.Uterine leiomyoma in the Eker rat:a unique model for important diseases of women[J].Genes Chromosomes Cancer,2003,38(4):349-356.
[4]Mizutani T,Sugihara A,Nakamuro K,et al.Suppression of cell proliferation and induction of apoptosis in uterine leiomyoma by gonadotropin-releasing hormone agonist(leuprolide acetate)[J].J Clin Endocrinol Metab,1998,83(4):1253-1255.
[5]Brandon DD,Erickson TE,Keenan EJ,et al.Estrogen receptor gene expression in human uterine leiomyomata[J].J Clin Endocrinol Metab,1995,80(6):1876-1881.
[6]Chegini N,Verala J,Luo X,et al.Gene expression profile of leiomyoma and myometrium and the effect of gonadotropin releasing hormone analogue therapy[J].J Soc Gynecol Investig,2003,10(3):161-171.
[7]Fujii S,Nakashima N,Okamura H,et al.Progesterone-induced smooth muscle-like cells in the subperitoneal nodules produced by estrogen.Experimental approach to leiomyomatosis peritonealis disseminata [J].Am J Obstet Gynecol,1981,139(2):164-172.
[8]曹斌融.子宫体肿瘤 [M]//张惜阴.实用妇科学.2版.北京:人民卫生出版社,2003:651-657.
[9]Zbucka M,Miltyk W,Bielawski T,et al.Mechanism of collagen biosynthesis up-regulation in cultured leiomyoma cells[J].Folia Histochem Cytobiol,2007,45 Suppl 1:S181-S185.
[10]Maruo T,Ohara N,Wang J,et al.Sex steroidal regulation of uterine leiomyoma growth and apoptosis[J].Hum Reprod Update,2004,10(3):207-220.
[11]Engman M,Granberg S,Williams AR,et al.Mifepristone for treatment of uterine leiomyoma.a prospective randomized placebo controlled trial[J].Hum Reprod,2009,24(8):1870-1879.
[12]Englund K,Blanck A,Gustavsson I,et al.Sex steroid receptors in human myometrium and fibroids:changes during the menstrual cycle and gonadotropin-releasing hormone treatment[J].J Clin Endocrinol Metab,1998,83(11):4092-4096.
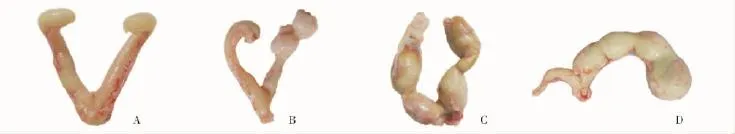
图1 大鼠子宫病理组织学变化Fig 1 The pathohistological changes of the uteri of the rats
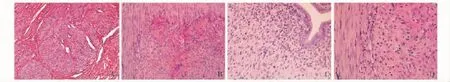
图2 大鼠与人子宫病理组织学比较 (HE)Fig 2 The histological comparison between human and rat uteri(HE)

图3 免疫组织化学染色测定子宫ER和PR表达 (×20)Fig 3 Investigations of the ER and PR in rats'uteri by immunohistochemical staining(×20)

