检测非霍奇金淋巴瘤患者外周血CD14+单核细胞组织因子和血管内皮生长因子的临床意义
王红霞,李秀梅,韩秀华,江亚军,朱贵华,庄万传
1徐州医学院附属连云港医院 (连云港市第一人民医院)病理科,江苏连云港222002
2蚌埠医学院附属连云港医院 (连云港市第二人民医院)血液科,江苏连云港222002
细胞炎症因子表达失调可能导致外周单核细胞激活及某些细胞表型改变,并参与恶性淋巴瘤的侵袭生长、浸润转移和血管新生等过程[1,2]。本研究采用流式细胞术检测非霍奇金淋巴瘤 (non-Hodgkin lymphoma,NHL)患者外周血CD14+单核细胞表面组织因子 (tissue factor,TF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达并分析两者与国际预后指数 (International Prognostic Index,IPI)及短期疗效间的潜在关系,旨在研究两者在NHL患者病情评估、预后评价以及短期疗效观察中的临床意义。
对象和方法
对象选择2004年10月至2010年3月在连云港市第二人民医院病理确诊的NHL患者47例作为病例组,男28例,女19例,年龄7~80岁,中位年龄46岁,平均 (46.3±17.3)岁;≤60岁34例,>60岁13例。B细胞性NHL 41例、T细胞性NHL 6例。
按照 Ann Arbor分期法[3],患者分为Ⅱ期 (6例)、Ⅲ期 (22例)和Ⅳ期组 (19例)。无全身症状的25例,有全身症状的22例。乳酸脱氢酶 (lactate dehydrogenase,LDH;正常参考值:110~246 U/L)正常者26例,升高者21例。依据美国东部肿瘤协作组 (Eastern Cooperative Oncology Group,ECOG)体力状态分级标准[4],患者可分为体力状态≤1级(35例)和≥2级组 (12例)。结外病灶数=1者31例、>1者16例。
健康体检者30例作为对照组,男19例,女11例,年龄11~77岁,中位年龄49岁,平均 (45.0±17.8)岁。
对照组和病例组在性别、年龄构成方面的差异无统计学意义 (P均>0.05),影响单核细胞功能的其他因素如自身免疫性疾病、伴发肿瘤、急慢性感染性疾病、血栓性疾病等均被排除。
化疗方案与疗效评价所有患者均常规化疗4周期,具体方案包括环磷酰胺+长春新碱+泼尼松(COP方案)21例次、环磷酰胺+多柔比星+长春新碱+泼尼松 (CHOP方案)106例次、环磷酰胺+米托蒽醌+长春新碱+泼尼松 (CMOP方案)16例次、CHOP+利妥昔单抗 (RCHOP方案)12例次、CHOP+依托泊苷 (CHOPE方案)23例次、环磷酰胺+多柔比星+长春新碱+地塞米松/甲氨蝶呤+阿糖胞苷 (Hyper-CVAD/MA方案)4例次、氟达拉滨+阿糖胞苷+粒细胞集落刺激因子 (FLAG方案)2例次。
参照文献 [5]判断临床疗效。完全缓解:临床及影像学上可检测到的病灶消失,症状消失且持续超过1个月;部分缓解:病灶最大直径及其最大垂直直径的乘积缩小≥50%,无新病灶且持续超过1个月;疾病稳定:病灶最大直径及其最大垂直直径的乘积缩小<50%或增大≤25%持续超过1个月;疾病进展:病灶最大直径及其最大垂直直径的乘积增大>25%或出现新病灶。4周期化疗结束后47例患者中,完全缓解20例、部分缓解16例、疾病稳定6例、疾病进展5例,其中完全缓解和部分缓解病例组成缓解组 (36例),疾病稳定和疾病进展病例组成未缓解组 (11例)。
IPIIPI评分依据美国国立综合癌症网络 (National Comprehensive Cancer Network,NCCN)评分标准[6]。根据年龄 (>60岁)、Ann Arbor分期 (Ⅲ/Ⅳ期)、LDH异常、体力状态 (2~4级)和结外病变数>1等5个预后危险因素将患者分为低危组(15例),低中危组 (14例),高中危组 (11例)和高危组 (7例)。
LDH测定清晨空腹采取静脉血2 ml置于无抗凝物的真空采血管中,1200 g离心10 min后分离血清。采用速率法检测血清LDH水平,仪器为美国强生公司VITROS950全自动干化学分析仪,试剂盒为LDH(L→P法)测定试剂盒 (购自上海荣盛生物技术有限公司)。
TF和VEGF测定分别于化疗前及化疗4周期后抽取肘静脉血2 ml,置于3.8%枸橼酸钠抗凝的真空采血管中,分别取20 μl全血至2个检测管中,其中对照管加入CD14-PerCP(购自美国R&D公司)、IgG1-FITC(购自美国BD公司)和IgG2a-PE(购自美国BD公司)各20 μl,测量管加入 CD14-PerCP、TF-FITC(购自AbD Serotec公司)和VEGF-PE(购自美国R&D公司)各20 μl。轻轻混匀后室温避光反应20 min后加入2 ml溶血素,振荡混匀后,避光反应10 min后加入2 ml PBS缓冲液洗涤,重复洗涤1次后加入200 μl PBS缓冲液悬浮细胞,于2 h内用FACSCalibur型流式细胞仪 (购自美国BD公司)进行检测,波长为488 nm,光源为功率15 mW的氩离子激光器。用CellQuest软件进行TF和VEGF表达百分率分析,每个样本检测1×104个细胞。
统计学处理采用SPSS 11.5统计软件,数据用均数±标准差表示,两组间比较采用t检验,多组间比较采用方差分析,两定量指标间相关性分析采用Pearson定量资料相关分析法,P<0.05表示差异有统计学意义。
结 果
NHL患者外周血CD14+单核细胞TF和VEGF表达病例组外周血CD14+单核细胞TF和VEGF表达显著高于对照组 (P均<0.01),TF和VEGF的表达呈正相关 (r=0.708,P=0.00)。≤60岁与>60岁患者外周血CD14+单核细胞TF和VEGF表达的差异无统计学意义 (P均>0.05)。具有预后危险因素患者外周血CD14+单核细胞TF和VEGF表达显著高于不具有预后危险因素者 (P均<0.05),Ann Arbor分期Ⅲ期和Ⅳ期患者比较两者表达的差异无统计学意义 (P均>0.05,表1)。
不同危险分层NHL患者外周血CD14+单核细胞TF和VEGF表达情况高中危组和高危组外周血CD14+单核细胞TF和VEGF表达显著高于较低危组和低中危组 (P均<0.01),高中危组和高危组比较两者表达的差异无统计学意义 (P均>0.05,表2)。
不同疗效NHL患者外周血CD14+单核细胞TF和VEGF表达情况化疗前未缓解组外周血CD14+单核细胞TF(45.66% ±9.17%比30.90% ±8.58%,P<0.01)和VEGF表达(48.28% ±6.13%比36.30% ±7.12%,P<0.01)显著高于缓解组。化疗后缓解组TF(22.48%±6.92%)和VEGF的表达 (24.30%±11.66%)较化疗前显著降低 (P均<0.01),但未缓解组TF(46.21%±8.99%)和VEGF的表达(51.25%±6.70%)与化疗前的差异无统计学意义 (P均>0.05)。
讨 论
TF广泛分布于各种组织细胞如单核细胞和肿瘤细胞等表面,在病理状态下由各种炎症介质诱导表达。TF通过MAPK等信号通路参与肿瘤生长、血管新生[7]、浸润转移等过程[8-11]。
本研究结果显示:NHL患者外周血CD14+单核细胞TF和VEGF表达明显上调,且TF和VEGF呈正相关关系,提示TF和VEGF可能协同参与NHL的发生发展过程。基础研究表明高表达TF的转染瘤细胞建立的实验性肿瘤组织血管丰富且伴VEGF转录增强,敲除TF胞内区后这一作用明显削弱[12,13],因此推测TF能上调NHL单核细胞表达VEGF,进而促使NHL形成新生血管,但是两者具体的作用机制有待进一步研究阐述。
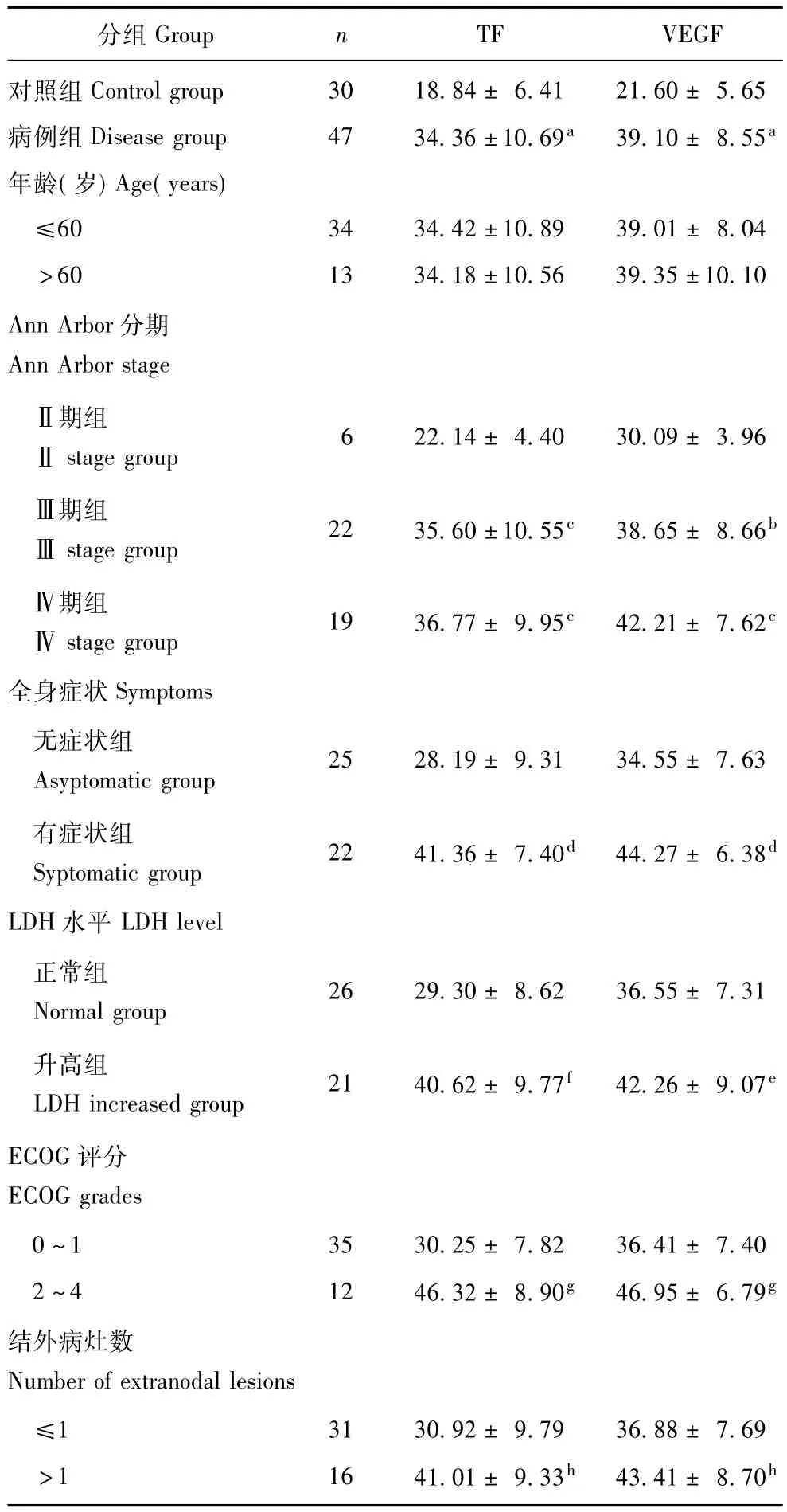
表1 对照组、病例组以及各病例亚组外周血CD14+单核细胞TF和VEGF表达水平 (x ± s,%)Table 1 Levels of TF and VEGF expressions on peripheral CD14+monocytes in control group,disease group and its subgroups(x ± s,%)
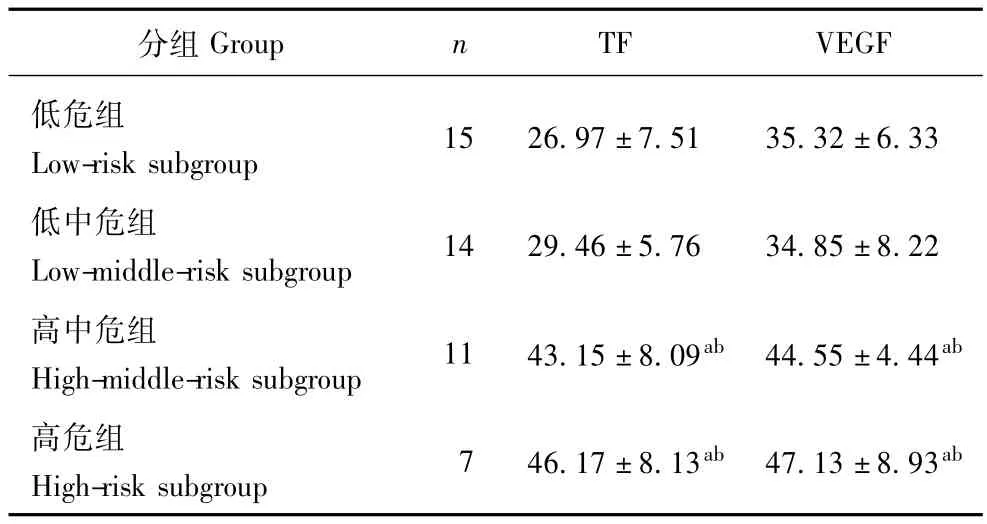
表2 不同危险分层NHL患者外周血CD14+单核细胞TF和VEGF表达水平 (x ± s,%)Table 2 Values of TF and VEGF expressions on peripheral CD14+monocytes in different risk stratification of NHL patients(x ± s,%)
本研究显示:NHL晚期播散患者单核细胞TF和VEGF表达明显高于早期局灶患者,提示单核细胞高表达TF和VEGF参与了NHL的浸润转移等过程。Nadir等[8]研究证实:高表达TF的肿瘤细胞转移能力显著增强,阻断TF受体功能后肿瘤细胞转移能力明显降低。Versteeg等[14]分别给严重联合免疫缺陷病小鼠注射高表达TF和低表达TF的黑色素瘤细胞,高表达TF小鼠大多数出现肿瘤转移灶,而低表达TF小鼠很少出现肿瘤转移灶。临床研究亦证实:TF表达水平与肿瘤分期分级、淋巴结转移、骨转移等特性显著相关[15,16]。
有全身症状、LDH升高及ECOG评分2~4级的NHL患者CD14+单核细胞TF和VEGF表达量显著高于无全身症状、LDH正常及ECOG评分0~1级者,提示NHL患者发热等全身症状以及体力下降可能与TF和VEGF的高表达有关。LDH增高NHL患者CD14+单核细胞TF和VEGF表达量显著高于LDH正常者,可能由于淋巴瘤细胞迅速生长过程中局部缺氧和营养消耗而引起肿瘤组织细胞坏死,释放LDH的同时伴有其他炎症细胞因子释放,后者进而激活单核细胞上调TF等的表达。
单因素和多因素回归分析证实患者年龄、LDH水平、体力状态、Ann Arbor分期和结外病灶数是影响NHL预后的重要因素[17]。本研究结果显示:高中危组和高危组外周血CD14+单核细胞TF和VEGF表达水平明显高于低危组和低中危组,提示CD14+单核细胞表达TF和VEGF与患者危险分期密切相关,可能是NHL患者的一个预后不良指标。Nitori等[15]研究表明:TF(-)的胰腺癌患者即使发生淋巴结转移,其预后仍较TF表达阳性的患者好,但是CD14+单核细胞TF和VEGF表达与NHL患者预后间的关系需要进一步研究证实。
全身化疗仍然是治疗淋巴瘤的重要手段,但是临床上即使是病理类型和临床分期相同的患者,采用相同的化疗方案,疗效也明显不相同。影响化疗效果的因素包括:血管生成能力和肿瘤细胞增殖活性等[18,19]。临床缓解病例化疗前 CD14+单核细胞TF和VEGF表达水平明显低于未缓解者,其可能与TF和VEGF促进微血栓形成、促进血管新生、增强侵袭力及抑制细胞凋亡等有关,但尚缺少充分的证据支持。化疗后缓解病例CD14+单核细胞TF和VEGF表达水平较化疗前明显降低,但未缓解病例化疗前后两者比较未见明显变化。上述结果提示:CD14+单核细胞表达TF和VEGF的水平高低可能是影响短期疗效的两个因素,即高表达TF和VEGF的患者对化疗的敏感性差。
综上所述,CD14+单核细胞可能通过高表达TF和VEGF共同参与NHL的侵袭浸润和血管新生等过程。外周血CD14+单核细胞TF和VEGF高表达可作为NHL病情评估、预后评价以及短期疗效观察的指标之一。
[1]应莉莎,朱欣,许沈华.恶性淋巴瘤患者TH 1/TH 2细胞因子表达水平的研究[J].中华微生物学和免疫学杂志,2008,28(12):1094-1098.
[2]Aldinucci D,Gloghini A,Pinto A,et al.The classical Hodgkin's lymphoma microenvironment and its role in promoting tumour growth and immune escape [J].J Pathol,2010,221(3):248-263.
[3]张之南,单渊东,李蓉生,等.协和血液病学 [M].北京:中国协和医科大学出版社,2004:475.
[4]苏卫,曹辉,王彦.吉西他滨联合顺铂治疗老年晚期恶性肿瘤的临床观察 [J].肿瘤防治研究,2008,35(5):355-357.
[5]Cheson BD,Horning SJ,Coiffier B,et al.Report of an international workshop to standardize response criteria for non-Hodgkin's lymphomas.NCI Sponsored International Working Group[J].J Clin Oncol,1999,17(4):1244-1253.
[6]Zelenetz AD,Abramson JS,Advani RH,et al.NCCN Clinical Practice Guidelines in Oncology:non-Hodgkin's lymphomas[J].J Natl Compr Canc Netw,2010,8(3):288-334.
[7]Dienst A,Grunow A,Unruh M,et al.Specific occlusion of murine and human tumor vasculature by VCAM-1-targeted recombinant fusion proteins [J].J Natl Cancer Inst,2005,97(10):733-747.
[8]Nadir Y,Brenner B,Zetser A,et al.Heparanase induces tissue factor expression in vascular endothelial and cancer cells[J].J Thromb Haemost,2006,4(11):2443-2451.
[9]Jiang X,Guo YL,Bromberg ME.Formation of tissue factorfactor VIIa-factor Xa complex prevents apoptosis in human breast cancer cells [J].Thromb Haemost,2006,96(2):196-201.
[10]Steffel J,Arnet C,Akhmedov A,et al.Histamine differentially interacts with tumor necrosis factor-alpha and thrombin in endothelial tissue factor induction:the role of c-Jun NH2-terminal kinase [J].J Thromb Haemost,2006,4(11):2452-2460.
[11]Cirillo P,Golino P,Calabrò P,et al.C-reactive protein induces tissue factor expression and promotes smooth muscle and endothelial cell proliferation [J].Cardiovasc Res,2005,68(1):47-55.
[12]Fernandez PM,Rickles FR.Tissue factor and angigogenesis in cancer[J].Curr Opin Hematol,2002,9(5):401-406.
[13]Belting M,Dorrell MI,Sandgren S,et al.Regulation of angiogenesis by tissue factor cytoplasmic domain signaling [J].Nat Med,2004,10(5):502-509.
[14]Versteeg HH,Spek CA,Peppelenbosch MP,et al.Tissue factor and cancer metastasis:the role of intracellular and extracellular signaling pathways [J].Mol Med,2004,10(1-6):6-11.
[15]Nitori N,Ino Y,Nakanishi Y,et al.Prognostic significance of tissue factor in pancreatic ductal adenocarcinoma[J].Clin Cancer Res,2005,11(7):2531-2539.
[16]Ohta S,Wada H,Nakazaki T,et al.Expression of tissue factor is associated with clinical features and angiogenesis in prostate cancer[J].Anticancer Res,2002,22(5):2991-2996.
[17]Shipp MA,Harrington DP,Anderson JR,et al.A predictive model for aggressive non-Hodgkin's lymphoma.The International Non-Hodgkin's Lymphoma Prognostic Factors Project[J].N Engl J Med,1993,329(14):987-994.
[18]罗加林,朱远.预测直肠癌术前同步放化疗敏感性的指示剂 [J].国际肿瘤学志,2008,35(6):458-461.
[19]唐成和,石太新,张文林,等.儿童急性白血病PCNA和P53及Bcl-2蛋白表达及其临床意义 [J].中国医师杂志,2005,7(7):887-889.

