恶性肿瘤患者化疗所致中性粒细胞减少与其疗效的相关性
沈 飞 茅力平 孙雅君
术后辅助化疗是恶性肿瘤手术后常用的治疗方案,中性粒细胞减少是细胞毒化疗药物的主要剂量限制性毒性。一些学者提出实体瘤化疗过程中出现骨髓抑制与患者远期疗效具有明显相关性,但关于恶性肿瘤术后化疗过程中出现适度中性粒细胞减少与患者无瘤生存期(diease-free survival time,DFS)的相关性,未见报道,我们对我院2006年1月~2010年12月收治的、136例术后辅助化疗恶性肿瘤患者的临床资料,进行回顾性研究,分析化疗过程中粒细胞减少与患者无瘤生存期的相关性,现报告如下。
1 资料与方法
1.1 临床资料
我们收集2006年1月~2010年12月我院收治的136例恶性肿瘤术后患者的临床资料,均经病理检查诊断,术后均具有化疗适应症;男性75例,女性61例;年龄17~80岁,平均年龄(54.07 ±11.21)岁;其中胃癌44例,大肠癌37例,肺癌15例,乳腺癌40例。按照国际抗癌联盟肿瘤TNM分期:Ⅱ期86例(63.3%),Ⅲ期50 例(36.8%)。
1.2 治疗方法
按照NCCN指南术后辅助化疗推荐方案及剂量。所有患者化疗前体力状况(ECOG)评分≤2分,预计生存期≥3个月;血常规、肝肾功能、心电图检查结果正常。
1.3 中性粒细胞减少分级
中性粒细胞(ANC)减少程度采用世界卫生组织(WHO)不良反应标准进行分级,以化疗过程中性粒细胞的最低值进行判定。据此将患者分为3组:无中性粒细胞减少组(A组),ANC≥2.0×109/L;中性粒细胞减少组(B 组),ANC(0.5~2.0)×109/L;中性粒细胞缺乏组(C 组),ANC < 0.5×109/L。
1.4 疗效观察及评价指标
疗效观察及评价指标为无瘤生存期(diease-free survival time,DFS),生存期以手术病理检查确诊日开始计算,至肿瘤复发日期或截止至2010年12月31日,以月为单位。
1.5 统计学分析
采用SPSSl5.0软件包进行统计分析,采用Kapln-Meier生存曲线和log-rank检验进行生存分析,组间差异比较采用t检验。
2 结果
2.1 一般资料(表1)
各组间患者年龄、性别、体力状况评分(ECOG评分),经统计学分析,无显著性差异(P>0.05)。

表1 各组患者的临床资料(例)
2.2 中性粒细胞减少与院内感染发生率关系 (表2)
A组(无中性粒细胞减少组)院内感染发生率与B组(中性粒细胞减少组)比较无显著性差异(P>0.05)。C组(中性粒细胞缺乏组)院内感染发生率分别与A组(无中性粒细胞减少组)和B组(中性粒细胞减少组)比较,均有显著性差异(P<0.05)。
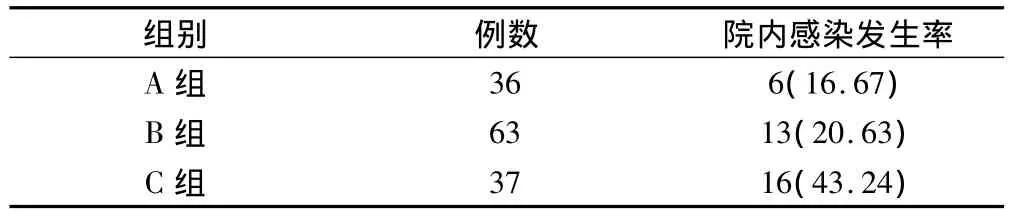
表2 各组院内感染发生率比较(例,%)
2.3 中性粒细胞减少与患者无瘤生存期的关系(图1)
A组(无中粒细胞减少组)无瘤生存期为(33.86±15.14)个月,B组(中粒细胞减少组)无瘤生存期为(42.50±12.39)个月,C 组(粒细胞缺乏组)无瘤生存期为(45.24±13.85)个月;B组与 A组比较,P=0.045;C组与A组比较,P=0.045;B组与C组比较,P=0.073,无显著性差异(P >0.05)。
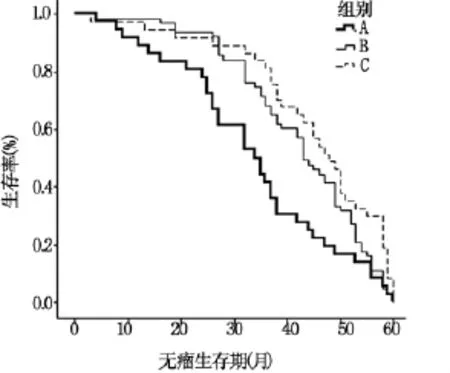
图1 3组无瘤生存期比较
3 讨论
肿瘤细胞对该药的敏感性和药物剂量是化疗是否有效的两个方面[1]。化疗所致的中性粒细胞减少与肿瘤干细胞的杀伤存在相关性,通过化疗所致的骨髓抑制可以一定程度上反映药物对肿瘤细胞的杀伤作用,存在个体差异,出现中性粒细胞降低的患者,化疗敏感性相对较高,也说明有足量的药物作用于肿瘤细胞,因而疗效较好,从而影响患者的 DFS[2,3],本研究结果提示,136例恶性肿瘤患者术后辅助化疗中,63例(46.32%)出现中性粒细胞减少,37 例(27.20%)出现中性粒细胞缺乏,与文献报道的相近[4],无中性粒细胞减少组和中性粒细胞减少/缺乏组DFS具有明显的差异,提示中性粒细胞减少/缺乏的出现与DFS具有明显的相关性。而中性粒细胞减少组和中性粒细胞缺乏组DFS无明显差异,可能与中性粒细胞缺乏后、增加院内感染的机会、甚至因严重感染难以控制而死亡、导致患者治疗的依从性降低、治疗的疗程和剂量发生改变有关[5]。
化疗药物的生物有效剂量存在个体差异,无中性粒细胞减少的患者用药量不足,没有达到药物的生物有效剂量[1],适度中性粒细胞减少可以延长DFS,所以根据药物毒性调整药物剂量[6]能否提高疗效还需要前瞻性研究进一步证实,实现用药剂量个体化,有望进一步提高化疗疗效,延长无瘤生存期。
[1]Di Maio M,Gridelli C,Gallo C,el al.Chemotherapy—induced neutropenia and treatment efficacy in advanced nonsmall-cell lung cancer:a pooled analysis of three randomised trials〔J〕.Lancet Oncol,2005,6(9):669.
[2]Rocconi RP,Matthows KS,Kemper M K,et a1.Chemotherapy—related myelesuppression a,S a marker of survival in epithelial ovariancancer patients〔J〕.Gynecol Oncol,2008,108(2):336.
[3]Wieha M S,Liu S,Dontu G.Caneer stem cells:an old idea,paradigm shift〔J〕.Cancer Res,2006,66(4):1883.
[4]Greil R.ESMO recommendations for the application of hematopoictic growth factors ChDFs〔J〕.Ann Oncol,2001,12(9):1219.
[5]刘 淑,郑玉龙,周黎阳,等.晚期非小细胞肺癌患者化疗骨髓抑制与生存相关性研究〔J〕.临床肺科杂志,2010,15(11):1544.
[6]Banelji U,Ashley S,Coward J,et al.The association of chemotherapy induced neutropenia on treatment outcomes in small cell lung cancer〔J〕.Lung Cance,2006,54(3):371.

