不同产地大花红景天有效成分的含量测定研究
黎代余,黄丽凤,陈鸿平,向楚兵,刘友平,*
(1.成都中医药大学药学院,四川成都611137;2.中药材标准化教育部重点实验室,四川成都611137)
不同产地大花红景天有效成分的含量测定研究
黎代余1,2,黄丽凤1,2,陈鸿平1,2,向楚兵1,2,刘友平1,2,*
(1.成都中医药大学药学院,四川成都611137;2.中药材标准化教育部重点实验室,四川成都611137)
目的:通过测定西藏、四川、云南三省大花红景天药材中红景天苷、多糖、多酚的含量,为合理开发利用大花红景天资源及建立大花红景天GAP基地提供理论依据。方法:采用HPLC测定红景天苷含量,硫酸-苯酚法测定多糖含量,三氯化铁-铁氰化钾法测定多酚含量。结果:西藏产大花红景天药材中红景天苷、多糖、多酚平均含量分别为:1.39%、4.83%、5.71%;四川产大花红景天药材中红景天苷、多糖、多酚平均含量分别为:1.32%、4.78%、5.56%;云南产大花红景天药材中红景天苷、多糖、多酚平均含量分别为:1.27%、4.76%、5.51%。结论:西藏产大花红景天药材质量最优,西藏最适宜大花红景天生长。
大花红景天,红景天苷,多糖,多酚,不同产地
大花红景天[Rhodiolcrenulata(Hook.f.et Thomx.)H.Ohba]来源于景天科(Crassulaceae)景天属(Rhodiola)植物,其具有悠久的药用历史,主要用于滋补元气,被誉为“高原人参”[1]。现代药理学研究表明,红景天中所含的红景天苷、多糖、多酚类成分具有抗疲劳、耐缺氧[2]、防放射[3-4]、抗病毒[5]、双向调节[6]、免疫调节[7]以及抗氧化等多种药理作用。我国大花红景天植物资源丰富,蕴藏量大[8-9],主要分布于西藏、四川、云南等广大的西部地区,具有很强的开发利用价值。本研究收集了西藏、四川、云南三省的大花红景天药材,并分别采用HPLC法、硫酸-苯酚法、三氯化铁-铁氰化钾法对红景天苷、多糖、多酚进行了含量测定,目的是为了合理开发利用我国的大花红景天资源,为我国大花红景天药材GAP基地建设及其相关医药工业生产提供理论依据。
1 材料与方法
1.1 材料与仪器
大花红景天药材 经四川大学王署教授鉴定为大花红景天[Rhodiol crenulata(Hook.f.et Thomx.)H.Ohba]的根和根茎;红景天苷对照品 批号:110818-200404,中国药品生物制品检定所;葡萄糖分析纯,成都化学试剂厂;乙腈 色谱纯,美国Fisher公司;磷酸 分析纯,成都金山化学试剂有限公司;浓盐酸、浓硫酸、苯酚、三氯化铁、铁氰化钾分析纯,成都科龙化工试剂厂;水 为蒸馏水;其他试剂 均为分析纯。
高效液相色谱仪(Shimadzu SPD-10aVP紫外检测仪)、CLASS-VP工作站 日本岛津;BP211D电子分析天平(十万分之一)、BP121S电子分析天平(万分之一) 德国Sartorius公司;BUG25-12超声仪上海必能信超声波有限公司;1100型分光光度计上海天美科学仪器有限公司。
1.2 实验方法
1.2.1 红景天苷的含量测定
1.2.1.1 色谱条件 色谱柱:HypersiL ODS(4.6mm× 200mm,5μm);流动相:乙腈∶水(8∶92);流速:1.0mL/ min;检测波长:275nm;柱温:30℃。
1.2.1.2 对照品溶液的配制 精密称取红景天苷对照品适量,加甲醇配制成含红景天苷0.545mg/mL的溶液,即得。
1.2.1.3 供试品溶液的制备 取本品粉末(过三号筛)约0.5g,精密称定,置具塞锥形瓶中,精密加入甲醇10mL,密塞,摇匀,称定重量,超声处理30min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,过滤,取续滤液,即得。
1.2.2 多糖的含量测定
1.2.2.1 5%苯酚试剂的配制 取苯酚100g,加铝片0.1g和NaHCO30.05g,蒸馏,收集182℃馏分,称取7.5g,加水150mL溶解,置棕色瓶内放冰箱备用。
1.2.2.2 对照品溶液制备 精密称取105℃干燥至恒重的葡萄糖标准品,加水配制成葡萄糖102.32μg/mL的溶液,即得。
1.2.2.3 样品溶液的制备 取大花红景天粉末2.5g(过3号筛),精密称定,置于圆底瓶中,加80%乙醇100mL回流提取1.5h,趁热过滤,药渣挥干,加蒸馏水100mL,回流1h,趁热过滤,用15mL热水洗涤烧瓶和药渣3次,待冷却后移入250mL容量瓶中,用蒸馏水定容,摇匀,即得样品溶液。
1.2.2.4 最大吸收波长的选择 分别精密吸取对照品溶液0.8mL、供试品溶液0.6mL置于具塞试管中,加水至1.0mL,再分别加入5%苯酚溶液1.6mL,摇匀,然后加浓 H2SO47.0mL,充分摇匀,室温放置25min。另取1.0mL水作同上平行操作,作为空白对照,在400~650nm之间扫描。
1.2.2.5 测定方法 红景天多糖的精制:取大花红景天药材粉末100g,依次用250mL石油醚(60~90℃)、乙醚回流1.5h,取过滤后的残渣,挥干溶剂;加入250mL 80%的乙醇回流1.5h,取过滤后的残渣,挥干溶剂;加5倍量蒸馏水回流提取2次,每次1.5h,抽滤,合并滤液,减压浓缩至一定体积,浓缩液加入等量的Sevag试剂除蛋白,反复进行5次;取上层液加无水乙醇使其含醇量达到80%,置于4℃冰箱中静置过夜,再离心分离(4000r/min,10min),沉淀依次用无水乙醇、丙酮反复洗涤5次,于50℃减压干燥至恒重,即得精制红景天多糖。
换算因素的测定:精密称取60℃干燥至恒重的大花红景天多糖21.03mg置于100mL容量瓶中,用蒸馏水稀释至刻度,摇匀,即可。精密吸取0.6mL,按照“1.2.2.4”项操作,在所选定的最大波长处测定吸光度。按照下面公式计算换算因素f:
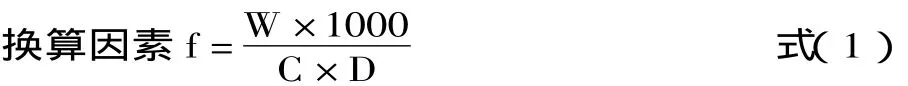
式中:W-称取多糖的重量,μg;C-溶液中多糖液中葡萄糖单糖的重量,μg;D-多糖的稀释倍数。计算得f=2.14。
样品测定:精密吸取样品溶液 0.6mL,按照“1.2.2.4”中方法在所选定的最大波长处测定吸光度。按照下面公式计算样品中红景天多糖的含量:
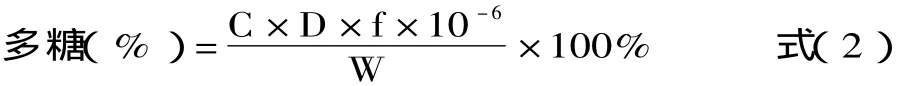
式中:C-样品提取液中按标准曲线计算出的葡萄糖的量,μg;D-多糖的稀释倍数;f-换算因素;W-样品重量,g。
1.2.3 多酚的含量测定
1.2.3.1 对照品溶液的制备 精密称取没食子酸对照品,加入丙酮∶水(1∶1)配制成没食子酸50μg/mL的溶液,即得。
1.2.3.2 供试品溶液的制备 取大花红景天粉末0.5g,精密称量,加入80mL丙酮∶水(1∶1),置水浴中微沸浸提30min后,趁热抽滤,冷却后定容至100mL。
1.2.3.3 最大吸收波长的选择 分别精密吸取没食子酸对照品溶液0.5mL、供试品溶液0.6mL置于25mL量瓶中,依次加入0.100mol/L三氯化铁溶液0.5mL、0.008mol/L铁氰化钾溶液0.5mL和0.10mol/L盐酸溶液0.5mL,定容,同时在25mL量瓶中加入0.100mol/L三氯化铁溶液0.5mL、0.008mol/L铁氰化钾溶液0.5mL和0.10mol/L盐酸溶液0.5mL,定容后得到空白溶液,在600~900nm之间扫描。
2 结果与讨论
2.1 红景天苷测定结果
2.1.1 线性关系的考察 分别精密量取对照品溶液2.5、5、10、12.5、15μL注入液相色谱仪,按前述色谱条件分别测定其峰面积。以对照品含量(C)为横坐标,峰面积积分值(A)为纵坐标,绘制标准曲线。计算得回归方程和相关系数见表1。
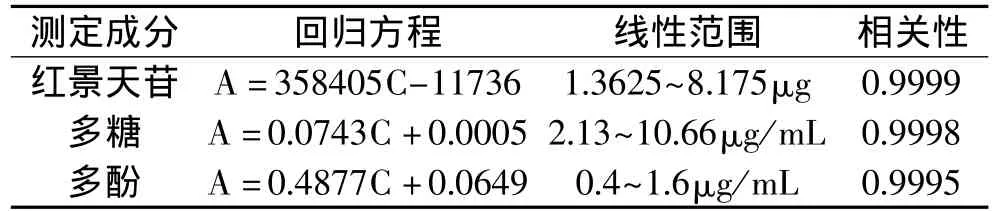
表1 红景天苷、多糖、多酚的回归方程
2.1.2 精密度实验 精密吸取红景天苷对照品溶液10μL,重复进样测定3次,结果红景天苷平均峰面积分别为 1160245、1159862、1200973,RSD分别为0.43%、0.98%、0.64%。
2.1.3 稳定性实验 取红景天苷标准溶液2mL放置,分别在0、1、2、4、8、16h测定峰面积,进样量10μL。测得峰面积的平均值为 1156785,RSD为0.67%。
2.1.4 重现性实验 取大花红景天样品5份,每份0.5g,精密称定,按供试品溶液制备方法制备供试品溶液后测定,进样量10μL,测得红景天苷的平均含量为1.34%,RSD为0.60%。
2.1.5 加样回收实验 取已知红景天苷含量的大花红景天样品5份,每份0.25g,精密称定后,精密加入红景天苷对照品溶液4mg,按供试品溶液制备方法制备供试品溶液后测定,进样量10μL,计算得回收率为101.4%,RSD为2.27%。
2.1.6 药材含量测定 称取大花红景天样品10份,每份0.5g,精密称定,按供试品溶液制备方法制备供试品溶液。分别精密吸取供试品溶液各10μL,注入液相色谱仪,测定,计算红景天苷含量。10批大花红景天药材红景天苷含量见表2,图1。
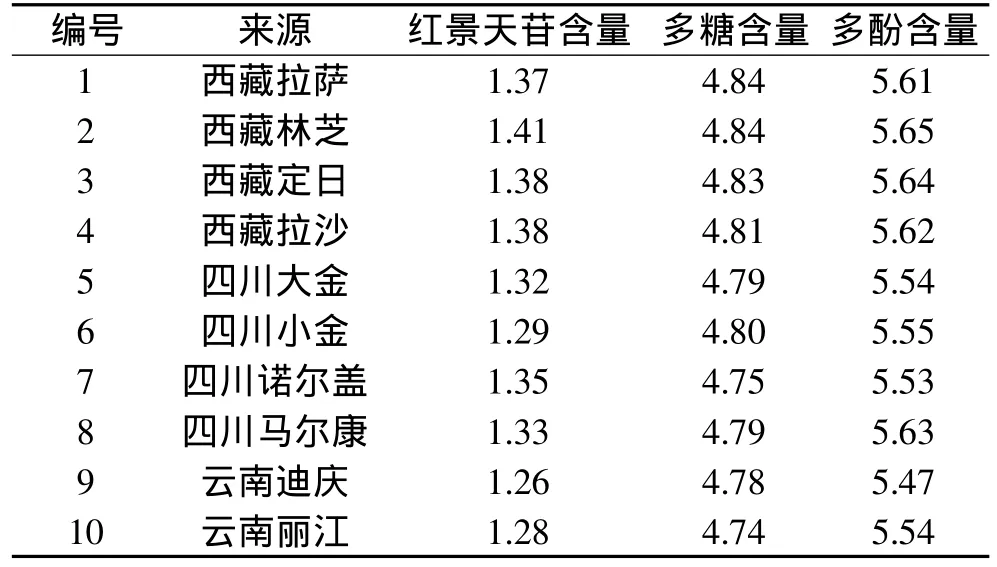
表2 10批大花红景天药材红景天苷、多糖、多酚含量结果(%,n=3)
图1 HPLC色谱图
2.2 红景天多糖的测定结果
2.2.1 最大吸收波长的选择 结果表明,对照品溶液和供试品溶液在486nm处有最大吸收峰,故选择486nm作为测定波长。
2.2.2 标准曲线的制备 精密移取对照品溶液0.2、0.4、0.6、0.8、1.0mL分别置具塞试管中,按“1.2.2.4”项下操作,在486nm处测定吸光度。以吸光度(A)为纵坐标,浓度(C)为横坐标,绘制标准曲线,得回归方程和相关系数见表1。
2.2.3 精密度实验 取葡萄糖对照品溶液0.6mL,按“1.2.2.4”项下操作,在486nm处测定吸光度,重复测定5次。结果吸光度分别为 0.481、0.479、0.486、0.479、0.483,RSD为0.30%。
2.2.4 稳定性实验 取葡萄糖标准溶液0.6mL,按“1.2.2.4”项下操作,在486nm处测定吸光度。在0、 10、30、60、120、240min测定,其吸光度分别为:0.477、0.481、0.479、0.474、0.485、0.480,RSD为0.37%。
2.2.5 重复性实验 取大花红景天同一样品5份,每份2.5g,分别精密称定,按照“1.2.2.4”项下操作,在486nm处测定吸光度。结果所测样品平均含量为4.83%,RSD为1.44%。
2.2.6 加样回收实验 取已知多糖含量的药材5份,每份约0.25g,精密称定,分别精密加入红景天多糖12mg,按照样品溶液制备方法制备样品,按照“1.2.2.4”项下方法,在486nm处测定吸光度,并以葡萄糖对照品溶液作对比测定。测得平均回收率为98.6%,RSD为1.15%。
2.2.7 药材样品测定 取各大花红景天药材样品粉末各2.5g,精密称定,加水至1.0mL,再分别加入5%苯酚溶液1.6mL,摇匀,然后加浓H2SO47.0mL,充分摇匀,室温放置25min,以相应试剂为空白,在486nm处测定吸收度,并计算其含量,测定结果见表2。
2.3 多酚的含量测定结果
2.3.1 最大吸收波长的选择 结果表明,对照品溶液和供试品溶液在738nm处有最大吸收峰,故选择738nm作为测定波长。
2.3.2 标准曲线的制备 精密移取对照品溶液0.2、0.3、0.4、0.5、0.6、0.7、0.8mL分别置于25mL容量瓶中,按照“1.2.3.3”项下方法,在738nm处测定吸光度。以吸光度(A)为纵坐标,浓度(C)为横坐标,绘制标准曲线,得回归方程和相关系数见表1。
2.3.3 精密度实验 取同一份没食子酸对照品溶液,按照“1.2.3.3”项下方法,在738nm处测定吸光度,重复测定6次。吸光度分别为:0.561、0.562、0.561、0.559、0.564、0.562,RSD为0.17%。
2.3.4 稳定性实验 取没食子酸标准溶液0.5mL,按“1.2.3.3”操作显色,在 738nm处测定吸光度,每30min测定一次吸光度。吸光度分别为:0.567、0.561、0.565、0.558、0.560、0.566,RSD为0.37%。表明在3h内吸光度基本保持恒定,稳定性良好。
2.3.5 重复性实验 取大花红景天同一样品5份,每份0.5g,分别精密称定,按照“1.2.3.3”方法操作测定,在738nm处测定吸光度。所测样品平均含量为5.55%,RSD为1.44%,表明供试品重复性良好。
2.3.6 加样回收实验 取已知多酚含量的药材5份,每份约0.1g,精密称定,分别精密加入没食子酸5.6mg,按照样品溶液制备方法制备样品,按照“1.2.3.3”项下方法,在486nm处测定吸光度,并以葡萄糖对照品溶液作对比测定。测得平均回收率为96.1%,RSD为3.81%。
2.3.7 药材样品测定 取各大花红景天药材样品粉末各0.5g,精密称定,按照“1.2.3.3”方法操作,测定,以相应试剂为空白,在738nm处测定吸收度,并计算其含量,测定结果见表2。
3 讨论
大花红景天植物在我国集中地分布在西南和西北地区,其中,以西藏地区产量最大[8],根据文献记载,红景天易受地形、地貌、土壤、气候等各种自然条件影响,其分布与海拔高度有密切关系,多数种红景天都分布在海拔2500~5000m之间,有些种分布高度达5000m以上,1700m以下几乎没有红景天分布。从实验结果看,三省的大花红景天药材红景天苷含量均高于《中国药典》2005年版一部中规定的红景天苷含量(≥0.5%),但是,西藏所产的大花红景天药材中红景天苷、多糖、多酚类成分的含量较四川、云南的高,而且成分稳定,这可能与西藏地区海拔高度密切相关。而四川大花红景天产地与西藏海拔高度、气候条件相似,其大花红景天药材中的红景天苷、多糖、多酚类成分的含量与西藏大花红景天中的含量相近。由此可见,西藏是大花红景天药材最适宜的生长区。
[1]江林波.高原人参红景天[J].餐饮世界,2005(9).
[2]佟力,席军.红景天苷的药理作用研究进展[J].中外医疗,2008,27:135-137.
[3]骆传环,高月,王作华,等.红景天多糖的抗放实验研究[J].中国放射医学与防护杂志,1994,14(5):340-341.
[4]骆传环,舒融,高月.高山植物红景天抗疲劳抗辐射的实验研究[J].现代应用药学,1996,13(4):5-7.
[5]孙非,王秀清,许守民,等.高山红景天多糖对小鼠抗柯萨奇B6病毒感染能力的研究[J].中华实验和临床病毒杂志,1995,9(4):361-363.
[6]李西林,南艺蕾.红景天多糖的化学药理研究进展[J].中国中医药信息杂志,2006,13(3):109-111.
[7]张汝学.红景天多糖对小鼠体内脾淋巴细胞转化反应及NK细胞活性的影响[J].中国药理学通报,1993,9(4):278-280.
[8]熊先荣.西藏红景天资源调查[J].华西药学杂志,1995,10(3):187-188.
[9]贺俊生,白马群增,康中林.藏东地区大花红景天资源调查[J].西藏医药杂志,1995,16(4):45-46.
Determination of the active ingredient content of Rhodiola crenulata in different origins
LI Dai-yu1,2,HUANG Li-feng1,2,CHEN Hong-ping1,2,XIANG Chu-bing1,2,LIU You-ping1,2,*
(1.College of Chinese Materia Medica,Chengdu University of Traditional Chinese Medicine and Chinese Materia Medica,Chengdu 611137,China;2.Chinese Medicinal Standardization Lab,Chengdu 611137,China)
Objective:To provide a basis for development and to establish GAP base of Rhodiola crenulata resources,the contents of salidroside,polysaccharide,polyphenol of Rhodiola crenulata in Tibet,Sichuan and Yunnan provinces were determined.Methods:The content of salidroside,polysaccharide and polyphenol were determined by HPLC,sulfuric acid-phenol method and ferric chloride-potassium ferricyanide method,respectively.Results:The average concentrations of glycosides,polysaccharides and polyphenols of Rhodiola crenulata in Tibet were:1.39%,4.83%,5.71%.The average concentrations of glycosides,polysaccharides and polyphenols of Rhodiola crenulata in Sichuan province were:1.32%,4.78%,5.56%.The average concentrations of glycosides,polysaccharides and polyphenols of Rhodiola crenulata in Yunnan province were:1.27%,4.76%,5.51%.Conclusions:The best quality ingredient was the Rhodiola crenulata in Tibet,and the most suitable place for the growth of Rhodiola crenulata was Tibet.
Rhodiola crenulata;glycosides;polysaccharides;polyphenols;different origins
TS207.3
A
1002-0306(2011)02-0347-04
2009-11-09 *通讯联系人
黎代余(1983-),男,在读研究生,研究方向:中药化学成分与质量标准化研究。
“十一五”国家科技支撑计划项目(2006BAI06A14-10);质检公益项目(2007GYB215)。

