两例鸭禽霍乱的诊断试验
孟宇航 邓书 李光华 (山东省即墨市畜牧兽医局 266200 青岛诚誉食品检测有限公司)
两例鸭禽霍乱的诊断试验
孟宇航①邓书②李光华①(①山东省即墨市畜牧兽医局 266200 ②青岛诚誉食品检测有限公司)
本试验依据家禽(畜)流行病诊断的基本原理和方法,通过试验临床症状观察和病理解剖观察到的特征性病理变化,作出初步诊断;再进行实验室的病原生物学检查,病原的分离与纯化,动物回归试验和生化试验作出确诊,并以药敏试验的结果为依据提出治疗本病的合理治疗方案,以防止因菌株对所使用药物产生的耐药性而影响治疗效果。
禽霍乱 巴氏杆菌 生物学检查
随着人民生活水平的提高和对畜产品需求量的不断增加,集约化养殖业的发展也愈来愈迅速。但是在发展集约化规模养殖的过程中,各种传染病的危害也愈来愈严重。本试验结合当前养禽业面临的实际问题,主要研究鸭禽霍乱的诊断,对实际工作进行正确诊断具有一定的参考意义。
禽霍乱的流行特点是对各种家禽包括鸡、鸭、鹅和火鸡都有易感性。在鸭群中常呈流行性,1月龄以内雏鸭发病率和死亡率均高,而成鸭则较低。病禽和带菌禽是本病的传染源。病禽的各种脏器、分泌物、排泄物,以及被其污染的饲料、饮水、场地、用具,各种动物、人和机械,某些昆虫、寄生虫等都可以是本病的传播媒介。禽舍不洁、潮湿拥挤、气候突变、饲养失调、长途运输和患寄生虫病等均可诱发本病流行[1,2]。
1 材料与方法
1.1 材料
1.1.1 实验动物、器材 试验用鸭:共2组,取自即墨周边地区养殖场(户);家兔:3只,购自即墨;高压锅,37℃恒温箱,4℃冰箱,酒精灯,试管,玻片,培养皿,酒精棉球,碘酒,剪子等。
1.1.2 试剂 基础培养基原料:牛肉膏,蛋白胨,氯化钠,琼脂,蒸馏水[3],犊牛血清
1.2 试验准备
(1)清洗20副培养皿,一个20 ml的针筒,一支16号针头,用洁净报纸包好后高压蒸汽灭菌(121℃,15min),待用。(2)购家兔2只。(3)基础培养基的制备。(4)鲜血琼脂平板的制备。预先将经高压蒸汽灭菌的平皿,酒精灯放入细菌实验专用操作柜作柜中;再将已冷却的基础培养基加热融化并冷却至50℃,以无菌操作法取家兔心血20ml注入基础培养基溶液中,在细菌实验专用操作柜作柜中摇匀并以无菌方法迅速倒平板;待鲜血平板冷却后,将其倒置平放于37℃温箱中培养24h,观察,无细菌生长,说明鲜血平板未被污染,可继续用于巴氏杆菌的分离与纯化试验。平板从温箱中取出后置于4℃冰箱中待用。
1.3 操作方法
1.3.1 病理解剖 将疑似禽霍乱病鸭(共2组, 已死亡)做病理解剖,仔细检查各内脏器官的病理变化。
1.3.2 涂片镜检 病理解剖后,各取一小片肝脏和心脏触片,分别用瑞士染色法和革兰氏染色法染色后观察细菌的形态结构和染色特性。
1.3.3 细菌的分离与纯化 分别自第1,2组病鸭的肝脏挑取细菌接种于鲜血琼脂平板,置37℃温箱中培养24h,观察细菌生长情况。在长出菌落的培养基中,挑取半个菌落抹片,用革兰氏染色和瑞士染色法染色后观察细菌的形态结构和染色特性。
1.3.4 动物试验 (1)将取自第1组病料的细菌纯培养物接种血清肉汤,于37℃温箱中培养24h后,给家兔注射0.5ml,观察24~48h。(2)将取自第2组病鸭的肝脏,取一片捣碎后加生理盐水制成悬液,静置后取上清液1ml注射家兔,观察24~48h。(3)将1ml生理盐水注射阴性对照家兔,观察24~48h。(4)对动物试验中死亡的家兔进行病理解剖,并取病变部位材料涂片镜检。
1.3.5 药敏实验 (1)血清肉汤培养基的制备:先配制50ml肉汤培养基。高压灭菌后,以10:1的比例加入5ml犊牛血清。在微生物实验专用操作柜中以无菌方法分装试管,共分装6支试管。(2)接种血清肉汤:从两组病料接种的鲜血琼脂平板上挑取单个菌落,分别接种3支血清肉汤试管。(3)将接种好的血清肉汤培养基置于37℃温箱中培养24h。(4)药敏试验:以无菌棉球蘸取血清肉汤培养物均匀涂抹于鲜血琼脂平板上,分别在每个平板中放入5个药敏片,置于37℃温箱中培养24h并观察结果。
1.3.6 生化试验 以无菌操作方法,挑取单一菌落分别接种于如下微量生化试管:过氧化氢酶、氧化酶、尿素、甘露醇。观察并记录结果。
2 试验结果
2.1 试验观察记录
2.1.1 病理变化 病理特征有:冠、肉垂黑紫色,胸肌和胸浆膜散在出血点。心包积多量浆液,心外膜出血明显。肝肿胀、棕黄色、质脆,散在大量的灰白色坏死点。肺有点状出血和暗红色肝变区。十二指肠呈严重的出血性炎症变化,肠腔扩张,浆膜血管明显,并见出血斑点;肠内容物血样、粥状;黏膜高度充血、出血。
2.1.2 镜检结果 分别取第1、2组病鸭的肝脏、心脏触片,用瑞士染色法染色后,观察到大量两极浓染、中部略空的球杆状细菌。做革兰氏染色后观察到大量革兰氏阴性杆菌。
2.1.3 分离培养结果 两组病料接种的鲜血平板上均长出水滴样小菌落,无溶血现象。挑取单个菌落抹片后作瑞士染色和革兰氏染色,观察到两极浓染的革兰氏阴性球杆菌。
2.1.4 动物试验结果 第1组死亡;第2组死亡;阴性对照组存活。
对死亡的家兔作病理解剖,均可观察到肝脏有大量灰色坏死点,取一小片肝脏触片镜检,观察到两极浓染的革兰氏阴性球杆菌。
2.1.5 生化试验结果 (见表1)

表1 生化试验结果
2.1.6 药敏试验结果 (见表2)
2.2 诊断结论
(1)从病理解剖的结果看,各病变特征均符合禽霍乱的病理要求,其特征性病变有肝脏有灰白色针尖状小点,据此可以初步诊断为禽霍乱。(2)从涂片、镜检、分离培养以及动物实验所观察到的病原微生物特征,皆可确诊为禽多杀性巴氏杆菌,据此可确诊两株是禽霍乱。(3)生化试验结果表明两株细菌确系巴氏杆菌。从药敏试验结果来看,此两株细菌对多种抗生素及磺胺类药物高度敏感,这些药物均可有效地治疗本病。(4)综上所述,对两组鸭分别进行了病理学诊断和病原学诊断,确诊为禽霍乱。故可根据防制禽霍乱的基本方法进行防制,并可根据本试验中药敏试验的结果提供治疗措施。
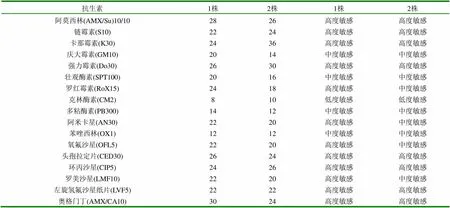
表2 药敏试验结果抑菌圈直径 (mm)
3 讨论
(1)本病一年四季均可发生,气候剧变、高温潮湿、多雨、饲养管理不良等因素常促进该病的发生和流行。在诊断过程中,要结合多方面的因素,综合考虑而作出诊断结论。(2)禽霍乱的病原为多杀性巴氏杆菌,为细小球杆菌。根据巴氏杆菌特异性荚膜抗原的不同,分为A,B,C,D,E和F5个血清型,禽霍乱主要属于A型,亦见于D型。(3)在动物试验中,对死亡的家兔作病理解剖,观察到肝脏有大量灰色坏死点。取一小片肝脏触片镜检,观察到两极浓染的革兰氏阴性球杆菌,为确诊禽霍乱提供了重要依据。(4)目前,在禽霍乱的治疗方面存在盲目用药的现象,因此,常出现在使用抗生素类药物治疗本病时,不能取得预期效果。而结合本场次的流行菌株的药敏试验结果选用有针对性的高敏药物,可有效解决这一问题。(5)在传染病的诊断过程中,要防止唯病原论观点。在本次试验中,虽然观察到革兰氏阴性,两极浓染的球杆菌,但也不排除存在混合感染的可能性。同时要注意不同疫病间的鉴别诊断,应将本病与鸭疫里氏杆菌病、鸭大肠杆菌病、鸭病毒性肝炎、鸭沙门氏菌病等进行鉴别。(6)在鸭禽霍乱的防制方面,加强鸭群的饲养管理,平时严格执行鸭场兽医卫生防疫措施,以栋舍为单位采取全进全出的饲养制度,对预防本病的发生是完全有可能的,一般从未发生本病的鸭场不进行疫苗接种。如发生本病,立即对鸭群进行封锁、隔离、检疫和消毒,对假定健康鸭,用禽霍乱抗血清进行紧急预防注射。
[1] 甘孟侯,蒋金书. 畜禽群发病防治[M]. 第2版. 北京: 中国农业大学出版社, 1998.
[2]中国农业科学院哈尔滨兽医研究所. 动物传染病学[M]. 北京: 中国农业出版社, 1998.
[3]姚火春. 兽医微生物学实验指导[M]. 第2版. 北京: 中国农业出版社. 1998.
[4]陈天寿. 微生物培养基的制造与应用[M]. 北京: 中国农业出版社,1995.
[5]赵斌, 何少江. 生物学实验[M]. 北京: 科学出版社, 2002.
[6]蔡宝祥. 兽医传染病学[M]. 第3版. 北京: 中国农业出版社, 2001.
[7]北京农业大学. 动物生物化学实验指导[M]. 北京: 中国农业出版社 2000.
(2010–11–23)
S858.32
A
1007-1733(2011)02-0010-03

