草酸二乙酯和草酸二甲酯加氢反应热力学对比分析
张 旭,王保伟
(天津大学 化工学院 绿色合成与转化教育部重点实验室,天津 300072)
草酸二乙酯和草酸二甲酯加氢反应热力学对比分析
张 旭,王保伟
(天津大学 化工学院 绿色合成与转化教育部重点实验室,天津 300072)
采用Benson基团贡献法、Constantinou-Gani法和Rihani-Dorasiwamy法计算了草酸二乙酯(DEO)、乙醇酸乙酯、草酸二甲酯(DMO)和乙醇酸甲酯等物质的标准生成焓、标准生成吉布斯自由能和摩尔定压热容。在473~513 K和1.0~3.5 MPa下,分别计算了DEO和DMO加氢反应的焓变、吉布斯自由能变和平衡常数。计算结果表明,除在低压高温条件下乙醇酸甲酯加氢生成乙二醇的反应为非自发反应外,DEO和DMO加氢都是自发进行的放热反应;低温高压有利于生成乙二醇;与DMO的加氢反应相比,DEO加氢反应具有更高的平衡常数。
草酸二乙酯;草酸二甲酯;乙二醇;加氢;热力学
乙二醇(EG)是重要的化工原料,具有广泛的用途。目前EG主要由环氧乙烷直接水合法生产,该方法的生产规模大,技术成熟,在较长时期内仍将是EG的主导生产方法。但以乙烯或乙烷为原料生产环氧乙烷在一定程度上会受到石油资源日益紧缺的影响。因此寻找一种成本低、流程短、清洁环保、不依赖石油资源的EG生产方法十分必要。草酸二乙酯(DEO)[1-2]和草酸二甲酯(DMO)[3-6]加氢可获得EG,该方法受到了广泛的关注[7]。
热力学计算对研究化学反应具有重要的指导和参考意义[8]。DEO和DMO具有类似的结构,但仍存在一些区别,因此表现出不同的性质。尹安远等[9-10]分别对DEO和DMO的加氢反应进行了热力学计算,取得了一定的成果。但由于部分物质的热力学数据需要通过估算得到,而选取的估算方法往往不统一,因此当把不同文献结果进行对比研究时容易出现较大的偏差。
本工作对DMO和DEO的加氢过程进行了热力学计算、分析和对照,以期为进一步的研究提供理论参考。
1 热力学计算
1.1 基础热力学数据
DEO加氢两步反应分别生成乙醇酸乙酯(MPEG)和EG,反应历程如下:
DMO的加氢过程与DEO加氢过程类似,主要区别为第一步反应的产物为乙醇酸甲酯(MG)和甲醇,反应历程如下:


采用 Benson 集团贡献法[11]46-55估算 DEO,MPEG,DMO,MG的标准生成焓(Δf)分别为:-758.32,- 590.45,- 690.5,- 561.99 kJ/mol。由文献[12]查得DEO和DMO的 Δf分别为-742.0,-708.9 kJ/mol,与 Benson 集团贡献法估算值的偏差分别为2.2%,-2.7%,证明Benson集团贡献法估算的数据可用。DEO和DMO的ΔfH298取文献值[12]。
采用 Constantinou - Gani法[11]572-573计算 DEO,DMO,MPEG,MG的标准生成吉布斯自由能(Δf),再由式(7)计算计算标准生成熵(Δf)。

DMO和DEO加氢反应物系中各物质的热力学数据见表1,其中乙醇、甲醇和EG数据源自文献[12],H2和H2O 的数据源自文献[13];各物质的摩尔定压热容(Cpm)计算公式见表2,其中 DEO,DMO,MPEG,MG 的数据采用 Rihani-Dorasiwamy法[14]估算,其他各物质数据源自文献[13]。
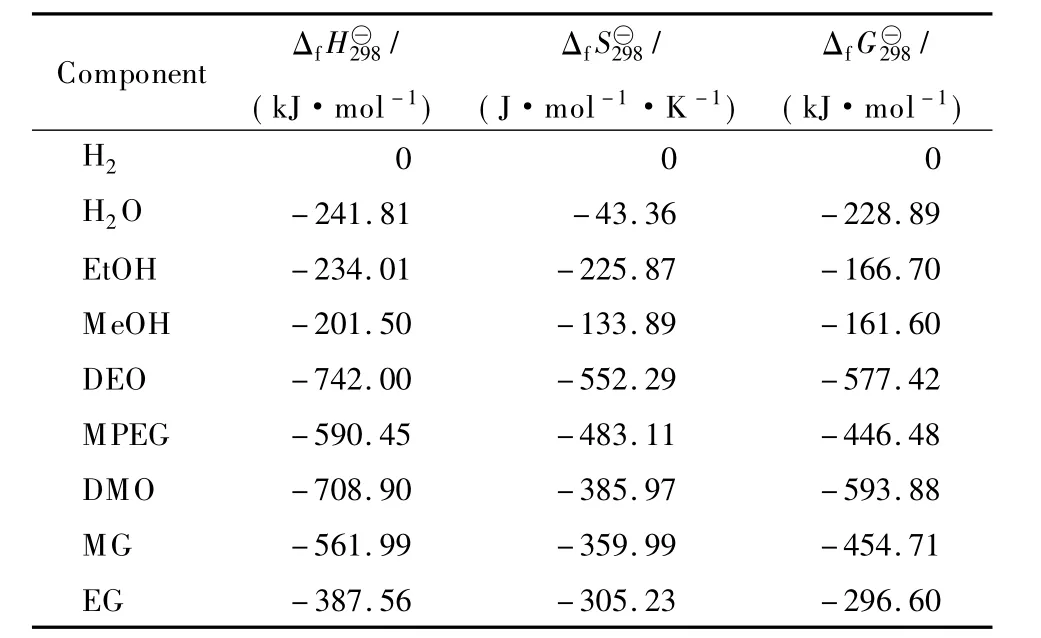
表1 DMO和DEO加氢反应物系中各物质的热力学数据[12-13]Table 1 Thermodynamic data of the components in the system for the hydrogenations of dimethyl oxalate(DMO)and diethyl oxalate(DEO)[12-13]
表2 DMO和DEO加氢反应物系中各物质的Table 2 Molar heat capacities at constant pressure(Cpm)of the components in the hydrogenation system[13-14]

表2 DMO和DEO加氢反应物系中各物质的Table 2 Molar heat capacities at constant pressure(Cpm)of the components in the hydrogenation system[13-14]
Component Cpm(J·mol-1·K -1)=A+B(T/100)+C(T/100)2+D(T/100)3 ABCD H2 28.621 0.092 052 -0.000 469 94 0.000 736 28 H2O 32.415 0.034 221 4 0.128 514 7 -0.004 408 350 EtOH 6.732 23.152 86 -1.211 626 0.024 934 82 MeOH 14.184 11.073 15 -0.390 215 8 0.003 786 256 DEO 31.281 44.808 2 -1.156 4 -0.046 01 MPEG 19.258 37.057 7 -1.565 2 0.005 043 DMO 27.980 26.931 6 -0.154 8 -0.067 74 MG 17.608 28.119 4 -1.064 4 -0.005 82 EG 17.090 28.822 63 2.250 416 0.074 062 49
1.2 状态设计及热力学计算
以473 K、2.5 MPa下的反应1为例,进行状态设计,如图1所示。
根据反应过程和压力及温度的变化,计算得473 K下反应的焓变(ΔrHT)、熵变(ΔrST)和吉布斯自由能变(ΔrGT)为:
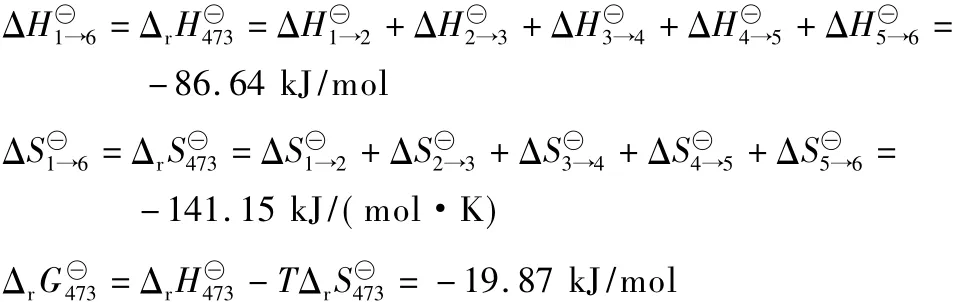
由Δr=-RTlnKp计算得平衡常数Kp=156。
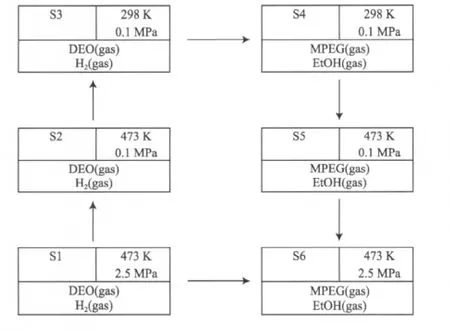
图1 反应方程1的热力学计算状态设计Fig.1 Status design of thermodynamic calculation for reaction 1.
2 结果与讨论
2.1 DEO 加氢反应
2.5 MPa下DEO加氢反应的热力学数据见表3。由表3可知,在温度由473 K到513 K变化的过程中,ΔrGT<0,反应可以自发地进行;各步都是放热反应,所以降低反应温度有利;各步反应的Kp都大于20,平衡转化率较高,其中Kp(1)<<Kp(2'),有利于生成EG。反应3基本为不可逆反应。因此若希望得到更高的EG收率,需要调整反应条件、选用合适的催化剂,促进反应1和反应2的进行,抑制反应3的发生。
不同条件下DEO加氢反应各步的Kp见图2~4。

表3 2.5 MPa下 DEO 加氢反应的 ΔrGT,ΔrHT,KpTable 3 Changes of Gibbs free energy(ΔrGT),enthalpy(ΔrHT)and equilibrium constant(Kp)for hydrogenation of DEO under 2.5 MPa

图2 反应1的Kp随温度和压力的变化Fig.2 The effects of reaction temperature and pressure on Kpof reaction 1.
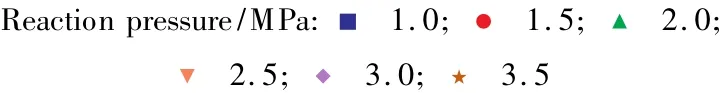
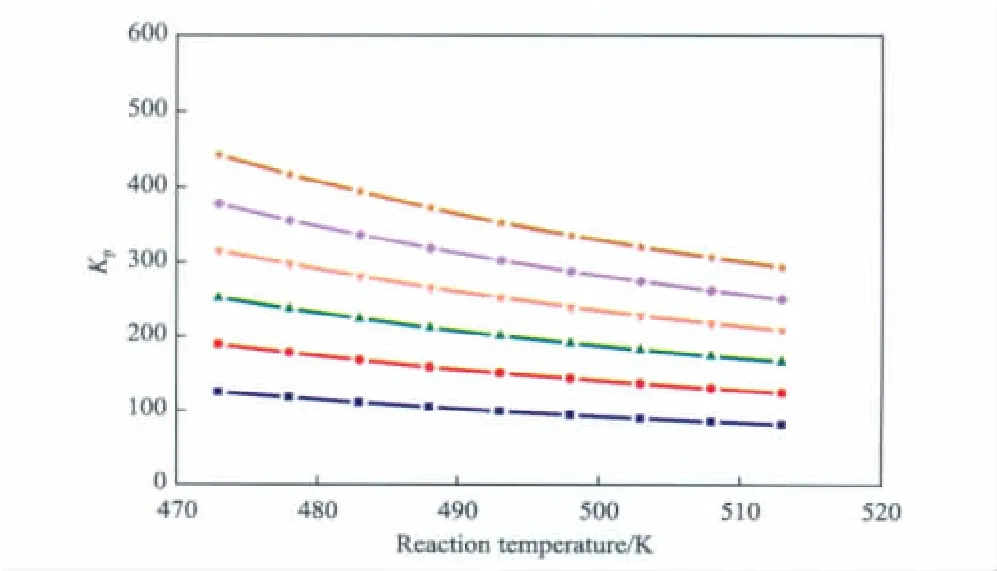
图3 反应2的Kp随温度和压力的变化Fig.3 The effects of reaction temperature and pressure on Kpof reaction 2.
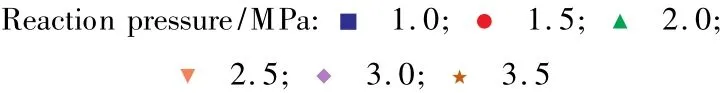

图4 反应2'的平衡常数随温度和压力的变化Fig.4 The effects of reaction temperature and pressure on Kpof reaction 2'.

由于反应3中反应前后反应物与生成物的量一致,所以ΔrGT不受压力变化的影响。
由以上分析可见,在一定的压力下,温度由473 K到513 K变化的过程中,Kp都有所减小,差距可达数倍;而在相同的温度下,提高压力则使Kp明显提高。所以低温高压有利于EG的生成。
2.2DMO 加氢反应
2.5 MPa下DMO加氢反应的热力学数据见表4。由表4可知,不同温度下各反应的ΔrGT<0,为自发反应,但与表3进行比较可以发现ΔrGT的绝对值有所减小,导致Kp较小,说明从反应平衡角度分析DEO加氢具有一定的优势;EG过加氢生成乙醇的Kp较大,不利于EG的生成;由于ΔrHT绝对值较低,使得反应放热减小,有利于对反应进行精确的温度控制。
不同条件下DMO加氢反应各步的Kp见图5~7。

表4 2.5 MPa下DMO加氢反应的ΔrGT,ΔrHT和KpTable 4 ΔrGT,ΔrHTand Kpof hydrogenation of DMO under 2.5 MPa

图5 反应4的Kp随温度和压力的变化Fig.5 The effects of reaction temperature and pressure on Kpof reaction 4.


图6 反应5的Kp随温度和压力的变化Fig.6 The effects of reaction temperature and pressure on Kpof reaction 5.


图7 反应5'的Kp随温度和压力的变化Fig.7 The effects of reaction temperature and pressure on Kpof reaction 5'.
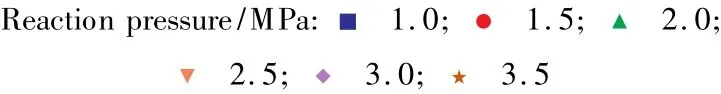
通过与图2~4的对比可知,DMO加氢生成乙醇酸酯和EG反应的Kp随压力和温度的变化与DEO加氢过程类似,即随着压力升高而升高,随着温度的升高而降低。但是变化的幅度有所减缓。这说明了DMO与DEO具有一定的相似性。另外,在确定的压力和温度下DMO加氢反应与相对应的DEO加氢反应相比,Kp都有很大幅度的降低。当反应温度为473 K、压力为2.5 MPa时,DEO和DMO加氢生成乙醇酸酯反应的Kp由156下降为49.7,DEO 和DMO加氢生成EG 的Kp则由4.96×104下降为128;特别是反应5,当压力为1.0 MPa,而且温度高于478 K时,其Kp小于1,成为非自发反应,表示DEO和DMO加氢反应有较大的差异。
3 结论
(1)除在低压高温条件下MG加氢生成EG的反应非自发外,各步加氢反应均为自发的放热反应。
(2)降低反应温度有利于提高各反应的平衡转化率;高压有利于生成乙醇酸酯和EG。
(3)DEO加氢生成MPEG和EG的反应比DMO加氢生成对应产物的反应更为有利。
[1]He Liming,Chen Xiaochun,Ma Jingsheng,et al.Characterization and Catalytic Performance of Sol-Gel Derived Cu/SiO2Catalysts for Hydrogenolysis of Diethyl Oxalate to Ethylene Glycol[J].J Sol-Gel Sci Technol,2010,55(3):285 -292.
[2]Wang Baowei,Zhang Xu,Xu Qian,et al.Preparation and Characterization of Cu/SiO2Catalyst and Its Catalytic Activity for Hydrogenation of Diethyl Oxalate to Ethylene Glycol[J].Chin J Catal,2008,29(3):275 -280.
[3]Chen Liangfeng,Guo Pingjun,Qiao Minghua,et al.Cu/SiO2Catalysts Prepared by the Ammonia - Evaporation Method:Texture,Structure,and Catalytic Performance in Hydrogenation of Dimethyl Oxalate to Ethylene Glycol[J].J Catal,2008,257(1):172 -180.
[4]Yin Anyuan,Guo Xiuying,Dai Weilin,et al.Highly Active and Selective Copper-Containing HMS Catalyst in the Hydrogenation of Dimethyl Oxalate to Ethylene Glycol[J].Appl Catal,A,2008,349(1-2):91-99.
[5]Yin Anyuan,Guo Xiuying,Fan Kangnian,et al.Influence of Copper Precursors on the Structure Evolution and Catalytic Performance of Cu/HMS Catalysts in the Hydrogenation of Dimethyl Oxalate to Ethylene Glycol[J].Appl Catal,A,2010,377(1 -2):128 -133.
[6]张启云,黄维捷,文峰,等.草酸二甲酯加氢合成乙二醇反应的研究[J].石油化工,2007,36(4):340-344.
[7]许茜,王保伟,许根慧.乙二醇合成工艺的研究进展[J].石油化工,2007,36(2):194-199.
[8]王丽苹,萧斌,王公应.碳酸酯与1,4-丁二醇酯交换合成聚碳酸酯二醇的热力学分析[J].石油化工,2009,38(9):961-965.
[9]尹安远,戴维林,范康年.草酸二甲酯催化加氢合成乙二醇过程的热力学计算与分析[J].石油化工,2008,37(1):62-66.
[10]田克胜,王保伟,许根慧.草酸二乙酯气相加氢热力学计算与分析[J].天然气化工:C1化学与化工,2007,32(1):40-51.
[11]Poling B E,Prausnitz J M,O’Connell J P.气液物性估算手册[M].赵红玲,王凤坤,陈圣坤,译.北京:化学工业出版社,2006.
[12]马沛生.有机化合物实验物性数据手册——含碳、氢、氧、卤部分[M].北京:化学工业出版社,2006:521.
[13]金克新,赵传钧,马沛生.化工热力学[M].天津:天津大学出版社,1990:266-270.
[14]董新法,方利国,陈砺.物性估算原理及计算机计算[M].北京:化学工业出版社,2006:193-194.
Comparative Thermodynamic Analysis of Hydrogenations of Diethyl Oxalate and Dimethyl Oxalate
Zhang Xu,Wang Baowei
(Key Laboratory for Green Chemical Technology of Ministry of Education,School of Chemical Engineering&Technology,Tianjin University,Tianjin 300072,China)
Standard enthalpies of formation Δ,standard Gibbs free energies of formation Δfand molar heat capacities at constant pressureCpmof diethyl oxalate(DEO),ethyl glycolate,dimethyl oxalate(DMO)and methyl glycollate(MG)etc.,and further the enthalpy changes ΔrHT,Gibbs free energy changes ΔrGTand equilibrium constantsKpin hydrogenations of DEO and DMO under 473 -513 K and 1.0 -3.5 MPa were calculated by different methods,including Benson group contribution method,Constantinou-Gani method and Rihani-Dorasiwamy method.The results show that the hydrogenations of DEO and DMO are spontaneous exothermic reactions,except for the production of ethylene glycol from MG,which is not spontaneous at low pressure and high temperature.Low temperature and high pressure are propitious to synthesis of ethylene glycol.Kpof DEO hydrogenation is higher than that of DMO hydrogenation.
diethyl oxalate;dimethyl oxalate;ethylene glycol;hydrogenation;thermodynamics
1000-8144(2011)04-0403-05
TQ 013.1
A
2010-11-01;[修改稿日期]2010-12-21。
张旭(1983—),男,辽宁省锦州市人,博士生,电话13502077183,电邮 zhangxu_1983@126.com。联系人:王保伟,电话022 -27402944,电邮 wangbw@tju.edu.cn。
国家“十一五”科技支撑计划项目(2006 BAE02B00)。
(编辑 李治泉)

