由氟化锂和五氯化磷制备五氟化磷的动力学研究*
杨海兰,曹 骐,张志业,傅玉信,钟本和,王辛龙
(四川大学化工学院,四川成都 610065)
由氟化锂和五氯化磷制备五氟化磷的动力学研究*
杨海兰,曹 骐,张志业,傅玉信,钟本和,王辛龙
(四川大学化工学院,四川成都 610065)
在150~195℃下,研究了氟化锂和五氯化磷制备五氟化磷的反应过程,并应用缩芯模型处理数据,确定了反应的动力学模型:反应初期(0~0.5 h),该反应受化学反应控制,动力学方程为ks=22.2exp[-34 490/(RgT)];反应后期(1~3 h),该反应主要受内扩散控制,动力学方程为De=4.357×10-7exp[-29 980/(RgT)]。该研究旨在揭示氟化锂和五氯化磷制备五氟化磷反应过程的相关规律,为工业生产五氟化磷提供必要的基础数据。
五氟化磷;缩芯模型;动力学
五氟化磷(PF5)作为一种氟化剂广泛应用于电子工业、高分子材料和催化剂等领域[1-3]。近年来将PF5用于制备锂离子电池的电解质六氟磷酸锂已成为该领域的热点[4-7],六氟磷酸锂是目前锂离子电池中被公认为性能最优异的电解质。五氟化磷的制备方法根据反应历程大致可分为直接法和间接法[2-3]。直接法以氟气与五氧化二磷反应为代表,该方法要求反应装置具有较高的抗压能力,对反应器材质要求比较苛刻,且该反应剧烈放热难以控制,再加之原料氟气价格昂贵,因此该法的经济成本相对较高。另一种代表方法为采用五氯化磷和无水氟化氢反应,此法由于反应强烈放热,如果温度不能很好地控制易发生爆炸。间接法制备五氟化磷过程相对比较复杂,且涉及腐蚀性很强的物质如三氟氧磷、六氟磷酸,实际应用局限性较大。笔者选取氟化锂(LiF)和五氯化磷(PCl5)为原料制备PF5,这两种原料相对以上所述制备方法中涉及到的氟气、三氟氧磷、氟化氢等毒性较低、成本较低,且反应放热不强烈、易于控制、危险性小,适用于工业生产。笔者通过缩芯模型描述了氟化锂和五氯化磷制备五氟化磷的反应过程,以此来揭示该反应的相关规律,为工业生产五氟化磷及六氟磷酸锂提供基础数据。
1 实验过程及方法
1.1 试剂与仪器
试剂:五氯化磷、氟化锂均为化学纯,其中氟化锂颗粒分布均匀,平均粒径R为7.63 μm;其余试剂均为分析纯。
仪器:真空工作站(成都德力斯实业公司生产),自制蒙耐尔合金微型反应器。
1.2 实验原理
以氟化锂和五氯化磷为原料,在150~195℃条件下反应可制备五氟化磷。由于150℃以上五氯化磷已升华为气体,因此该反应的特性为LiF和PCl5的气固反应,即:

经初步热力学计算,在不含水分的情况下,两种物质(氟化锂和五氯化磷)在150~195℃只能生成五氟化磷,不存在其他副反应,且反应完毕后未反应的五氯化磷经降温可凝结成固体,因此有望得到纯度较高的PF5气体。该气体可以收集,也可以进一步制备六氟磷酸锂[8]。
1.3 实验方法
按PCl5与LiF物质的量比为1∶7.2分别称取PCl5和LiF(LiF的质量用m0表示,PCl5的质量用n0表示)。在手套箱中将两种物质混合均匀后装填于反应器中,紧固密封后放入自制加热套中程序升温至指定温度,并保持一定时间。待反应完毕后冷却,置换出气体,然后转移至真空工作站内,拆开反应器,分析气体吸收液和剩余固体残留物中的氟化锂。
1.4 分析方法
反应后剩余固体残留物是反应生成的产物LiCl和未反应的LiF及PCl5。LiF难溶于水和乙醇,易溶于酸[9],而LiCl和PCl5溶于水,也溶于酸和碱,且PCl5溶于水后会生成盐酸和磷酸。采用乙醇和氢氧化钠溶液溶解反应后的混合物,加入氢氧化钠的目的是为了中和残留的五氯化磷与水生成的酸,以防止氟化锂溶于酸中。通过称量不溶物,并与空白实验溶解氟化锂的量进行校正,加上吸收液中随气体带出的氟化锂,得到未反应氟化锂的质量m1,从而计算出五氯化磷的转化率(XPCl5)和氟化锂的转化率(XLiF),即:XLiF=(m0-m1)/m0×100%;XPCl5=(n0-n1)/n0×100%。其中:n0-n1=1.604 (m0-m1)。n1为未反应的PCl5的质量。
2 结果与讨论
2.1 反应过程的速率方程
图1和图2分别表示不同温度下PCl5和LiF的转化率随时间的变化。由于氟化锂加料量比理论量多,所以LiF的转化率要比PCl5的转化率少。从图1、图2看出:在0~0.5 h,PCl5和LiF的转化率变化很快,但超过1 h后,二者的转化率变化缓慢。
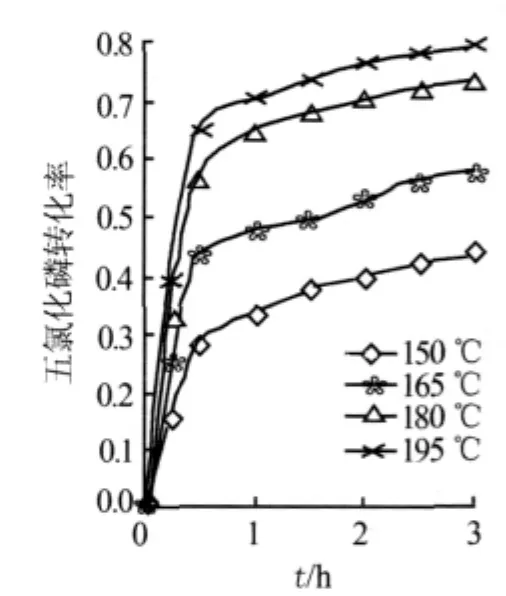
图1 不同温度下PCl5转化率随时间的变化

图2 不同温度下LiF转化率随时间的变化
由于该反应为PCl5和LiF的气固反应,符合非催化气固反应特征,又由于实验采用的氟化锂颗粒致密,固体空隙很小,反应后未反应的氟化锂核明显减小,因此该反应符合缩芯模型[10]。结合实验结果进行拟合,可得到PCl5和LiF反应的速率数学表达式: t

当反应受PCl5气体外扩散控制时,反应速率表达式简化为:

当反应受化学反应控制时,反应速率表达式简化为:

当反应受PCl5气体在固体层的内扩散控制时,反应速率表达式简化为:
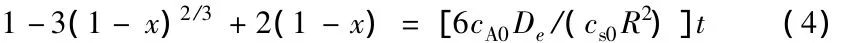
2.2 速率常数和扩散常数的确定
对固体氟化锂的转化率数据进行处理。首先假设反应受化学反应控制,根据反应速率表达式(3),g(x)=1-(1-x)1/3与t应呈线性关系。图3为不同温度下0~3 h的g(x)与t的关系。由图3可以看出:g(x)与t仅在反应初期的0~0.5 h呈较好的线性关系;在0.5 h后,g(x)实验点开始偏离直线,二者并不呈线性关系。图4为不同温度下0~0.5 h的g(x)与t的关系。由图4可以进一步证明g(x)与t在0~0.5 h呈较好的线性关系,其拟合曲线的线性相关系数大于0.98。图5为不同温度下1.0~3.0 h的P(x)与t的关系。由图5可以看出,在1.0~3.0 h的反应阶段,P(x)与t亦呈较好的线性关系,其拟合曲线的线性相关系数也大于0.98。
由此可以说明氟化锂和五氯化磷制备五氟化磷的反应历程:该反应符合缩芯模型,在反应初期的0~0.5 h,反应主要是按反应控制的缩芯模型进行;超过0.5 h时,随着内扩散阻力的增大,反应开始逐渐向内扩散控制区转移,0.5~1.0 h为反应控制和内扩散控制的混合控制区;当反应超过1.0 h后,反应进入以内扩散控制为主导的区域。在反应初期的0~0.5 h,受到的化学反应阻力较小,反应速率较快;在反应后期的1.0~3.0 h,由于受到内扩散阻力影响较大,反应速率明显减小,这就解释了转化率变化先快后慢的原因。

图3 不同温度下0~3.0 h的1-(1-x)1/3与t的关系
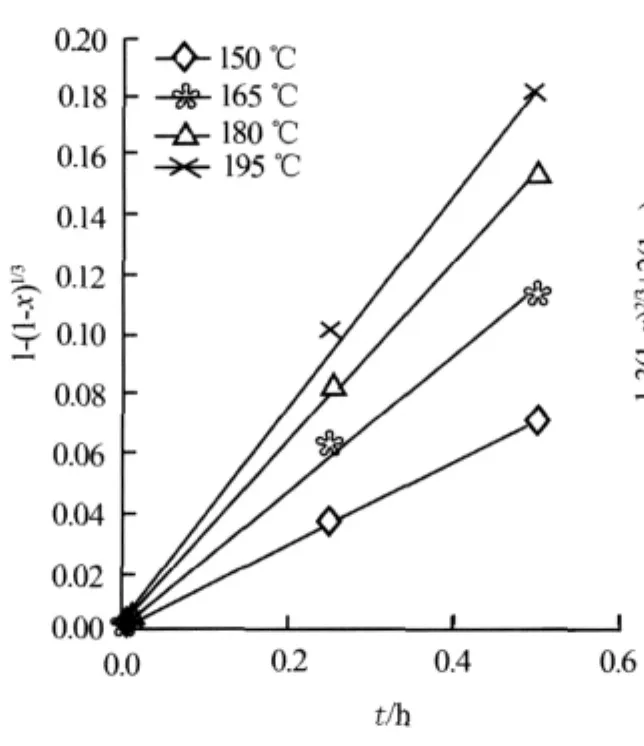
图4 不同温度下0~0.5 h的1-(1-x)1/3与t的关系

图5 不同温度下1.0~3.0 h的1-3(1-x)2/3+2(1-x)与t的关系
根据图4的拟合结果求出0~0.5 h的各拟合直线斜率k,再由缩芯模型速率公式(3)求出表面反应速率常数ks,即ks=kcs0R/cA0。式中:R= 7.63×10-6m;cs0=1.02×105mol/m3;cA0= 95.465 mol/m3。各温度下(150、165、180、195℃)反应初期(0~0.5 h)表面反应速度常数ks计算结果为:1.152×10-3、1.829×10-3、2.499×10-3、2.940×10-3。由Arrhenius公式lnks=-E/(RgT)+lnks0,在150~195℃做lnks—1/T的拟合直线可求出反应的活化能E反应=34.49 kJ/mol;ks与温度的关系表示为ks=22.2exp[-34 490/(RgT)]。
同样地,根据图5的拟合结果求出1.0~3.0 h的各拟合直线斜率k,再由缩芯模型速率公式(4)求出气体在固相中的有效扩散系数De,即De= kcs0R2/cA0。各温度下(150、165、180、195℃)在1.0~3.0 h扩散系数De的计算结果为:0.801× 10-10、1.206×10-10、1.529×10-10、1.830×10-10。由De的Arrhenius公式lnDe=-E/(RgT)+lnDe0,在150~195℃通过拟合lnDe—1/T可求出扩散活化能E扩散=29.98 kJ/mol;扩散系数与温度的关系是De=4.357×10-7exp[-29 980/(RgT)]。
3 结论
通过系统研究150~195℃下PCl5和LiF反应制备五氟化磷,发现反应过程可通过缩芯模型描述,即在反应初期的0~0.5 h,PCl5和LiF的转化率随时间的变化很快,该过程主要受化学反应控制,其动力学方程为ks=22.2exp[-34 490/(RgT)];超过1.0 h后,二者的转化率随时间变化趋于缓慢,该过程主要受内扩散控制,其动力学方程为De=4.357× 10-7exp[-29 980/(RgT)]。因此要想进一步增大反应物的转化率就必须减小反应的内扩散阻力,可以通过减小氟化锂颗粒的粒径,或者以较高比表面积的氟化锂颗粒为原料来实现。
符号说明:x为LiF的转化率;cA0为PCl5的起始浓度;R为LiF的颗粒半径;cs0为LiF的固体浓度;kg为气体扩散系数;ks为反应速率常数;De为气体在固相中的有效扩散系数;t为反应时间。
[1]Montgomery M,Crai D.Methods of improve semiconductor[J].Research of Semiconductor,1994,48(32):105-107.
[2]邓波,张志业.五氟化磷的制备研究进展[J].化学推进剂与高分子材料,2002(6):7-9.
[3]刘建文,李新海,王志兴,等.五氟化磷制备过程的GC-MSSIM法评价与监测[J].中南大学学报:自然科学版,2009,40(4):868-873.
[4]郭炳琨,徐徽,王先友,等.锂离子电池[M].长沙:中南大学出版社,2002:158-161.
[5]李凌云,张志业,陈欣.六氟磷酸锂的制备工艺新进展[J].化学工业与工程,2005,22(3):224-228.
[6]滕祥国,戴纪翠,马培华.锂离子二次电池电解质材料LiPF6的制备及表征[J].无机化学学报,2004,20(9):1109-1111.
[7]天津化工设计研究院电池材料研究所.六氟磷酸锂的制备方法:中国,1850592[P].2006-10-25.
[8]乌尔里希·维特尔曼,克劳斯·沙德.制备LiPF6的方法: 1224405[P].1999-07-28.
[9]B.A.拉宾诺维奇.简明化学手册[M].北京:化学工业出版社,1983:136.
[10]郭汉贤.应用化工动力学[M].北京:化学工业出版社,2003: 407-440.
Research on kinetics for preparation of phosphorus pentafluoride with lithium fluoride and phosphorus pentachloride
Yang Hailan,Cao Qi,Zhang Zhiye,Fu Yuxin,Zhong Benhe,Wang Xinlong
(School of Chemical Engineering,Sichuan University,Chengdu610065,China)
Reaction process for the preparation of phosphorus pentafluoride with phosphorus pentachloride and lithium fluoride was studied at 150~195℃.Shrinking core model was used to simulate the data and the kinetic model of the reaction was obtained:the earlier period from start to 0.5 h was controlled by chemical reaction,the kinetic equation was:ks= 22.2exp[-34 490/(RgT)];the later period from 1 h to 3 h is controlled by diffusion control,the dynamic equation was:De=4.357×10-7exp[-29 980/(RgT)].This study aims to reveal the related laws of the reaction between phosphorus pentachloride and lithium fluoride to prepare phosphorus pentafluoride and provides necessary data for the industrial production of phosphorus pentafluoride.
phosphorus pentafluoride;shrinking core model;kinetics
TQ124.3;131.11
A
1006-4990(2011)06-0030-03
四川省科技支撑计划项目(2008GZ0025)。
2011-01-17
杨海兰(1986— ),女,在读硕士研究生,主要从事锂离子二次电池的研究。
联系人:王辛龙
联系方式:wangxl@scu.edu.cn

