石参多糖的体外抗氧化活性研究
马 宁,杨培君,李会宁,裴会鹏,黄 俊
(陕西理工学院生物科学与工程学院,陕西汉中723001)
石参多糖的体外抗氧化活性研究
马 宁,杨培君*,李会宁,裴会鹏,黄 俊
(陕西理工学院生物科学与工程学院,陕西汉中723001)
采用水提醇沉法提取石参粗多糖,通过比色法测定石参多糖对羟自由基(·OH)、超氧阴离子(·)、过氧化氢(H2O2)和2,2-二苯基苦基苯肼自由基(DPPH·)的清除率,并与VC进行比较,从而对石参多糖的抗氧化活性进行研究。结果表明,石参多糖具有一定的体外抗氧化能力,与阳性对照VC相比,石参多糖对H2O2有较强的清除能力,对DPPH·、·OH和·具有不同的清除活性,清除率与石参多糖浓度呈正相关性。
石参,多糖,抗氧化作用
1 材料与方法
1.1 材料与设备
石参 购于陕西省汉中市略阳县产地加工产品,烘干,粉碎,过50目筛,备用;邻苯三酚(焦性没食子酸)、三羟甲基氨基甲烷(Tris)、磷酸二氢钠、磷酸氢二钠、抗坏血酸(VC)、邻菲啰啉、硫酸亚铁、30%过氧化氢(H2O2)、2,2-二苯基苦基苯肼(DPPH)、无水乙醇、无水乙醚、丙酮、正丁醇、三氯甲烷和盐酸均为分析纯。
AL204电子天平 梅特勒;UV-2550紫外分光光度计 日本岛津;数显恒温水浴锅 北京科伟; RV10旋转蒸发仪 德国IKA。
1.2 实验方法
1.2.1 石参粗多糖的制备 取一定量石参粉末,置于索氏提取装置中,加入乙醚,45℃回流浸提,以脱去表面脂肪;挥干乙醚,然后加入80%乙醇,热回流去杂3次,每次2h,抽滤。滤渣在90℃,料液比1∶50条件下浸提2次,每次3h。浓缩滤液,采用Sevag法除蛋白,以1∶4加入无水乙醇,有絮状凝胶物和粒状沉淀析出,静置过夜。抽滤,滤渣依次用无水乙醇、丙酮和乙醚洗涤,60℃干燥得淡黄色粉末,即石参粗多糖。
1.2.2 各体系特征吸收波长的确定
1.2.2.1 多糖清除羟自由基(·OH)特征波长的确定
采用邻二氮菲-Fe2+氧化法[15],取75mmol/L邻二氮菲1.0mL,加入 150mmol/L pH 7.4磷酸缓冲液(PBS)1.5mL,充分混匀后,加入7.5mmol/L FeSO4溶液1.0mL,每加一管立即混匀,加0.01%H2O21.0mL,最后以蒸馏水补充至总体积为10.0mL。反应液37℃保温1h后,扫描其300~600nm范围内的紫外吸收曲线,其特征吸收波长为536nm。
1.2.2.2 多糖清除DPPH·特征波长的确定 按文献[16]方法略加改动,准确称取10.0mg DPPH,用50%乙醇定容于250mL容量瓶中,得到浓度为1×10-4mol/L的 DPPH溶液。取4.0mL DPPH溶液,加入4.0mL 50%乙醇,摇匀,25℃环境中放置40min,扫描其450~550nm范围内的紫外吸收曲线,其特征吸收波长为517nm。
1.2.2.3 多糖清除超氧阴离子自由基(O2-·)特征波长的确定 取4.5mL50mmol/LTris-HCl缓冲液(pH =8.2),4.2mL蒸馏水,混匀,置于25℃条件下保温20min后立即加入25℃预热过的0.3mL 3mmol/L邻苯三酚溶液,且加入后快速摇匀,扫描其300~500nm范围内的紫外吸收曲线,其特征吸收波长为325nm。
1.2.3 石参多糖抗氧化活性的测定
1.2.3.1 多糖对羟自由基(·OH)的清除作用 根据
1.2.2.1 方法所测出的吸光度值为A损伤,样品管中依次加入1.0mL不同浓度多糖溶液后再加入H2O2,37℃保温1h,在特征吸收波长处测A加样。未损伤管为不加H2O2及多糖溶液。VC为阳性对照。按下式计算自由基清除率。

1.2.3.2 清除DPPH·能力的测定方法 依1.2.2.2方法,将4.0mL蒸馏水用不同浓度石参多糖样品代替,以特征吸收波长处的吸光度Ai,以4.0mL 50%乙醇代替样品得吸光度Ac,代替DPPH得吸光度记作空白校正Aj值。以VC作为对照。按下式计算自由基清除率。

1.2.3.3 多糖对过氧化氢(H2O2)清除率的测定 依文献[21]方法,在试管中加入由50mmol/L磷酸缓冲液(pH=7.4)配制的0.5mmol/L H2O2溶液2.8mL,再加入不同浓度的多糖溶液1.0mL后,用纯净水补齐至10.0mL,室温放置10min后,于230nm处测定吸光度值A样品,对照管为不加多糖溶液。以VC作为对比。按下式计算自由基清除率。
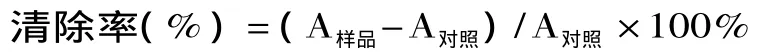
氧化速率=(最后1次记录值-第1次记录值)/4
清除率(%)=(自氧化管氧化速率-样品管氧化速率)/自氧化管氧化速率×100%
2 结果与分析
2.1 石参多糖对·OH的清除作用
石参粗多糖和VC对·OH的清除效果如图1所示。不同浓度的石参粗多糖对H2O2/Fe2+体系通过Fenton反应产生的·OH具有清除作用,且在所选浓度范围内,随着浓度增大,清除率上升,即清除率与多糖的浓度二者呈正相关。作为对照的VC在浓度为1.0mg/mL时,清除率达到100%;而石参粗多糖浓度为4.5mg/mL时仅有20.6%的清除率,7.0mg/mL时清除率才达100%。表明VC清除·OH自由基活性优良,且清除能力优于石参粗多糖。
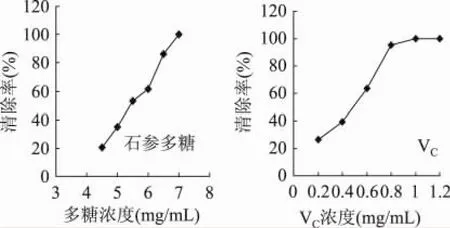
图1 石参多糖和VC对·OH的清除能力
2.2 石参多糖对DPPH·的清除作用
由图2可知,在一定的浓度范围内,石参多糖对DPPH·的清除率和多糖浓度呈一定的量效关系,随着石参多糖浓度的增加,石参多糖对DPPH·的清除率也逐步增加。石参多糖对DPPH·的清除率最终能达到100%,但此时所需石参多糖的最小质量浓度为3.5mg/mL,而VC对DPPH·的最大清除率仅为94%,所需的最小质量浓度为0.12mg/mL。由此可见,在相同条件下,石参多糖对DPPH·的清除效果更加彻底,但清除能力远弱于VC。
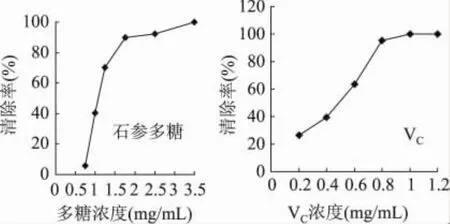
图2 石参多糖和VC对DPPH·的清除能力
2.3 石参多糖对过氧化氢(H2O2)的清除作用
石参多糖和VC对H2O2的清除率都与浓度呈一定的量效关系,随着浓度的增加,二者对H2O2的清除率也逐步增加。在0.4~0.9mg/mL质量浓度范围内,VC的清除能力略优于石参多糖,当浓度高于0.9mg/mL时,与VC相比,石参多糖对H2O2的清除能力较强,清除率达到100%时,石参多糖的最小浓度为1.4mg/mL,而VC的最小浓度为1.6mg/mL。表明石参多糖对H2O2的清除能力优于VC(图3)。

图3 石参多糖和VC对H2O2的清除能力
由图4可知,石参多糖对邻苯三酚自氧化产生的O-2·具有一定的抑制作用,并随浓度的增加其清除率逐渐上升,二者呈正相关。与VC相比,石参多糖浓度为10 mg/mL时,清除率达到100%,而VC在浓度为0.28mg/mL时已达最大清除率,说明VC清除的能力远强于石参多糖。

图4 石参多糖和VC对·的清除能力
3 讨论
随着人们对健康的关注,减少自由基对人体的危害,寻找低毒、高效的天然抗氧化剂已成为现今的研究热点,国内外学者一直在不断寻找能有效清除自由基活性的抗氧化食品[18]。本实验通过4种体外实验模型研究了食用资源石参多糖的体外抗氧化活性。研究表明,石参多糖在各种体系中均表现出一定的清除能力,但强弱程度并不完全一致。与VC相比,石参多糖对H2O2有较强的清除作用,浓度高于0.9mg/mL时,石参多糖对H2O2的清除能力甚至高于阳性对照VC;对·OH和DPPH·的清除作用较弱;而对O2-·的清除作用最弱,需要较高的多糖浓度才能抑制O2-·。这是由于每一个反应体系的组成组分并不相同,发生的反应及抗氧化作用的机理也不相同。
目前,植物多糖体外抗氧化活性研究报道较多,张莲姬等[19]对桔梗多糖抗氧化活性研究表明,桔梗多糖清除·OH的效果优于对O2-·的清除效果,这与石参多糖对二者的清除效果一致,但石参多糖对二者的清除作用弱于桔梗多糖。张泽庆等[20]采用相同的体系研究了防风多糖对·OH,DPPH·和O2-·的清除作用,结果表明,在多糖浓度为8.0mg/mL时,防风多糖对·OH和DPPH·的清除率均接近70%,而石参多糖在7mg/mL和3.5mg/mL,就已经分别达到二者的最大清除率(100%),所以石参多糖对·OH和DPPH·的清除力强于防风多糖。目前,有关多糖清除H2O2方面的研究较少,茹巧美等[21]研究了忽地笑多糖对H2O2的清除作用,结果表明忽地笑多糖对H2O2的清除率达50%时所需的浓度小于0.1mg/mL;而石参多糖清除H2O2的能力明显弱于忽地笑多糖。
本研究的某些模型中,石参多糖表现出的抗氧化活性并不及其阳性对照物VC,但石参是一种野生食用资源,其多糖类物质可以作为一种纯天然抗氧化剂,在为人体提供多种营养物质的同时,石参多糖也能抑制人体一部分有害自由基的产生。另外,目前已有研究表明,对已有的抗氧化多糖进行硫酸化、硒化等结构修饰后,所得的硫酸化多糖和硒化多糖比修饰前的抗氧化活性有较大改善[22-23]。因此,寻找和研究植物活性多糖资源倍受关注;对石参多糖进行进一步的结构改造,有望得到一种安全高效、经济实用的天然抗氧化剂,并在食品、医药工业、化妆品等行业应用,将拓宽石参产品的应用范围,提高其资源价值。
[1]中国科学院中国植物志编委会.中国植物志(第十四卷)[M].北京:科学出版社,1980:35-38.
[2]王勇,杨培君.陕西省百合科一新纪录属——独尾草属[J].西北植物学报,2007,27(10):2116-2117.
[3]李新生,杨培君,李会宁,等.陕西地区石参资源的调查[J].氨基酸和生物资源,2002,24(3):1-2.
[4]凌关庭.抗氧化食品与健康[M].北京:中国医药科技出版社,2000:112-113.
[5]成静,祝寿芬.大刺猴头多糖的免疫调节功能[J].卫生毒理学杂志,2001,9(2):165-166.
[6]Srivastava R,Kulshreshtha D K.Bioactive polysaccharides from plants[J].Photochemistry,1989,28(11):2877-2883.
[7]蔡永春.中药多糖防治肿瘤研究进展[J].中西医结合杂志,2001,21(12):945-947.
[8]郑子瑞,戴玲,钟辉.多糖抗病毒活性的研究进展[J].生物技术通讯,2008,19(5):763-764.
[9]张莅峡,刘泓,常雅萍.红毛五加多糖抗病毒效应的实验研究[J].中国中医基础医学杂志,1999,5(3):25-27.
[10]徐大量,林辉,李盛青,等.玉竹水提液体内外抗氧化的实验研究[J].中药材,2008,31(5):729-731.
[11]单颖,潘兴瑜,姜东,等.玉竹多糖抗衰老的实验观察[J].中国临床康复,2006,10(3):79-81.
[12]郭景仙.重要多糖类成分抗衰老作用的现代研究与应用[J].中国自然医学杂志,2000,2(3):91-92.
[13]辛晓林.中药多糖抗氧化作用研究进展[J].中国中医药大学学报,2000,23(5):45-46.
[14]朱晓霞,罗学刚.多糖提取与纯化技术应用进展[J].食品研究与开发,2007,28(3):186-189.
[15]金鸣,蔡亚欣,李金荣,等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555.
[16]严成,严夏.枸杞多糖提取工艺比较及体外抗氧化性研究[J].食品科学,2008,29(7):183-187.
[17]林丽清,黄丽英,郑艳洁,等.金线莲多糖的提取及清除氧自由基作用的研究[J].福建中医学院学报,2006,16(5): 37-39.
[18]俞慧红,竺巧玲,戴飞,等.多糖抗氧化作用的研究现状[J].食品研究与开发,2008,29(3):172-176.
[19]张莲姬,南昌希,张丽霞.桔梗多糖的提取及抗氧化作用研究[J].食品与机械,2008,24(3):60-63.
[20]张泽庆,田应娟,张静.防风多糖的抗氧化活性研究[J].中药材,2008,31(2):268-272.
[21]茹巧美,裴真明,郑海雷.忽地笑多糖的体外抗氧化和抑菌活性研究[J].中药材,2008,31(10):1536-1540.
[22]张亚费,吴风兰,张明珠.硒化黄芪多糖对小鼠的抑瘤和抗氧化作用研究[J].中国公共卫生学报,1997,16(4):22-26.
[23]Huamao Y,Weiwei Z,Xuegang L,et al.Preparation and in vitro antioxidantactivityofoligosaccharidesand theirover sulfated,acetylated and phosphorylated derivatives[J]. Carbohydrate Research,2005,34(4):685-688.
Study on antioxidant effect of polysaccharide from Shishen(Eremurus chinensis)in vitro
MA Ning,YANG Pei-jun*,LI Hui-ning,PEI Hui-peng,HUANG Jun
(School of Biological Sciences and Engineering,Shaanxi University of Technology,Hanzhong 723001,China)
The polysaccharides from Shishen(Eremurus chinensis)were obtained through water extracting and ethanol precipitating method.Clearance rate of the polysaccharides to hydroxyl radical(·OH),superoxide anion·),hydrogen peroxide(H2O2)and 2,2-Diphenyl-2-picrylhydrazyl(DPPH·)was determined by UV method,and compared with VC.Then the antioxidant effects of polysaccharides were studied.The results showed the polysaccharide had certain antioxidant capacity through comparing with positive control VC.The polysaccharide had stronger capacity of scavenging on the H2O2and had different scavenging activity on the DPPH·,·OH and·.It was indicted to a positive correlation with concentration of polysaccharides.
Shishen(Eremurus chinensis);polysaccharide;antioxidant effect
TS201.1
A
1002-0306(2011)11-0148-04
石参属百合科独尾草属独尾草(Eremurus chinensis Fedtsch)[1]肉质根加工的一种稀有山野菜。独尾草属在我国有4种,1种产于西南,3种产于新疆[2]。陕西省略阳县有独尾草分布,属陕西分布新记录属植物[3]。石参又名石蒜苔、崖参(陕西略阳),食用部分是肉质根,味甘甜,营养丰富,是陕西南部山区一种稀见的山野菜[3]。抗氧化活性是保健食品的27种保健功能之一,它能有效清除体内有害自由基,防止自由基对生物大分子的氧化损伤,保证细胞结构与功能的正常[4]。研究自由基与病理现象的关系,寻找其清除剂已成为目前十分活跃的研究领域。多糖具有免疫调节[5-6]、抗肿瘤活性[7]及抗病毒[8-9]、抗氧化[10]和防衰老[11-12]等作用,而这些作用主要又与多糖的抗氧化作用相关。现代研究发现许多中药多糖都具有提高抗氧化酶活性、清除自由基、抑制脂质过氧化,从而保护生物膜的作用[13]。目前,独尾草属植物多糖的研究报道较少,未见其清除活性自由基方面的研究报道。因此本文对石参粗多糖的体外抗氧化活性进行了较为系统的研究,以期为发挥资源潜在经济价值提供科学依据。
2010-11-09 *通讯联系人
马宁(1984-),男,在读硕士,研究方向:植物生物技术。
陕西省教育厅研究项目(08JK251);陕西省资源生物重点实验室培育项目(SLGJD0803)。

