肉豆蔻炮制品的化学成分分离与鉴定
赵光云,王晓霞,高慧媛
(沈阳药科大学教育部基于靶点的药物设计与研究重点实验室,辽宁 沈阳 110016)
化学
肉豆蔻炮制品的化学成分分离与鉴定
赵光云,王晓霞,高慧媛*
(沈阳药科大学教育部基于靶点的药物设计与研究重点实验室,辽宁 沈阳 110016)
目的:对肉豆蔻Myristica fragrans Houtt.种仁炮制后的化学成分进行分离鉴定。方法:采用麦麸煨制法炮制肉豆蔻,Sephadex LH-20和ODS反相硅胶柱色谱等方法对制肉豆蔻的95%乙醇提取物进行化学成分分离,结合理化性质和波谱数据进行结构鉴定。结果:从麸制肉豆蔻中分离得到9个化合物,分别鉴定为消旋-去氢二异丁香酚[(±)-dehydrodiisoeugenol,1]、利卡灵-B(licarin-B,2)、愈创木素(guaiacin,3)、肉豆蔻醚(myristicin,4)、malabaricone A(5)、malabaricone B(6)、malabaricone C(7)、β-谷甾醇(β-sitosterol,8)、胡萝卜苷(daucosterol,9)。结论:化合物5~7为马拉巴酮衍生物,在生品中至今未见国内有分离报道,推测炮制使该类成分含量明显增加。
肉豆蔻;炮制;化学成分;结构鉴定
肉豆蔻是肉豆蔻科肉豆蔻属(Myristica)植物肉豆蔻Myristica fragransHoutt.的干燥成熟种仁,又名迦拘勒、豆蔻、肉果、顶头肉等,分布于马来西亚、印度尼西亚、西印度群岛等地,我国台湾、广东、云南等地有引种栽培。肉豆蔻具有温中行气,涩肠止泻的功能,用于脾胃虚寒,久泻不止,脘腹胀痛,食少呕吐等。现代药理学研究表明,肉豆蔻具有抗菌、消炎、镇静、抗肿瘤等作用,但因种仁的油中富含有可致幻性的黄樟醚(safrol,油中含量>4%)、肉豆蔻醚(myristicin,油中含量>37%)等毒性物质,需经炮制后入药,用于治疗呕吐、腹泻、风湿病、霍乱、胃胀气等。肉豆蔻的炮制方法有8种:包括面裹煨、麦麸煨、滑石粉煨、蒸制、蛤粉制、炒制、土制、制霜等,目前应用多以麦麸煨制为主,并收录在《中国药典》2010版,中医理论认为肉豆蔻炮制的作用在于 “减毒增效”[1-4]。
肉豆蔻中除富含挥发油、脂肪油外,还有苯丙素及木脂素等成分,国内外对其生品、制品的挥发性组分研究报道较多[5-9],但对中等及大极性组分、尤其是炮制前后这些成分变化与药效的相关性等研究还十分有限。杨秀伟等[10]从生品肉豆蔻中分离出多个新木脂素衍生物,也进一步说明肉豆蔻的其他药效组分还待深入认识,这也是对其炮制原理进行深入认识的必要前提。课题在前期对生品肉豆蔻进行脱脂处理后,对其中大极性组分进行了化学研究[11],发现肉豆蔻炮制后乙醇可溶性组分的含量不但有明显变化,而且有新成分产生。为做进一步认识,本文对炮制品脱脂后的95%乙醇提取物进行了化学分离,结合理化性质及谱学分析鉴定出9个化合物,分别为消旋-去氢二异丁香酚(1)、利卡灵-B(2)、愈创木素(3)、肉豆蔻醚(4)、malabaricone A(5)、malabaricone B(6)、malabaricone C(7)、β-谷甾醇(β-sitosterol,8)、胡萝卜苷(daucosterol,9)。其中化合物5~7为马拉巴酮衍生物,文献记载有很好的抗炎活性[12],但国内至今未见其从生品中分离报道。化合物1~7的结构式见图1。
1 仪器与材料
1.1 仪器与试剂
Bruker-ARX-300型、AV-600核磁共振仪(TMS内标,瑞士Bruker公司);FL-220高效液相色谱仪(浙江温岭福立分析仪器有限公司);101-1-BS-Ⅱ电热恒温鼓风干燥箱(上海跃进医疗器械厂);DK-98-1型恒温水浴锅(天津市泰斯特仪器有限公司)。柱色谱用硅胶(200~300目)、薄层色谱用硅胶GF254(10~40μm)和薄层色谱用硅胶 H(10~40μm),均为青岛海洋化工有限公司生产。柱色谱用分析纯试剂、液相用色谱纯试剂均为市售。
肉豆蔻药材购买于河北安国药材市场,产地海南,经沈阳药科大学中药学院中药学教研室孙启时教授鉴定为肉豆蔻Myristica fragransHoutt.的干燥种仁。
1.2 药材炮制品的制备
根据《中国药典》(2010年版一部)[13]对肉豆蔻记述的炮制方法:取生品肉豆蔻用水浸泡6 h,用水量以浸没药材为度,然后取出稍晾,以无明显水印为度,加入麸皮,麸制温度150~160℃,时间15 min,至麸皮呈焦黄色,肉豆蔻呈棕褐色,表面有裂隙时取出,每100 g肉豆蔻用40 g麦麸,依法炮制肉豆蔻10 kg备用。
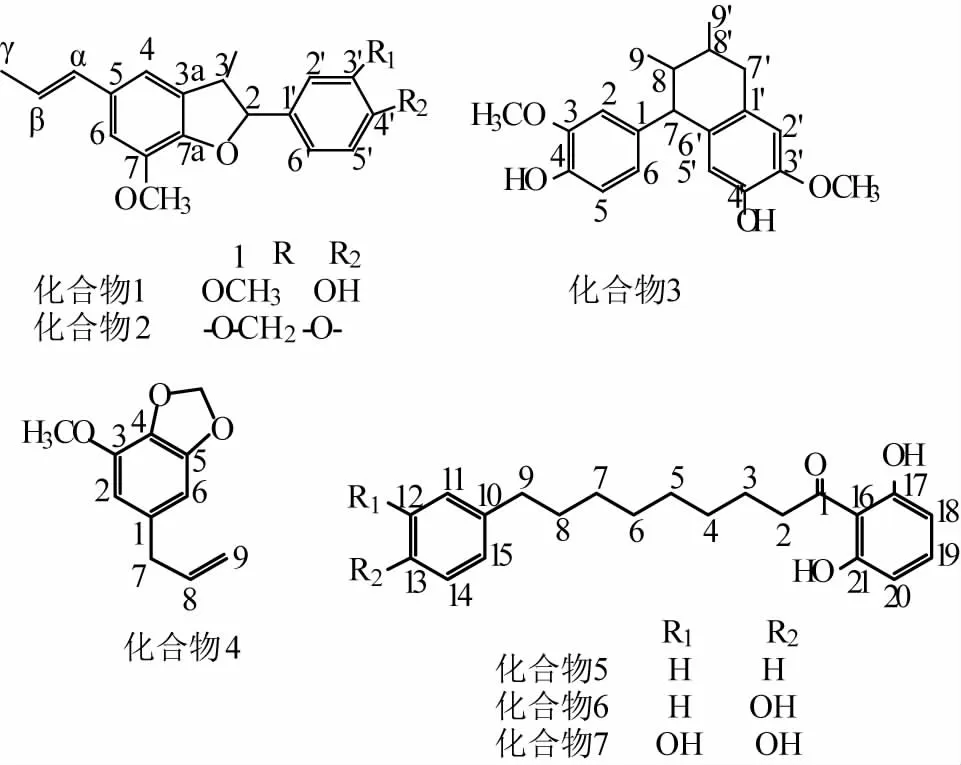
图1 化合物1~7的化学结构
2 提取分离
取麸制品肉豆蔻(10 kg)粉碎后过20目筛,预先用8倍量石油醚(沸程60~90℃)热回流提取3次,每次2 h,进行脱脂处理;药渣用95%乙醇热回流提取3次,每次2 h,提取液过滤合并,减压回收乙醇至无醇味,得浸膏3 197 g,以蒸馏水将浸膏分散后,用等体积醋酸乙酯萃取3次,回收溶剂,得浸膏1 210 g。
取醋酸乙酯浸膏200 g,用石油醚-丙酮系统梯度洗脱(100∶0~1∶1)。对各流分进行硅胶、凝胶柱色谱等方法反复分离,得到化合物1(5.2 mg)、2(0.2 g)、3(5.3 mg)、4(9.5 mg)、5(20 mg)、6(18.5 mg)、7(23.2 mg)、8(15.6 mg)、9(1.6 g)。
3 结构鉴定
3.1 化合物1
白色结晶(石油醚),mp 134~136℃,[α]D±0°(c0.1,CHCl3)。1H-NMR(300 MHz,CDCl3):δH1.38(3H,d,J=6.8 Hz,C3-CH3),1.87(3H,dd,J=6.6,1.5 Hz,H-γ),3.45(1H,m,H-3),3.88(3H,s,C7-OCH3),3.89(3H,s,C3′-OCH3),5.10(1H,d,J=9.4 Hz,H-2),5.63(1H,s,C4′-OH),6.11(1H,m,H-β),6.36(1H,dd,J=15.7,1.5 Hz,H-α,6.77(1H,br.s,H-4),6.79(1H,br.s,H-6),6.88(1H,br.d,J=8.3 Hz,H-5′),6.91(1H,br.d,J=8.3 Hz,H-6′),6.97(1H,br.s, H-2′);13C-NMR(75 MHz, CDCl3)δC17.5(C3-CH3),56.0(C7-OCH3),56.0(C3-OCH3),18.4(C-γ),45.6(C-3),93.8(C-2),108.9(C-2′),109.2(C-6),113.3(C-4),114.0(C-5′),120.0(C-6′),123.5(C-β),130.9(C-(),132.1(C-1′),132.2(C-5),133.2(C-3a),144.1(C-7),145.8(C-4′),146.6(C-7a),146.6(C-3′),以上谱学数据与文献[14]中的一致,故鉴定化合物1为消旋 -去氢二异丁香酚 [(±)-dehydrodiisoeugenol)]。
3.2 化合物2
白色结晶(石油醚-丙酮),mp 89~90℃,1HNMR(300 MHz,CDCl3)δH1.38(3H,d,J=6.8 Hz,C3-CH3),1.87(3H,dd,J=6.6,1.5 Hz,H-γ),3.42(1H,m,H-3),3.89(3H,s,C7-OCH3),5.10(1H,d,J=9.4 Hz,H-2),5.95(2H,s,C3′-OCH2O-C4′),6.11(1H,m,H-β),6.36(1H,dd,J=15.7,1.5 Hz,H-α,6.79(1H,br.s,H-4),6.76(1H,br.s,H-6),6.78(1H,br.d,J=7.9 Hz,H-5′),6.88(1H,br.d,J=7.9Hz,H-6′),6.93(1H,br.s,H-2′);13C-NMR(75 MHz,CDCl3) δC17.9(C3-CH3),55.9(C7-OCH3),18.4(C-γ),45.8(C-3),93.4(C-2),106.8(C-2′),109.2(C-6),134.3(C-4),108.0(C-5′),120.2(C-6′),123.5(C-β),130.9(C-α,134.3(C-1′),132.2(C-5),133.0(C-3a),144.1(C-7),147.6(C-4′),146.5(C-7a),147.9(C-3′),101.0(C3′-OCH2O-C4′),以上谱学数据与文献[15]一致,故鉴定化合物2为利卡灵-B(licarin-B)。
3.3 化合物3
白色结晶,mp 169~171℃。1H-NMR(300 MHz,CDCl3)δH0.78(3H,d,J=5.7 Hz,H-9′),1.02(3H,d,J=5.8 Hz,H-9),1.49(2H,m,H-8,H-8′),2.64(1H,m,J=3.8 Hz,Ha-7′),3.29(1H,m,J=9.5 Hz,Hb-7′),3.35(1H,s,H-7),6.02(1H,s,H-6′),6.50(1H,dd,J=8.0,1.7 Hz,H-6),6.55(1H,s,H-3′),6.60(1H,d,J=1.7 Hz,H-2),6.70(1H,d,J=8.0 Hz,H-5);13C-NMR(75MHz,CDCl3)δC17.2(C-9),20.0(C-9′),35.3(C-8′),39.3(C-7′),43.1(C-8),53.3(C-7),55.6(C3′-OCH3),111.5(C-6′),113.0(C-2),115.3(C-5),116.3(C-3′),121.7(C-6),126.9(C-1′),132.7(C-2′),137.6(C-1),144.2(C-4′),144.8(C-4),145.7(C-5′),147.5(C-3),以上谱学数据与文献[16]一致,故鉴定化合物3为愈创木素(guaiacin)。
3.4 化合物4
黄 色 油 状 物,1H-NMR(300 MHz,CDCl3)δH3.28(2H,d,J=6.7 Hz,H-7),3.88(3H,s,C3-OCH3),5.06(2H,m,H-9),5.92(1H,m,H-8),5.92(2H,s,C4-OCH2O-C5),6.35(1H,br.s,H-2),6.38(1H,br.s,H-6);13C-NMR(75 MHz,CDCl3)δC40.1(C-7),56.4(C3-OCH3),101.1(C4-OCH2O-C5),102.6(C-6),107.5(C-2),115.8(C-9),133.3(C-4),134.5(C-1),137.3(C-8),143.4(C-5),148.7(C-3)。以上谱学数据与文献[17]一致,鉴定其为肉豆蔻醚(myristicin)。
3.5 化合物5
白色针晶(甲醇)。1H-NMR(300 MHz,CDCl3)δH2.61(2H,t,J=7.5 Hz,H-9),3.12(2H,t,J=7.5 Hz,H-2),6.39(2H,d,J=8.1 Hz,H-18,H-20),7.19(1H,t,J=8.1 Hz,H-19),7.24(5H,m,H-11~H-15),9.50(2H,s,C17-OH,C21-OH),1.34(8H,H-5~H-8),1.66(4H,m,H-3,H-4);13C-NMR(75MHz,CDCl3)δC128.4(C-11,C-15),128.2(C-12,C-14),161.1(C-17,C-21),108.4(C-18,C-20),135.6(C-19),110.0(C-16),207.9(C-1),142.9(C-10),125.5(C-13),44.7(C-2),24.3(C-3),29.4(C-4,C-5),29.2(C-6,C-7),31.4(C-8),35.9(C-9),以上谱学数据与文献[18]一致,鉴定其为 Malabaricone A。
3.6 化合物6
白色针晶(甲醇)。1H-NMR(300 MHz,CDCl3)δH2.54(2H,t,J=7.5 Hz,H-9),3.11(2H,t,J=7.5 Hz,H-2),6.39(2H,d,J=8.1 Hz,H-18,H-20),7.25(1H,t,J=8.1 Hz,H-19),6.78(2H,d,J=8.4Hz,H-11,H-15),7.05(2H,d,J=8.4 Hz,H-12,H-14),7.25(1H,t,J=8.1 Hz,H-19),9.42(2H,s,C17-OH,C21-OH),9.07(1H,s,C13-OH),1.32(8H,H-5~H-8),1.69(4H,m,H-3,H-4);13C-NMR(75 MHz,CDCl3)δC129.4(C-11,C-15),115.0(C-12,C-14),161.1(C-17,C-21),108.5(C-18,C-20),135.6(C-19),110.0(C-16),207.8(C-1),135.2(C-10),153.3(C-13),44.7(C-2),24.3(C-3),29.4(C-4~C-6),29.2(C-7),31.2(C-8),35.6(C-9)。以上谱学数据与文献[18]一致,鉴定其为Malabaricone B。
3.7 化合物7
白色针晶(甲醇)。1H-NMR(600 MHz,DMSO-d6)δH2.61(2H,t,J=7.8 Hz,H-9),3.01(2H,t,J=7.2 Hz,H-2),6.35(2H,d,J=7.8 Hz,H-18,H-20),7.19(1H,t,J=7.8 Hz,H-19),6.54(1H,d,J=2.4 Hz,H-11),6.40(1H,dd,J=7.8,2.4 Hz,H-15),6.60(1H,d,J=7.8 Hz,H-14),7.19(1H,t,J=8.1 Hz,H-19),11.55(2H,s,C17-OH,C21-OH),8.54(2H,s,C12-OH,C13-OH),1.27(8H,H-5~H-8),1.58(2H,m,H-3),1.47(2H,m,H-4);13C-NMR(75 MHz,DMSO-d6)δC115.2(C-11),143.8(C-12),141.8(C-13),114.9(C-14),120.0(C-15),161.8(C-17,C-21),107.5(C-18,C-20),135.7(C-19),110.1(C-16),207.3(C-1),135.3(C-10),44.6(C-2),24.3(C-3),29.2(C-4~C-6),28.9(C-7),31.4(C-8),35.3(C-9)。以上谱学数据与文献[18]一致,鉴定其为Malabaricone C。
3.8 化合物8
白色针晶(丙酮),mp 136~138℃。Lieberman-Burchard反应阳性,将该单体化合物与已知对照品β-谷甾醇共薄层,在3种溶剂系统下Rf值均一致,故鉴定化合物其为β-谷甾醇。
3.9 化合物9
白色粉末(甲醇),mp>300℃。Lieberman-Burchard反应阳性,Molish反应阳性。将该单体化合物与胡萝卜苷对照品共薄层,在3种溶剂系统下Rf值一致,混合后测定熔点不下降,鉴定其为胡萝卜苷。
4 讨论
对肉豆蔻中的挥发性组分炮制前后的变化,杨秀伟等[19]以气相、气相-质谱(GC-MS)联用技术对生品、炮制品都进行过分析研究,至今已检出100余个化学成分,其中已鉴定出的化学结构有80余种。另外,根据肉豆蔻炮制后挥发油的变化情况,认为炮制后挥发油含量都有不同程度的降低,其颜色、比重、旋光度、折光率亦有改变,毒性成分黄樟醚、肉豆蔻醚的含量也有不同程度的降低。我们前期对肉豆蔻成分进行的研究中也发现,肉豆蔻炮制前后的甲醇提取物的化学成分及含量组成均有变化。国外学者从生品肉豆蔻的外种皮中分离得到了马拉巴酮衍生物[20],且有很好的抗炎、抗菌活性,但至今未见国内有过分离报道,我们在前期的生品中也未能发现该类成分,推测其在原植物种仁中含量较少,但经炮制加工后,此类化合物却易于分离得到,推测炮制带来了含量的明显变化,然而是否为基于内源性成分在炮制条件下进行的转化却不得而知,尤其是炮制带来的 “减毒增效”作用是否与该类成分存在必然联系,尚需深入研究才能得出正确的结论。
[1]代冬梅,贾天柱,徐洪亮,等.肉豆蔻炮制及现代研究进展[J].中成药,2005,27(12):1416-1419.
[2]代冬梅,贾天柱,相宇,等.中药肉豆蔻历史沿革研究[J].时珍国医国药,2005,16(8):707-708.
[3]天津市药品检验所中药组.关于肉豆蔻炮制方面有关问题的探讨[J].中草药通讯,1979,10(1):16.
[4]俞永琼.浅谈肉豆蔻的炮制[J].云南中医中药杂志,2001,22(3):46.
[5]李铁林,周杰,江文君,等.炮制对肉豆蔻挥发油成分及肉豆蔻醚含量影响的研究[J].中国中药杂志,1990,15(8):23-25.
[6]赖闻玲,曾志,陈亿新,等.中药复方中泻下组份化学成分研究(Ⅱ)肉豆蔻挥发油[J].中草药,2002,33(7):596-598.
[7]刘博,陈开勋,陈渭萍,等.肉豆蔻超临界二氧化碳萃取工艺及其精油的GC-MS分析研究[J].香料香精化妆品,2003,31(4):17-19.
[8]王莹,杨秀伟,陶海燕,等.商品肉豆蔻挥发油成分的GCMS分析[J].中国中药杂志,2004,29(4):339-342.
[9]王莹,杨秀伟.印度尼西亚产肉豆蔻挥发油成分的GCMS分析[J].中华中医药杂志,2007,22(9):603-606.
[10]杨秀伟,黄鑫,艾合买提·买买提.肉豆蔻中新的新木脂素类化合物[J].中国中药杂志,2008,33(4):397-402.
[11]李秀芳,吴立军,贾天柱,等.肉豆蔻的化学成分[J].沈阳药科大学学报,2006,23(11):698-701.
[12]Shinohara C, Mori S, Ando T, et al.Arg-gingipain inhibition and anti-bacterial activity selective for Porphyromonas gingivalis by malabaricone C[J].Biosci Biotechnol Biochem,1999,63(8):1475-1477.
[13]国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:127.
[14]Enriquez R.G.,Chavez M.A.,ReynoldsW.F.Phytochemical investigations of plants of the genus aristolochia,Isolation and NMR spectral characterization of eupomatenoid derivatives[J].JNat Prod,1984,47(5):896-899.
[15]Wenkert E,Gottlieb H E,Gottlieb O R,et al.13C-NMR Spectroscopy of neolignans[J].Phytochem,1976,15(10):1547-1551.
[16]Fo R B,De Carvalho MG,Gottlieb O R.The chemistry of Brazilian Myristicaceae[J].Planta Med,1984,50(1):53-55.
[17]Benevides PJC,Sartorelli P,Kato MJ.Phenylpropanoids and neolignans from Piper regnellii[J].Phytochem,1999,52(2):339-343.
[18]Purushothaman K K,Sarada A,Connolly JD.Malabaricones A-D,Novel Diarylnonanoids from Myristica malabarica Lam(Myristicaceae)[J].JChem Soc,Perkin TransⅠ,1977,(5):587-588.
[19]黄鑫,杨秀伟.不同炮制品肉豆蔻挥发油成分的GC-MS分析[J].中国中药杂志,2007,32(16):1669-1675.
[20]Orabi K Y,Mossa J S,EI-Feraly F S.Isolation and characterization of two antimicrobial agents from Mace(Myristica Fragrans)[J].J Nat Prod,1991,54(3):856-859.
Isolation and Identification of Chem ical Constituents from Processed Myristica fragrans Houtt.
ZHAO Guang-yun,WANG Xiao-xia,GAO Hui-yuan
(Key Laboratory of Structure-Based Drug Design&Discovery of Ministry of Education,Shenyang Pharmaceutical University,Shenyang611001,China)
Objective:To isolate the chemical constituents from the processed Myristica fragrans Houtt.,and identify their structures.MethodsMyristica fragransHoutt.was delt with the wheat bran processing method.Compoundswere isolated by Sephadex LH-20,ODS column chromatographies,and their structureswere identified on the basis of the physico-chemical properties and their spectral data.Results:Nine compoundswere obtained and they were elucidated as(±)-dehydrodiisoeugenol(1),licarin-B(2),guaiacin(3),myristicin(4),malabaricone A(5),malabaricone B(6),malabaricone C(7),β-sitosterol(8),daucosterol(9),respectively.Conclusion:Compounds5~7 were identified asmalabaricone derivatives,while they have not reported from crudematerial of this plant in China,and processing preparation was supposed to be the reason for the contents increasing of these components.
Myristica fragransHoutt.;Processing;Chemical constituents;Structrual identification
*高慧媛,Tel:(024)23986482,E-mail:gaohuiyuan1997@yahoo.com.cn
2011-09-20)

