D-阿洛酮糖的分离纯化
邢庆超,沐万孟,江 波,*,周榴明,储菲菲,张 涛
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214122; 2.罗盖特美国公司,基奥卡克52632,美国)
D-阿洛酮糖的分离纯化
邢庆超1,沐万孟1,江 波1,*,周榴明2,储菲菲1,张 涛1
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214122; 2.罗盖特美国公司,基奥卡克52632,美国)
通过生物法以D-果糖为原料生产D-阿洛酮糖,产物的分离纯化采用阴阳离子交换树脂脱色脱盐,再通过DTF-Ca2+型离子交换树脂进行分离纯化。最佳分离条件:柱温60℃,10mL进样量,1mL/min流速。通过高效液相色谱测定,分离得到的D-阿洛酮糖纯度为98.3%。
D-阿洛酮糖,分离,离子交换树脂,纯化
1 材料与方法
1.1 材料与仪器
D-阿洛酮糖标样 Sigma公司;DTF-Ca2+色谱分离树脂、阳离子交换树脂001×7、阴离子交换树脂313 江苏苏青集团;其他试剂 均为分析纯。
Agilent 1200系列高效液相色谱 Agilent公司; Sugar-PakTM1糖柱 Waters公司;HL-2B型数显恒流泵、DBS-100自动部分收集器 上海沪西分析仪器厂。
1.2 实验方法
1.2.1 D-阿洛酮糖的生物酶法转化 根据报道,D-塔格糖-3-差向异构酶(D-tagatose-3-epimerase,DTE)家族可以催化D-果糖生成D-阿洛酮糖[6-7],本实验室构建的CS-DTE酶,是DTE酶家族中的一种,可以应用于生物法生产D-阿洛酮糖。基本反应条件为:以1L酶反应器为例,含有700g/L的D-果糖,50mmol/L的Tris-HCl,100mmol/L的NaCl,10mmol/L的Co2+,pH8.0。该溶液500mL与发酵得到的含有CS-DTE酶的湿菌体充分混合,在60℃反应10h,得到D-阿洛酮糖和D-果糖的混合物。
1.2.2 D-阿洛酮糖粗样品处理 经过酶转化得到的D-阿洛酮糖和D-果糖的混合物,分批以8000r/min离心除去菌体,再经高温煮沸使溶液中酶蛋白变性沉淀,再次以12000r/min彻底离心除去溶液中蛋白质,获得混合的糖溶液。
1.2.3 D-阿洛酮糖粗样品脱盐脱色 将再生好的阳离子交换树脂001×7和阴离子交换树脂313分别装填在两根长300mm,直径25mm的玻璃柱中。用串联方式,去离子水先通过阳离子柱,再通过阴离子柱,待平衡后将混合糖液泵入,进行脱色与脱盐,以除去糖液中的Co2+和NaCl等盐类。基本条件为:流速1.0mL/min,柱体积分别为50mL,用去离子水洗脱,收集样品。
1.2.4 离子交换色谱柱层析 脱盐脱色后的D-阿洛酮糖和D-果糖的混合物,通过一根长1m,内径2cm的带有恒温夹套的层析柱,柱内填充处理好的DTF-Ca2+色谱分离树脂,以去离子水作为流动相,分别控制不同温度50、60、70℃,不同填料柱体积200、300、400mL,不同进样量5、10、15mL,不同流速0.5、1、1.5mL/min,洗脱D-阿洛酮糖和D-果糖的混合糖液,并采用分部收集器收集洗脱样品。
1.2.5 HPLC检测D-阿洛酮糖的含量 收集后的样品通过高效液相色谱(HPLC),与D-阿洛酮糖和D-果糖标准样品比较,定性和定量的检测各洗脱样品中的D-阿洛酮糖和D-果糖的浓度。HPLC的检测条件为:色谱柱:Sugar-PakTM1;柱温:85℃;流动相:脱气后的去离子水;流速:0.4mL/min;进样量: 10μL;检测器:示差折光检测器。
1.2.6 D-阿洛酮糖和D-果糖的分离度计算 HPLC检测后的数据,绘制分离曲线,并计算分离度,D-阿洛酮糖和D-果糖的分离度定义为[8]:
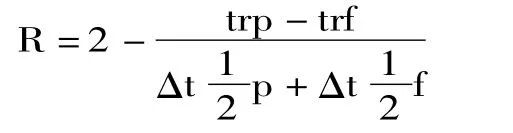
其中:trp为D-阿洛酮糖保留时间,trf为D-果糖保留时间为D-阿洛酮糖色谱峰的半峰宽度为D-果糖色谱峰的半峰宽度;以上单位均为min。
2 结果与讨论
2.1 D-阿洛酮糖的生物酶法转化率
通过DTE酶法,以D-果糖为底物,在上述条件下生成D-阿洛酮糖,并通过离心,阴阳离子柱除去蛋白、盐分等杂质,经HPLC检测(见图1),生物酶法生产D-阿洛酮糖转化率为27.9%。
2.2 D-阿洛酮糖的离子交换树脂分离
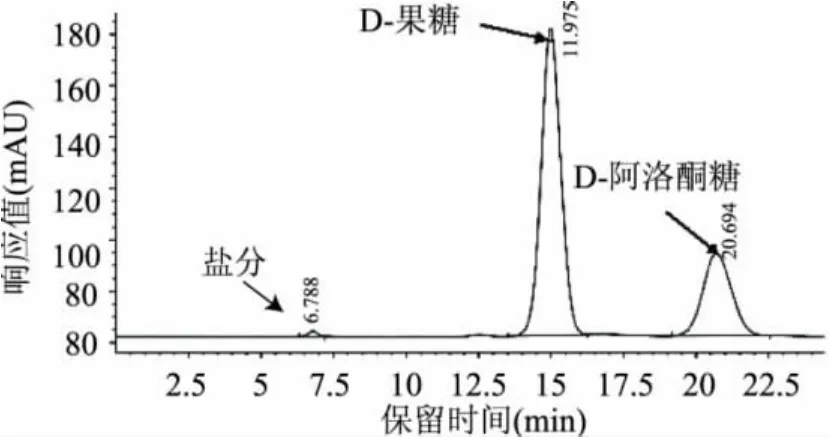
图1 HPLC检测D-阿洛酮糖含量
2.2.1 不同温度对分离效果的影响 根据HPLC检测温度推算,确定基本条件:进样量10mL,去离子水为流动相,流速1mL/min,填料体积为200mL,分别考察柱温为50、60、70℃时,对分离效果的影响。
如图2所示,通过分离度计算公式,在柱温为50、60、70℃时,分离度依次为0.97、1.23和1.03,可见60℃分离度最大,效果较好,并以此作为下一步探讨分离效果的基本条件。

图2 温度对分离效果的影响
2.2.2 不同填料柱体积对分离效果的影响 确定基本条件:进样量10mL,去离子水为流动相,流速1mL/min,柱温60℃,分别考察填料柱体积为200、300、400mL时,对分离效果的影响。
如图3所示,当填料柱体积为200、300、400mL时,计算分离度为0.97、1.37和1.57,可见填料柱体积为400mL时,分离度最大。根据色谱理论,提高填料柱体积,可以提高理论塔板数,有效提高分离效果,但是局限于采用柱子的体积限制,填料最大体积只能达到400mL,但这为今后工业分离D-果糖和D-阿洛酮糖提供了参考。
2.2.3 不同进样量对分离效果的影响 分别采用5、 10、15mL的进样量,基本条件为:去离子水为流动相,流速1mL/min,柱温60℃,400mL填料柱体积,考察不同进样量对分离效果的影响。

图3 填料柱体积对分离效果的影响
如图4所示,当进样量分别为5、10、15mL时,计算分离度分别为1.58、1.57和0.47,可以看出5mL进样量的分离度最大,但是与10mL进样量比较,差别并不十分明显,而15mL进样量时,分离度非常小,分离效果很不理想。可以看出,当较小进样量时,柱子本身选择性压力较小,当大进样量时,柱子的负荷很大,在有效塔板数不变时,严重影响了柱效,分离效果很差。同时考虑到分离效率问题,5mL进样量和10mL进样量比较差别不大,因此,选择10mL进样量作为分离的基本条件。
2.2.4 不同流速对分离效果的影响 分别以0.5、1、1.5mL/min作为流动相的流速,在进样量10mL,去离子水为流动相,填料体积为400mL,柱温60℃时,考察不同流速对分离效果的影响。
如图5所示,当流速分别为0.5、1、1.5mL/min,计算分离度分别为1.09、1.57和1.55。从图5可以看出,在流速为1mL/min时,分离度最大、分离效果最好。
2.2.5 最佳分离条件 通过以上实验,可以确定进样量10mL,去离子水为流动相,流速1mL/min,柱温60℃,400mL填料柱体积为最佳分离条件。将分离得到的样品通过HPLC检测,如图6所示,保留时间14.1min和19.5min分别为D-果糖和D-阿洛酮糖。在上述分离条件下,可以得到纯度为98.3%的D-阿洛酮糖。
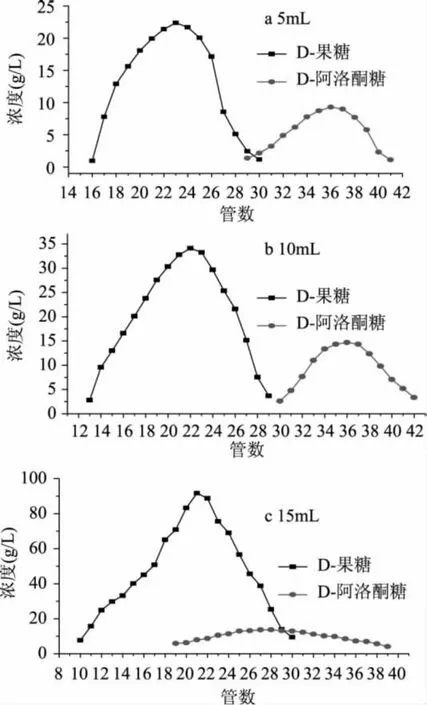
图4 不同进样量对分离曲线的影响
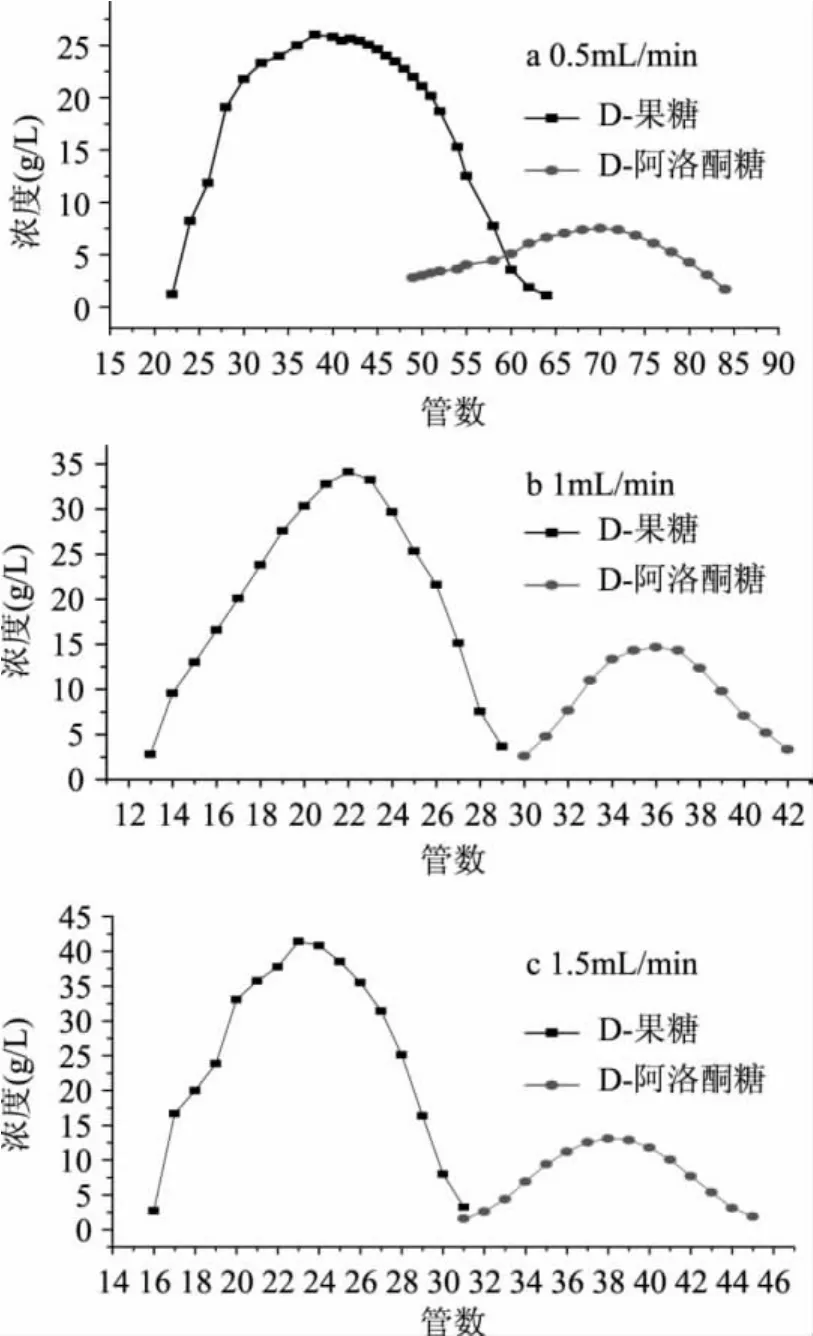
图5 不同流速对分离效果的影响
3 结论
3.1 D-阿洛酮糖的生物酶法制备,首次采用Ca2+型离子交换树脂对其产物分离纯化,实验证明,柱温、填料柱体积、进样量、流速均对分离效果有一定影响,其中填料柱体积直接影响理论塔板数,对分离效果影响最大,这为今后批量生产D-阿洛酮糖奠定了实验基础。
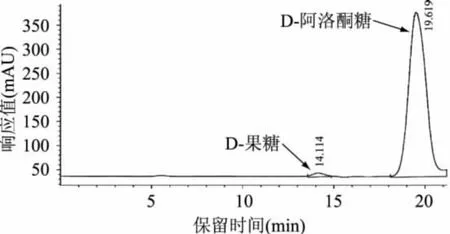
图6 最佳分离条件下HPLC检测图
3.2 最佳的分离条件为,以Ca2+型DTF离子交换树脂为填料,400mL填料体积,装填在带恒温夹套的长1m,内径2cm的层析柱内,在以去离子水作为流动相,10mL进样量,1mL/min流速,柱温60℃时,分离得到纯度为98.3%的D-阿洛酮糖。
[1]邓健仙.功能性食品甜味剂[M].北京:中国轻工业出版社,1997:34-39.
[2]胡国华.功能性高倍甜味剂[M].北京:化工出版社,2008: 3-7.
[3]Matsuo T,Tanaka T,Hashiguchi M,et a1.Metabolic effects of D-psicose in rats:studies on faecal and urinary excretion andcaecal fermentation[J].Asia Pac J Clin Nutr,2003,12(2): 225-231.
[4]Sun Y,Hayakawa S,Izumori K.Antioxidative activity and gelling rheological properties of dried egg white glycated with a rare ketohexose through the maillard reaction[J].J Food Sci,2004,69(6):427-436.
[5]钱永,戴军,彭奇均.离子交换树脂层析法分离木糖醇结晶母液[J].离子交换与吸附,2005,21(2):112-120.
[6]Longtao Zhang,Wanmeng Mu,Bo Jiang,et al.Characterization of D-tagatose 3-epimerase from Rhodobacter sphaeroides that converts D-fructose into D-psicose[J].Biotechnology Letters,2009,31:857-862.
[7]沐万孟,张涛,江波.稀有糖的生物转化生产策略: Izumoring方法[J].中国生物工程杂志,2007,27:129-136.
[8]刘佐才,候平然.果糖与葡萄糖的分离[J].北京理工大学学报,2001,21(6):782-785.
Separation and purification of D-psicose
XING Qing-chao1,MU Wan-meng1,JIANG Bo1,*,ZHOU Liu-ming2,CHU Fei-fei1,ZHANG Tao1
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China; 2.Roquette America,Keokuk,IA 52632,United States)
The D-psicose was convered from D-fructose by the biological production.The technology of separation and purification of D-psicose was established according to the methods of ion exchange resin desalting and bleaching,DTF-Ca2+cation exchange chromatography.The optimal Ca2+cation exchange chromatography conditions:column temperature of 60℃,the input volume of 10mL and the flow velocity of 1mL/min.The purity of D-psicose was 98.3%.
D-psicose;separation;ion exchange resin;purification
TS241
B
1002-0306(2011)09-0236-04
甜味剂是食品添加剂和动物饲料行业中的一项重要产品,在世界范围内的应用量位居各添加剂之首,传统的甜味剂如蔗糖,一般都具有高热量、高吸收率,被认为是引起肥胖症、糖尿病、心血管疾病、龋齿等的一项重要因素[1-2]。D-阿洛酮糖是一种自然界天然存在极少的稀有糖,其食用后不易被人体代谢,几乎不产生能量,无腐蚀,而且具有良好的食品加工特性,作为一种新型的功能性甜味剂配料,在食品开发中可以替代传统甜味剂,成为功能性食品添加剂研究领域的一项热门内容[3-4]。为了进一步研究D-阿洛酮糖的性质,推动其在食品领域中的应用,获得大量、价格合理、纯度较高的D-阿洛酮糖便尤为重要。D-阿洛酮糖是D-果糖的C-3位差向异构体,都属于单糖,经研究发现,可以用D-果糖为底物,通过D-塔格糖-3-差向异构酶家族,生物酶法转化大量生产D-阿洛酮糖,但产物为D-阿洛酮糖和D-果糖的混合物,并且D-果糖含量较高,因此研究D-阿洛酮糖和D-果糖的分离技术,对今后工业化生物法生产D-阿洛酮糖具有重要的指导意义[3-4]。根据色谱相关理论,单糖之间可以利用阳离子交换树脂实现分离,原理是通过配位交换,不同的糖与阳离子形成配位络合物的形成方式、过程和其稳定程度均不同,从而使不同的糖在阳离子交换树脂上具有不同的保留行为,综合二价、三价阳离子型树脂的分离情况,二价的Ca2+和Pb2+型树脂分离效果明显优于三价的Fe3+和Al3+树脂,Pb2+型树脂的分离效果显著优于 Ca2+型树脂[5],但是,因其毒性较大,选用Ca2+型阳离子树脂更适合食品级的分离研究,并取得了良好效果。
2010-11-30 *通讯联系人
邢庆超(1985-),男,硕士,研究方向:食品酶技术。
中央高校基本科研业务费专项(JUSRP31002);江苏省社会发展科技支撑项目(BE2010626)。

