胶束电动毛细管电泳法分离检测5种β-内酰胺类抗生素
姚 晔,邓 宁,余沐洋,何建波*
(合肥工业大学化工学院,农产品生物化工教育部工程研究中心,安徽 合肥 230009)
胶束电动毛细管电泳法分离检测5种β-内酰胺类抗生素
姚 晔,邓 宁,余沐洋,何建波*
(合肥工业大学化工学院,农产品生物化工教育部工程研究中心,安徽 合肥 230009)
采用毛细管电泳法,基于胶束电动模式与有机添加剂协同作用,分离检测5种β-内酰胺类抗生素。考察运行缓冲液的构成及各组分浓度、pH值、分离电压等因素对电泳分离的影响。优化后的电泳运行缓冲液包含20mmol/L Na2HPO4-20mmol/L NaH2PO4 (pH8.5),20mmol/L十二烷基硫酸钠和体积分数25%甲醇。在18kV电压下5种抗生素在15min内达到基线分离。各组分线性关系良好,检出限5.3~8.1mg/L,进样精密度RSD 3.8%~5.5%。研究表明,对分子结构特别相近的抗生素,通过表面活性剂胶束准固定相与有机添加剂协同作用来改善分离效果是可行的。
胶束毛细管电泳;有机添加剂;β-内酰胺抗生素;基线分离
β-内酰胺类抗生素在兽医药治疗和防治牲畜疾病方面有着广泛的应用,但是不合理的使用会导致其在动物组织中残留。长期食用抗生素残留的食物,会导致人体产生耐药性、破坏体内正常菌种平衡、诱发过敏反应等作用[1-3],因此动物性食品中的抗生素残留问题日益受到重视。目前检测抗生素的主要方法是液相色谱、液相-质谱联用和毛细管电泳等方法[4-5],其中仍在快速发展中的高效毛细管电泳法,因具有分离柱效高、试样用量少、分析时间短、适用范围广等特点,而在食品与环境安全[1-3,6-12]、生命科学、医药与临床、化学与化工等众多领域显示出广阔的应用前景。迄今已发展出毛细管区带电泳(capillary zone electrophoresis,CZE)、胶束电动毛细管色谱法(micellar electrokinetic capillary chromatography,MECC)、毛细管等电聚焦(capillary isoelectric focusing,IEF)、毛细管等速电泳(capillary isotachophoresis,CITP)等主要模式[1],其中MECC将胶束增溶和电动移动结合起来以强化分离优势[13-15],并在准固定相使用类型方面进展迅速。
本研究对畜牧业常用的5种β-内酰胺类抗生素进行毛细管电泳分离检测,包括头孢噻呋(Ceftiofur)、头孢唑啉(Cephazoline)、头孢氨苄(Cephalexin)、氨苄西林(Ampicillin)和青霉素钠(Penicillin G)。近年来一些研究者开展了这些抗生素在不同混合体系中毛细管电泳灵敏检测的研究[7-13],但未见针对这5种抗生素共存体系的报道。该混合体系包含两种在分子结构、相对分子质量和pKa值等方面差异甚微的抗生素:头孢氨苄(C16H17N3O4S,相对分子质量347.39,pKa1=2.5[16])和氨苄西林(C16H19N3O4S,相对分子质量349.40,pKa1=2.4[11]),给分离带来很大困难。本实验探索分子结构特别相近抗生素的有效分离方法,选择MECC模式的毛细管电泳技术,通过表面活性剂胶束准固定相与有机添加剂协同作用来改善分离效果。
1 材料与方法
1.1 试剂与仪器
氨苄西林(98%)、头孢噻呋(87.5%)、头孢唑啉(95%)中国药品生物制品检定所;青霉素钠(98%)、头孢氨苄(98%) 合肥博美生物科技有限公司;头孢氨苄胶囊 哈药集团制药六厂;磷酸二氢钠、磷酸氢二钠、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甲醇均为分析纯;实验用水为二次蒸馏水。
CL1020高效毛细管电泳仪(配备紫外检测器) 北京彩陆科学仪器有限公司;50μm未涂层熔融石英毛细管(有效长度50cm) 河北永年光导纤维厂;UV-2550紫外可见分光光度计 日本岛津公司;HS2060A型超声波清洗器 昆山超声仪器有限公司;TD5GL型离心机 湖南湘仪离心机仪器有限公司。
1.2 标准溶液的配制
准确称取5种抗生素标准品各10.0mg,青霉素钠、氨苄西林、头孢氨苄用水溶解,头孢噻呋和头孢唑啉用甲醇溶解,配制成质量浓度为1.00g/L的标准储备液。于4℃冰箱内避光保存。分别移取适量上述溶液,配制成含5种抗生素质量浓度均为0.100g/L的混合工作液。实验所用溶液使用前均用孔径为0.45μm的微孔滤膜过滤。
1.3 电泳方法及检测条件
采用MECC模式毛细管电泳法对5种抗生素进行分离测定,以SDS为胶束,并以甲醇为有机添加剂。测定前毛细管清洗顺序为:1mol/L HCl溶液冲洗5min,二次蒸馏水清洗5min,1mol/L NaOH清洗10min,二次蒸馏水冲洗10min,最后用缓冲液冲洗10min。两次测定之间用缓冲液平衡5min。高差进样,高度差为10cm,检测波长200nm。通过各种参数的考察,确定优化的电泳条件为:磷酸盐缓冲液20mmol/L(pH8.5),SDS 20mmol/L,甲醇体积分数25%,分离电压18kV。
2 结果与分析
2.1 电泳条件优化
2.1.1 电泳分离模式的选择
由于头孢氨苄和氨苄西林的分子结构仅在β-内酰胺环邻接的杂环上存在差异,导致迁移速度几近相等。在普通CZE模式中,优化各种参数均未能实现两种抗生素的分离,如图1A所示,两者的谱峰几乎完全重叠在一起(电泳条件:磷酸盐浓度20mmol/L,pH8.5,分离电压20kV)。保持这些条件不变,向运行液中添加20mmol/L SDS(其临界胶束浓度8mmol/L)和体积分数0.25的甲醇,分离效果显著改善,如图1B所示。在MECC模式下,带负电的SDS胶束朝阳极方向电迁移(与电渗流相反),使胶束准固定相和水醇相的迁移速度产生差异,而不同抗生素在两相中的分配系数不同,导致迁移速度差异变大。最佳SDS浓度确定为20mmol/L。
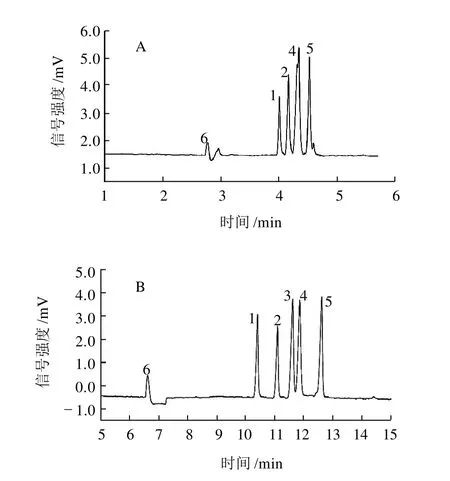
图1 5种抗生素的CZE模式(A)与MECC模式(B)电泳图Fig.1 Electropherograms of five antibiotics in the modes of CZE (A) and MECC (B)
2.1.2 缓冲液pH值和浓度的选择
缓冲溶液的pH值会影响毛细管内壁的硅羟基的荷电状态,从而显著地影响电渗流的大小,因此优先考虑优化pH值。运行缓冲溶液为20mmol/L磷酸盐,20mmol/L的SDS及体积分数0.25的甲醇。在pH7.0时,5种抗生素分离度高,但出峰时间在20~40min之间,分析时间过长;随着pH值增大,分析时间缩短,分离度降低;在pH8.5时,出峰时间最短,在11~15min之间,同时仍能实现基线分离,因此最佳pH值确定为8.5。
运行缓冲溶液的浓度会从缓冲容量、毛细管内扩散层的厚度、以及电泳介质导电性等方面对分离产生影响。在其他条件固定的前提下,在5~80mmol/L范围内考察缓冲溶液浓度对分离度的影响,结果表明,浓度较低时分离度较好,但分析时间长;而浓度过高时电流值过大,基线不稳。综合考虑,选择缓冲液浓度为20mmol/L。
2.1.3 甲醇添加量的选择
研究表明,在缓冲液中加入有机添加剂,能明显抑制电渗流,改善分离效果,并会使峰型变对称,改善拖尾现象。保持运行液为pH8.5、20mmol/L磷酸盐并含20mmol/L的SDS不变,甲醇体积分数在5%~30%之间变化,迁移时间和分离度的变化如图2所示。可以看出,随着甲醇体积分数的增加,分离效果得到改善,综合考虑分离效率和分析时间,选择甲醇体积分数为25%。
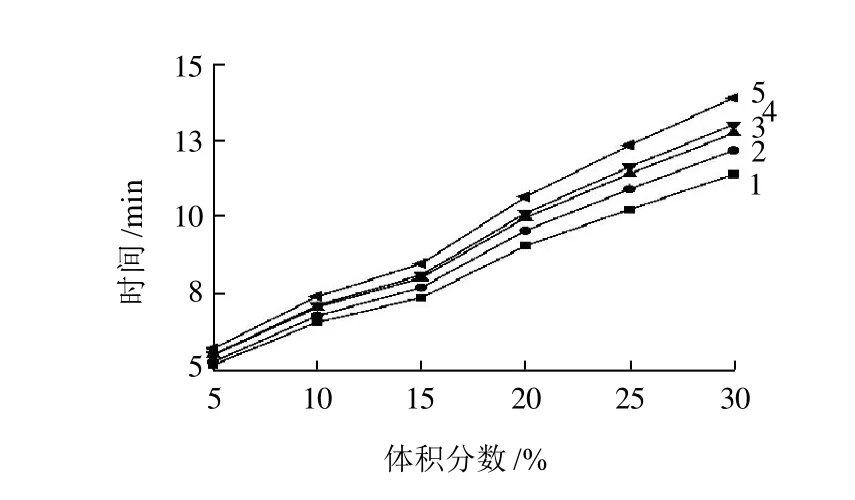
图2 甲醇体积分数对分离时间的影响Fig.2 Effect of amount of methanol addition on migration times of fiveβ-lactam antibiotics
2.1.4 分离电压的选择
在确定了缓冲溶液组成的条件下,考察了分离电压对迁移时间和分离度的影响。一般来说,提高电压会提高电渗流速度,但也容易引起分离度下降以及焦耳热效应。在12~28kV电压范围内考察了分离效果,选择最佳分离电压为18kV。
2.1.5 进样时间的选择
进样采用高差进样法,高差为10cm,进样时间从5s开始,5s为步长进行选择,峰高随着进样时间的延长而增加,当进样时间较少时,峰高太小;进样时间为40s时,峰高和峰型都较好,5种试样可以达到基线分离;当进样时间超过40s时,部分物质的检测峰重叠,不能分离。所以进样时间确定为40s。在前述各种参数的优化条件下,测得的5种抗生素电泳图见图3。
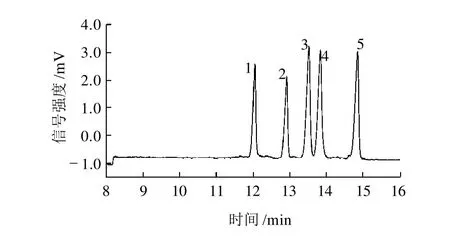
图3 最优条件下5种抗生素的电泳图Fig.3 Electropherogram of five β-lactam antibiotics under optimum conditions
2.2 精密度、检测线性范围和检出限分析
按优化后的条件重复进样8次,各种抗生素的迁移时间与峰面积的相对标准偏差(RSD)见表1。

表1 迁移时间和峰面积的精密度Table 1 Precision of the determination of the migration times and peak areas of five β-lactam antibiotics
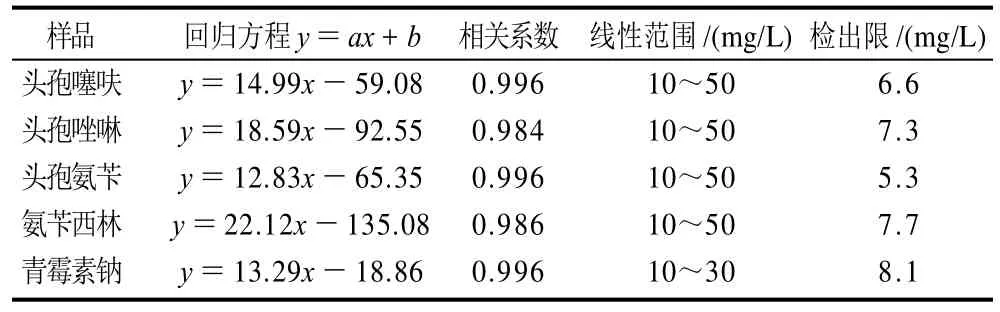
表2 线性方程与检出限Table 2 Regression equations and detection limits for fiveβ-lactam antibiotics
2.3 实际样品检测
采用优化过的方法对市售头孢氨苄胶囊(有效成分19%)进行检测。称取适量药品粉末,加水并超声处理40min,使药品中的头孢氨苄充分溶解。置于离心机中5000r/min离心10min,移取上层清液,用微孔滤头过滤后上机检测,结果见图4。图4中最强峰的迁移时间为13.5min,由此可以判断其为头孢氨苄的吸收峰。按照峰面积计算,头孢氨苄胶囊中的有效成分质量分数为18%,结果与药品的有效成分含量基本相符。可见此方法可以用于实验样品的检测。
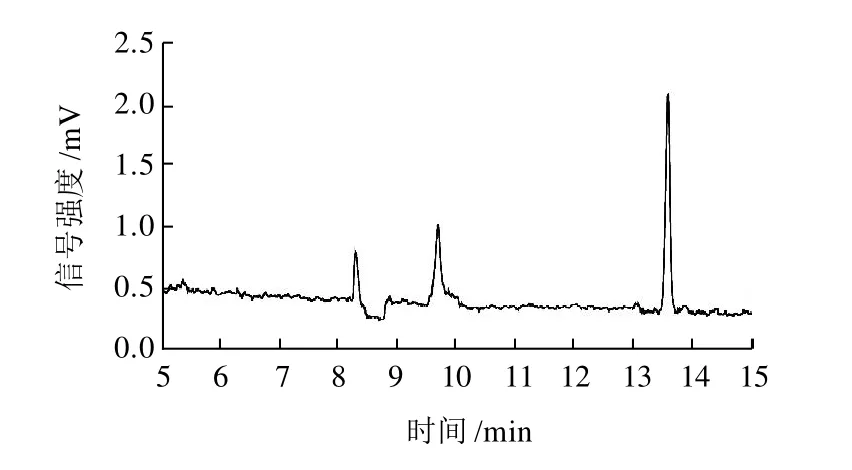
图4 最优条件下头孢氨苄胶囊的电泳图Fig.4 Electropherogram of ampicillin capsule under optimum conditions
3 结 论
通过考察电泳分离模式、缓冲溶液的pH值和浓度、分离电压、甲醇含量等重要影响因素,确定了分离头孢噻呋、头孢唑啉、头孢氨苄、氨苄西林和青霉素钠的最优化电泳条件,实现了5种抗生素在15min内完全分离,证明了通过适宜的表面活性剂胶束准固定相及与有机添加剂协同作用,可以显著改善分子结构相近的同类型抗生素的分离效果。优化的电泳运行缓冲液包含20mmol/L Na2HPO4-20mmol/L NaH2PO4(pH8.5),20mmol/L SDS和体积分数25%的甲醇。各组分线性关系良好,检出限5.3~8.1mg/L,进样精密度RSD3.8%~5.5%。该方法稳定可靠,精密度高,且操作简便,分析成本低,为同时快速分离检测多种β-内酰胺类抗生素提供了一种有效方案。
[1] GARCIA-RUIZ C, MARINA M L. Recent advances in the analysis of antibiotics by capillary electrophoresis[J]. Electrophoresis, 2006, 27(1):266-282.
[3] CASTRO-PUYANA M, CREGO A L, MARINA M L. Recent advances in the analysis of antibiotics by CE and CEC[J]. Electrophoresis, 2008,29(1): 274-293.
[4] MASTOVSKA K, LIGHTFIELD A R. Streamlining methodology for the multiresidue analysis ofβ-lactam antibiotics in bovine kidney using liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A,2008, 1202(2): 118-123.
[5] 张琦, 叶能胜, 谷学新, 等.β-内酰胺类抗生素分析检测技术及其应用研究进展[J]. 化学通报, 2009, 72(5): 394-400.
[6] 邢晓平. 毛细管电泳-电化学检测法测定鸡蛋中残留四环素类抗生素[J]. 食品科学, 2007, 28(10): 470-473.
[7] PUIG P, TEMPELS F W A, SOMSEN G W, et al. Use of large-volume sample stacking in on-line solid-phase extraction-capillary electrophoresis for improved sensitivity[J]. Electrophoresis, 2008, 29(6): 1339-1346.
[8] PUIG P, BORRULL F, CALULL M, et al. Improving the sensitivity of the determination of ceftiofur by capillary electrophoresis in environmental water samples: In-line solid phase extraction and sample stacking techniques[J]. Anal Chim Acta, 2007, 587(2): 208-215.
[9] VERA-CANDIOTI L, OLIVIERI A C, GOICOECHEA H C. Development of a novel strategy for preconcentration of antibiotic residues in milk and their quantitation by capillary electrophoresis[J]. Talanta, 2010,82(1): 213-221.
[10] BAILON-PEREZ M I, GARCIA-CAMPAA A M, OLMO-IRUELA M, et al. Multiresidue determination of penicillins in environmental waters and chicken muscle samples by means of capillary electrophoresistandem mass spectrometry[J]. Electrophoresis, 2009, 30(10): 1708-1717.
[11] BAILON-PEREZ M I, GARCIA-CAMPAA A M, CRUCES-BLANCO C, et al. Large-volume sample stacking for the analysis of seven betalactam antibiotics in milk samples of different origins by CZE[J].Electrophoresis, 2007, 28(22): 4082-4090.
[12] BAILON-PEREZ M I, GARCIA-CAMPAA A M, CRUCES-BLANCO C, et al. Trace determination ofβ-lactam antibiotics in environmental aqueous samples using off-line and on-line preconcentration in capillary electrophoresis[J]. J Chromatogr A, 2008, 1185(2): 273-280.
[13] 卢小玲, 倪坤仪, 屠洁, 等. 胶束电动毛细管电泳法测定β-内酰胺类抗生素[J]. 分析化学, 2006, 34(2): 259-262.
[14] 杜建中, 张天辉, 丁玎, 等. 胶束电动毛细管电泳法分离测定食品中尼泊金酯的研究[J]. 食品科学, 2009, 30(12): 183-186.
[15] 邓宁, 何友昭, 苏庆德. 胶束电动毛细管色谱在柱富集和分离7种植物激素[J]. 分析化学, 2005, 33(10): 1486-1488.
[16] NIU Hongyun, CAI Yaqi, SHI Yali, et al. Evaluation of carbon nanotubes as a solid-phase extraction adsorbent for the extraction of cephalosporins antibiotics, sulfonamides and phenolic compounds from aqueous solution[J]. Anal Chim Acta, 2007, 594(1): 81-92.
Separation and Determination of Fiveβ-Lactam Antibiotics by Micellar Electrokinetic Capillary Chromatography
YAO Ye,DENG Ning,YU Mu-yang,HE Jian-bo*
(Engineering Research Centre of Bioprocess, Ministry of Education, School of Chemical Engineening, Hefei University of Technology,Hefei 230009, China)
Micellar electrokinetic capillary chromatography (MECC) coupled with the addition of methanol to the running buffer was used for the separation and determination of fiveβ-lactam antibiotics, ceftiofur, cephazoline, cephalexin, ampicillin and penicillin G. The running buffer was optimized to consist of 20 mmol/L Na2HPO4, 20 mmol/L NaH2PO4 (pH 8.5), 20 mmol/L SDS and 0.25 (V/V) methanol. Under the voltage of 18 kV, baseline separation was achieved for the five antibiotics within 15 min, and their concentrations and peak areas exhibited a good linear relationship. The detection limits for these antibiotics were between 5.3 and 8.1 mg/L. The precision of the method was found to be 3.8%-5.5%. The results indicate that the combination of micellar pseudostationary phase and organic additives enables highly efficient chromatographic separation of antibiotics of very similar structures.
micelle capillary electrophoresis;organic additive;β-lactam antibiotics;baseline separation
O657.8;TS207.5
A
1002-6630(2011)16-0253-04
2010-11-10
安徽省自然科学基金项目(090411011);国家自然科学基金项目(20972038)
姚晔(1983—),男,硕士研究生,研究方向为仪器分析。E-mail:yaoye415@163.com
*通信作者:何建波(1965—),男,教授,博士,研究方向为电分析与生物电化学。E-mail:jbhe@hfut.edu.cn

