一种连续分离纯化酪蛋白磷酸肽的新工艺
徐桂敏,杨瑞金*,张文斌,赵 伟,华 霄,蒋孝燕
(1.江南大学 食品科学与工程国家重点实验室,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122)
一种连续分离纯化酪蛋白磷酸肽的新工艺
徐桂敏1,杨瑞金2,*,张文斌2,赵 伟2,华 霄2,蒋孝燕1
(1.江南大学 食品科学与工程国家重点实验室,江苏 无锡 214122;2.江南大学食品学院,江苏 无锡 214122)
为建立一条制备酪蛋白磷酸肽(CPPs)的新工艺路线。采用酶解与超滤耦联技术初步分离制备酪蛋白生物活性肽,然后通过树脂层析将酪蛋白生物活性肽中的酪蛋白磷酸肽和非磷酸肽分离。选用碱性蛋白酶Alcalase在切向流酶膜反应器中(膜截留分子质量10kD)连续酶解3h、酶解温度50℃、pH8.5。重点研究大孔弱碱性阴离子交换树脂D303对酪蛋白生物活性肽的分离纯化工艺,并采用单因素试验优化CPPs的分离纯化工艺参数,确定D303树脂的较佳动态吸附解吸条件:上样流速1BV/h、上样量100mL、洗脱温度45℃、洗脱酸浓度0.15mol/L HCl,获得磷酸肽N/P比为7.21,P洗脱得率为93.11%。
酶膜反应器;层析分离;酪蛋白磷酸肽;N/P;纯化
酪蛋白中富含多种生物活性肽,如酪蛋白磷酸肽、抗氧化活性肽、免疫活性肽和血管紧张素转化酶抑制剂等多种功能肽,其中磷酸肽(casein phosphopeptides,CPPs)的研究和开发是相对最早的。大量研究表明,酪蛋白经胃肠消化后,产生酪蛋白磷酸肽,具有很强的矿物质结合能力[1]。同时,酪蛋白磷酸肽在人体营养系统中起着极其重要的作用[2],如促进儿童骨骼和牙齿的发育,促进骨折患者的康复,预防和改善缺铁性贫血,抗龋齿[3]等,是一类极具开发价值的功能性食品添加剂。
国内外研究者[4-9]已采用不同方法制备了CPPs,取得了较好效果,但也存在能耗大、纯度低、生产工艺复杂、无法解决底物及酶的浪费等问题,工业化生产难度大。因此,建立一条连续分离制备低N/P比和CPPs高得率的新工艺路线,且操作简单、工艺成本低、易于自动化及工业化的方法是非常有意义的。
酪蛋白磷酸肽在日本、东南亚、欧洲、澳大利亚等地已被广泛应用于食品行业,在我国除了广州轻工业研究所有少量的磷酸肽CPPs作为钙吸收剂上市,尚未见有工业化规模生产磷酸肽CPPs的报道。酶膜反应器(enzymatic membrane reactor,EMR)的应用可以实现小分子量水解产物从酶解产物中连续分离[10],截留大分子底物及酶,减少底物抑制作用,减少游离氨基酸含量[11],并且能够降低酶损耗、提高蛋白转化率、降低生产成本。然后,采用树脂层析分离纯化酪蛋白磷酸肽,工艺操作简单,成本低,易于大规模化生产。因此选择正确的树脂层析分离工艺,并优化最佳的层析分离工艺参数,可以实现低N/P比和高得率CPPs产品的连续分离制备。本研究拟建立以酶膜反应器和树脂层析耦联连续分离纯化酪蛋白磷酸肽的新型工艺,旨在解决酪蛋白磷酸肽工业化生产难度大,成本高等问题。
1 材料与方法
1.1 材料、试剂与仪器
酪蛋白(食品级) 甘肃华羚有限公司;Alcalase FG 2.4L(酶活力2×105U/g) 美国Sigma公司;大孔弱碱性阴离子交换树脂D303 上海华震科技有限公司;其他试剂均为分析纯或优级纯。
Pellicon超滤系统和超滤膜(截留分子质量10kD) 美国Millipore公司。
1.2 方法
1.2.1 连续酶解分离纯化酪蛋白磷酸肽工艺及流程图
工艺及流程图见图1。

图1 连续分离制备酪蛋白磷酸肽的工艺流程图Fig.1 Process flow diagram of continuous preparation of casein phosphopeptides
酪蛋白生物活性肽的制备[12-13]:分别配制质量分数10%和6%的酪蛋白溶液,通过酶膜反应器连续酶解制备酪蛋白生物活性肽。操作工艺参数:E/S=0.05mL/g、酶解温度50℃、pH8.0~8.5、超滤设备进口压力10psi、出口压力6psi。将400mL 10%酪蛋白溶液加入酶反应器中,开启恒温水浴并升温至50℃,在搅拌状态下加入Alcalase开始连续酶解反应并计时,酶解过程采用pH-stat法维持酶解液pH值恒定,酶解10min后,开启超滤装置。超滤过程中,大分子底物及酶被膜截留返回到酶反应器内继续循环降解,而小于超滤膜平均截留分子质量的多肽透过膜组件形成渗透液(酪蛋白生物活性肽溶液),当有渗透液形成时,开启进料泵(料液为pH8.5,6%酪蛋白溶液),进料速度同渗透速度,以维持反应液体积和蛋白含量近似恒定。
酪蛋白磷酸肽的分离纯化:上述酪蛋白生物活性肽溶液以一定流速流经D303大孔弱碱性阴离子交换树脂进行分离纯化,通过水洗获得非磷酸肽,再经洗脱剂洗脱得到酪蛋白磷酸肽。
1.2.2 树脂预处理
树脂Cl型处理:树脂D303用清水浸泡充分溶胀后,用质量分数5% HCl溶液浸泡4h,去离子水冲洗至中性,用质量分数5% NaOH溶液浸泡4h,去离子水冲洗至pH8.0左右,再用5% HCl溶液浸泡4h,去离子水冲洗至pH4.0左右,装柱,柱规格Φ2.6cm×50cm,床体积200mL。
树脂OH型处理:处理顺序为清水溶胀、NaOH溶液浸泡、去离子水冲洗、HCl溶液浸泡、去离子水冲洗、NaOH溶液浸泡、去离子水冲洗至pH8.0左右,具体操作方法同上。
1.2.3 静态吸附与解析实验
取处理好的树脂50mL置于250mL烧杯中,加入酪蛋白生物活性肽溶液25mL,进行静态吸附实验。开启磁力搅拌(速度为1档),每隔5min吸取吸附液0.1mL,稀释到5mL于220nm波长处测OD值,直到OD值稳定认为吸附实验终止。解析实验操作步骤同吸附实验,最后分别测定吸附液及解析液的含N质量分数、含P质量分数。
1.2.3.1 洗脱剂的确定
树脂转型为Cl型时进行蛋白质吸附实验,搅拌吸附90min后,分别选用0.2mol/L NaOH溶液和0.2mol/L HCl溶液作为洗脱剂,进行静态酸、碱洗脱实验,确定最佳洗脱剂。
1.2.3.2 树脂转型处理对分离纯化CPPs的影响
对于树脂的转型,本实验分别考察树脂转型为Cl型、OH型时,对酪蛋白生物活性肽的吸附及解析效果,探讨其对CPPs分离纯化的影响。
1.2.4 动态洗脱分离纯化CPPs工艺条件的优化
1.2.4.1 上样量对CPPs分离纯化效果的影响
树脂转型为Cl型时进行动态洗脱实验。分别取膜渗透液75、100、125、150mL(蛋白质质量分数5%)上样至大孔弱碱性阴离子交换树脂,考察上样量对CPPs分离效果的影响。其他工艺条件:上样流速及洗脱流速1.5BV,洗脱温度25℃,洗脱酸浓度0.2mol/L HCl。
1.2.4.2 上样流速对CPPs分离纯化效果的影响
用选定的上样量进行,洗脱流速1.5BV。调整上样流速分别为0.5、1.0、1.5、2.0BV/h,从获得CPPs的N/P比及P得率判断最佳上样流速。
1.2.4.3 洗脱温度对CPPs分离纯化效果的影响
用选定的上样量及上样流速进行。调整循环水浴温度分别为25、30、35、40、45、50℃,考察温度对分离纯化CPPs的影响。
1.2.4.4 洗脱酸浓度对CPPs分离纯化效果的影响
用选定的上样流速、上样量、洗脱温度进行。洗脱酸(HCl)浓度分别为0.1、0.15、0.2、0.25mol/L洗脱CPPs,考察酸浓度对分离纯化的影响。
1.3 分析及检测方法
洗脱液中蛋白质质量测定:双缩脲法[14];洗脱液中N质量分数计算:蛋白质质量分数/6.38;洗脱液中磷质量分数测定:Morrision微量快速定磷法[15];N/P比=N的质量分数×31/(P的质量分数×14);P得率/%=洗脱液中P总质量/上样液中P总质量×100
2 结果与分析
2.1 酪蛋白及酪蛋白活性肽成分分析

表1 酪蛋白及酪蛋白活性肽成分分析Table 1 Composition of casein and casein peptides
经酶解-超滤过程,可制备完全澄清的酪蛋白活性肽溶液。由表1可知,酪蛋白活性肽溶液的N/P比相对原料而言降低为33.47,这说明超滤过程中有相对较多的非磷酸肽以大分子片段存在,不能及时透过超滤膜,而含P多肽透过量相对较多,所以酪蛋白活性肽溶液中CPPs含量相对变高,有利于后期CPPs的分离纯化。
2.2 静态法确定树脂分离纯化工艺
2.2.1 洗脱剂的确定
为避免产品引入过多的杂质,本实验选用HCl溶液和NaOH溶液作为树脂分离纯化的洗脱剂。当采用0.2mol/L NaOH溶液洗脱时,洗脱后的CPPs的N/P比为121.46,与原料相比,N/P比偏高,洗脱效果较差,结果见图2。这可能是由于在碱性范围内,大多数多肽处于电负性,与树脂间的静电相互作用增强,这样就使得CPPs更难以洗脱下来。导致CPPs的N/P比值变大。而采用0.2mol/L HCl溶液洗脱,CPPs的N/P比为12.75,考虑到优先吸附顺序Cl->PO43+以及环境pH值影响,低浓度酸洗脱效果更好。

图2 洗脱剂对分离纯化CPPs的影响Fig.2 Effect of eluents on separation and purification of CPPs
2.2.2 树脂转型处理对分离纯化CPPs的影响
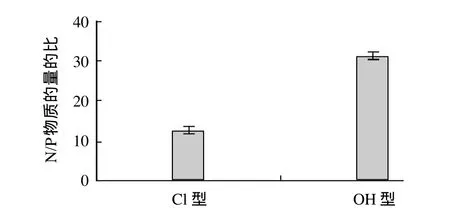
图3 Cl型、OH型上样对CPPs分离纯化的影响Fig.3 Effect of different anion types of resin D303 on separation and purification of CPPs

图4 Cl型、OH型上样过程蛋白质含量随时间的变化曲线Fig.4 Change of protein content during sample loading onto different anion types of resin D303
图3 表明,树脂转型为Cl型时,获得CPPs的N/P比为12.81,低于树脂转型为OH型时CPPs的N/P比。这主要受pH值变化影响,结合图4可知,OH型上样对蛋白质的吸附量很高,同样解吸下来的蛋白质也多,随着吸附实验的进行,OH型树脂中OH-不断被取代下来,溶液环境pH值变大,逐渐趋于碱性环境,导致溶液中大部分多肽带负电,使离子交换平衡发生变化,最终导致大量的非磷酸肽(CNPPs)也竞争吸附到树脂上,影响了CPPs与CNPPs的分离。而Cl型上样保证了溶液的pH值在酸性范围,使大部分CNPPs带正电,不被树脂吸附,从而更好地将二者分离,所以Cl型上样分离纯化效果优于OH型上样。
2.3 优化树脂分离纯化CPPs的工艺参数
2.3.1 D303树脂动态吸附解吸流出曲线

图5 动态洗脱过程蛋白质浓度随时间变化曲线Fig.5 Change of protein concentration with time during dynamic elution
图5 为D303树脂分离纯化CPPs过程图,洗脱剂为0.2mol/L HCl,酪蛋白活性肽溶液流经树脂过程中,基于荷电性,带负电的水解肽易于吸附到D303树脂上,由于CPPs带有PO43+,具有很强的电负性,易于竞争吸附到树脂上,从而将CPPs与CNPPs分离。因此未被吸附到树脂上的CNPPs采用水洗脱下来,洗脱液经220nm波长检测,形成图5中第一个水洗峰。吸附到树脂上的CPPs采用被树脂优先吸附的Cl-洗脱下来,经紫外检测形成图上第二个酸洗峰。
2.3.2 上样量对分离纯化CPPs的影响

图6 上样量对分离纯化CPPs的影响Fig.6 Effect of loading quantity on separation and purification of CPPs
图6 表明,随着上样量的增大,CPPs的N/P比逐步降低,纯度提高,但P的得率也相应降低。当上样量过低时,CPPs的N/P比有明显上升趋势,可能是由于更多的CNPPs也竞争吸附到树脂上,造成分离效果变差;上样量过高,P的得率又明显降低,这可能由于部分CPPs未被树脂吸附而伴随着CNPPs流出,导致CPPs损失,从而降低产品得率。因此仅当上样量为100mL(蛋白质质量分数约5%,即上样量约25mg/mL湿树脂),获得CPPs的纯度及得率比较适宜。
2.3.3 上样流速对分离纯化CPPs的影响
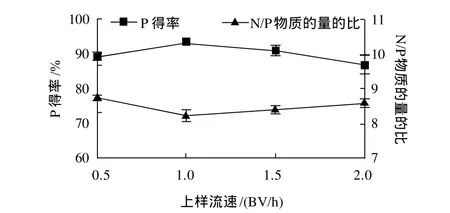
图7 上样流速对分离纯化CPPs的影响Fig.7 Effect of loading flow rate on separation and purification of CPPs
随着上样流速的增大,CPPs的N/P比先降低后增大,当流速为1BV/h时,CPPs的纯度及P得率最佳,增大或降低流速,都会影响分离效果,结果见图7。这可能是由于流速过慢,影响树脂的处理能力;流速过大,树脂对多肽分子的吸附量下降,吸附性能降低,导致分离效果及得率不佳[16]。
2.3.4 洗脱温度对分离纯化CPPs的影响

图8 洗脱温度对分离纯化CPPs的影响Fig.8 Effect of elution temperature on separation and purification of CPPs
从图8可以看出,温度对CPPs分离纯化的影响较明显,温度为40~45℃时,制备的CPPs的纯度较高。温度增高,树脂功能基团活性增强,多肽水解液黏度下降,多肽分子扩散速度加快,有利于促进多肽的吸附,从而制备高纯度的CPPs,但是温度过高CPPs的纯度又有所降低,可能是由于弱碱性树脂交换吸附酸根离子,发生酸碱中和反应,此反应为放热反应,温度过高不利于此反应的进行[17]。另外考虑到现实生产因素,高温将产生巨大的能耗,因此确定最佳洗脱温度为45℃。
2.3.5 洗脱酸浓度对分离纯化CPPs的影响
随酸浓度增大,P得率先增高后降低,结果见图8。这说明CPPs的解吸能力先增大后降低,这种吸附与解析平衡取决于CPPs与离子交换树脂间的静电相互作用力强弱[18]。当HCl浓度为0.15mol/L时,P的洗脱得率最高,所得CPPs的N/P比最低,这说明此时CPPs与离子交换树脂间的静电相互作用力较弱,因而得到较好的洗脱效果,同时低浓度HCl洗脱也降低了后续除酸工作的难度。
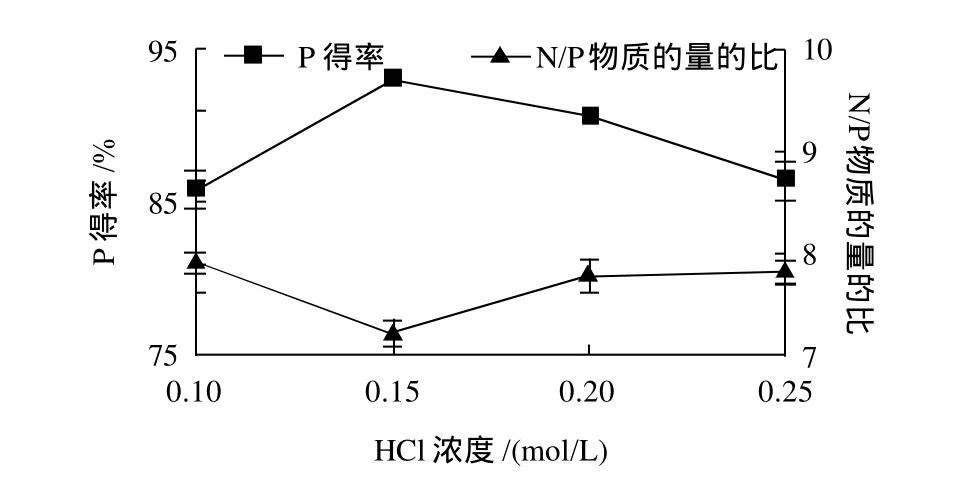
图9 洗脱酸浓度对分离纯化CPPs的影响Fig.9 Effect of HCl concentration on separation and purification of CPPs
3 结 论
本实验建立了一条新型连续分离纯化CPPs的工艺路线。采用酶解与超滤耦联初步分离酪蛋白磷酸肽,获得N/P比为33.47的完全澄清的酪蛋白活性肽溶液;继而采用大孔弱碱性阴离子交换树脂D303分离纯化CPPs,当上样流速1BV/h、上样量100mL、洗脱温度45℃、洗脱酸浓度0.15mol/L HCl时,获得酪蛋白磷酸肽的N/P比为7.21,P得率为93.11%。本法生产CPPs盐含量较高,后期研究将采用纳滤工艺脱除盐分及游离氨基酸,进一步提高CPPs的纯度。另外本法生产工艺简单,可自动化操作,易于放大,有利于工业化生产。
[1] PHILIPPE M, GRAT Y L, GAUCHERON F. The effects of different cations on the physicochemical characteristics of casein micelles[J]. Food Chemistry, 2005, 90(4): 673-683.
[2] KITTS D D. Antioxidant properties of casein-phosphopeptides[J]. Trends in Food Science and Technology, 2005, 16(12): 549-554.
[3] ANDREWS A T, WILLIAMS R J H, BROWNSELL V L, et al. β-CN-5P andβ-CN-4P components of bovine milk proteose-peptone:large scale preparation and influence on the growth of cariogenic microorganisms[J]. Food Chemistry, 2006, 96(2): 234-241.
[4] 赵一明. 酪蛋白非磷肽的制备及其ACE抑制活性的研究[D]. 无锡:江南大学, 2008.
[5] 焦宇知, 王璋. 高N/P摩尔比酪蛋白磷酸肽生产工艺及初步分离纯化研究[J]. 食品科技, 2006(1): 27-30.
[6] 齐崴, 何志敏, 何明霞, 等. 酶解与膜滤集成连续制取酪蛋白生物活性多肽的工艺: 中国, 200310107554.3[P]. 2004-11-17.
[7] 齐崴, 何志敏, 何明霞. 酶解反应与膜分离耦合连续制备酪蛋白磷酸肽[J]. 化学工程, 2006, 34(4): 43-54.
[8] ADAMSON N J, REYNLIDS E C. Characterization of tryptic casein phosphopeptides prepared under industrially relevant conditions [J].Biotechnology and Bioengineering, 1995, 45(3): 196-204.
[9] ELLEGARD K H, GAMMELGARD-LARSEN C, SORENSEN E S, et al. Process scale chromatographic isolation, characterization and identification of tryptic bioactive casein phosphopeptides[J]. International Dairy Journal, 1999, 9(9): 639-652.
[10] RIOS G M, BELLEVILLE M P, PAOLUCCI D, et al. Progress in enzymatic membrane reactors: a review[J]. Journal of Membrane Science,2004, 242(1/2): 189-196.
[11] CHEISON S C, WANG Zhang, XU Shiying. Use of response surface methodology to optimise the hydrolysis of whey protein isolate in a tangential flow filter membrane reactor[J]. Journal of Food Enzyneering,2007, 80(4): 1134-1145.
[12] 王文杰, 王璋. 酶膜反应器中水解大豆分离蛋白的研究[J]. 食品与机械, 2008, 24(1):16-19.
[13] CHEISON S C, WANG Zhang, XU Shiying. Hydrolysis of whey protein isolate in a tangential flow filter membrane reactor I. Characterisation of permeate flux and product recovery by multivariate date analysis[J].Journal of Membrane Science, 2006, 283(1/2): 45-56.
[14] BLANC B. Biochemical aspects of human milk comparison with bovine milk[J]. World Review of Nutrition and Dietetics, 1981, 36: 1-89.
[15] MORRISON W R. A fast, simple and reliable method for the microdetermination of phosphorus in biological materials[J]. Analytical Biochemistry, 1964, 7(2): 218-224.
[16] 高振鹏, 袁亚宏, 岳田利, 等. 用离子交换法分离苹果汁中果酸的技术研究[J]. 农业工程学报, 2007, 23(7): 212-216.
[17] 王元凤, 金征宇. D315树脂分离茶多糖工艺的研究[J]. 农业工程学报, 2005, 21(10): 147-150.
[18] 刘剑虹, 庞广昌, 于金华, 等. 酪蛋白磷酸肽(CPPs)的纯化研究[J].食品科学, 2001, 22(4): 31-35.
A Novel Process of Continuous Separation and Purification of Casein Phosphopeptides
XU Gui-min1,YANG Rui-jin2,*,ZHANG Wen-bin2,ZHAO Wei2,HUA Xiao2,JIANG Xiao-yan1
(1. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
A novel continuous preparation process of casein phosphopeptides (CPPs) was developed using enzymatic membrane reactor and anion-exchange chromatography. Alcalase was used to continuously hydrolyze 10% casein at pH 8.5 and 50 ℃ for 3 h in a tangential flow filter (TFF) enzymatic membrane reactor (EMR). The separation and purification of the resulting CPPs using anion-exchange resin D303 was investigated and the technological parameters were optimized by single factor design based on the recovery rate of phosphate and the molar ratio of nitrogen to phosphate. The results showed that the appropriate adorption/desorption conditions of D303 were as follows: loading permeate flow rate of 1 BV/h, sample loading quantity of 100 mL, elution temperature of 45 ℃, and hydrochloric acid concentration for elution of 0.15 mol/L, and the recovery rate of phosphate from the permeate was 93.11% and the molar ratio of nitrogen to phosphate was 7.21 under these conditions.
enzymatic membrane reactor;chromatography isolation;casein phosphopeptides;N/P molar ratio;purification
TS201.2
A
1002-6630(2011)08-0024-05
2010-05-20
国家“863”计划项目(2008AA10Z313)
徐桂敏(1986—),女,硕士研究生,主要从事食品生物工程技术研究。E-mail:xgm20091102@yahoo.cn
*通信作者:杨瑞金(1964—),男,教授,博士,主要从事食品生物工程技术研究。E-mail:yrj@jiangnan.edu.cn

