不同菌种制备大豆多肽的抗氧化活性比较研究
马利华,秦卫东,陈学红
(徐州工程学院食品学院,江苏徐州 221008)
不同菌种制备大豆多肽的抗氧化活性比较研究
马利华,秦卫东,陈学红
(徐州工程学院食品学院,江苏徐州 221008)
分别采用枯草芽孢杆菌、啤酒酵母菌以及黑曲霉菌发酵豆粕制备多肽,利用SephadexG-15凝胶过滤层析、SDS-PAGE电泳等方法进一步纯化,并对各组分进行抗氧化能力的研究。结果表明:采用枯草芽孢杆菌、啤酒酵母菌以及黑曲霉菌发酵豆粕得到多肽分别为13.512、12.462、14.752mg/mL。通过SephadexG-15凝胶过滤层析分别得到的组分Ⅰ分子质量范围分布在1055.67、1374.16、675.58u,组分Ⅱ分子质量范围分布在2031.49、2283.46、1625.54u。黑曲霉菌制备多肽原液及各组分清除3种自由基的作用较强,且组分1的清除效果好于组分2,其中对脂质过氧化物清除能力大于TBHQ,并与VC相当。
微生物,大豆,多肽,抗氧化性
微生物发酵法是将蛋白酶的发酵生产和大豆肽的酶解生产有机地结合在一起,降低大豆肽的生产成本,克服了酶水解法制备大豆肽产品的苦味大和口感差等缺点,同时由于微生物发酵法生产大豆肽反应条件温和[1],发酵豆粕后所得小肽所含的必需氨基酸与大豆蛋白质中必需氨基酸相比含量更加丰富、营养性更加平衡,且生理结构与大豆蛋白相比更加独特,比大豆蛋白更有营养。因此,利用微生物发酵法制备活性肽成为研究的热点领域。万琦等[2-3]研究了大豆多肽生产菌株的筛选,得到了一株能在发酵过程中产蛋白酶的枯草芽孢杆菌,并研究了其发酵大豆多肽的条件优化。李理等[4]用毛霉发酵大豆蛋白制备多肽,经24~30h发酵水解度达到25%~30%,多肽得率高达75%。邵伟等[5]报道了以豆粕粉为原料添加枯草杆菌将大豆蛋白水解为大豆多肽。张智等人[6]用Bacillus subtilis发酵生产玉米多肽,玉米肽得率达到最大为82.7%。各级分的相对分子质量分别大致为5128、3715和1513u。李善仁等[7]用芽孢杆菌和米曲霉混合菌固态发酵豆粕,大豆肽的得率为51%。陈学红等[8]以芝麻粕为原料接种枯草芽孢杆菌发酵,结果发现发酵时间为48h所得发酵液中芝麻多肽的质量浓度达到3.585mg/mL。周建新等人[9]报道了Actinomucor elegans固态发酵法生产菜籽肽工艺条件研究。庞宗文等人[10]毛霉发酵豆粕的提取物的大豆肽分子量集中在10ku以下。柳杰等人[11]报道了枯草芽孢杆菌液态发酵制备花生抗氧化肽的研究。本实验以枯草芽孢杆菌、啤酒酵母和黑曲霉为发酵菌种,液态发酵豆粕制备大豆抗氧化多肽,比较分析不同菌种制备大豆多肽的差别,旨在提高豆粕的利用率,为制备高质量的豆粕功能肽提供科学依据。
1 材料与方法
1.1 材料与仪器
豆粕 新沂明帝食品有限公司提供;枯草孢杆菌(Bacillus subtil)i、啤酒酵母(Saccharomyces cerevisiae)、黑曲霉(Aspergillus niger) 本院食品与生物实验中心提供;DPPH 生化试剂,SIGMA公司;标准品牛血清白蛋白(Mw67000u)、溶菌酶(Mw14400u)、短菌肽(Mw1422.7u)、L-精氨酸(Mw174.2u) 国药集团化学试剂有限公司;培养基 啤酒酵母培养基,LB固体培养基,枯草芽孢杆菌培养基,LB固体培养基,黑曲霉培养基,PDA固体培养基。
DHG9140型电热恒温鼓风干燥箱、7230G型可见分光光度计、精密酸度计PHS-3CA 上海精宏实验设备有限公司;旋转蒸发器 上海申生科技有限公司;DYY-12型电泳仪 北京市六一仪器厂;CX-1型层析谱数据分析系统 上海嘉鹏科技有限公司;小试平板超滤膜设备FlowMem0250 厦门世达膜科技有限公司;DNP-9162型电热恒温培养箱 上海精宏实验设备有限公司。
1.2 大豆多肽液的制备
枯草芽孢杆菌在发酵液pH为7.0,发酵温度为36℃,转速120r/min,接种量为5%(2.4×107cfu/mL),底物浓度即豆粕量为5%(W/V)的条件下培养32h,离心,上清液在80℃的水浴中灭活10min,测定多肽含量。
啤酒酵母菌在发酵液pH为7.0,发酵温度为37℃,转速为120r/min,接种量为7%(1.68×108cfu/mL)的条件下,底物浓度即豆粕量为9%(W/V)培养24h,离心,上清液在80℃的水浴中灭活10min,测定多肽含量。
黑曲霉菌在发酵液pH为7.0,培养温度37℃,接种量为2%(3.2×107cfu/mL),转速为120r/min,底物浓度为即豆粕量为9%(W/V)的条件下培养32h,离心,上清液在80℃的水浴中灭活10min,测定多肽含量。
将上述得到的各大豆多肽发酵液用超滤膜(COWM 5000u)超滤纯化。开启超滤装置,运行一段时间,待整个系统稳定后,在0.08MPa操作压力、料液温度为室温、膜面积为0.1m2的条件下,对大豆多肽提取液进行超滤纯化。
1.3 Sephadex G-15凝胶层析法分离大豆多肽[12]
使用层析谱分析系统,对超滤纯化后大豆多肽进行柱层析纯化。以0.5mL上样体积,流速为15mL/h,洗脱液为蒸馏水,检测波长设为280nm。
1.4 大豆多肽分子量的确定方法[13]
以标准蛋白质相对分子量的对数(lgMr)为纵坐标,相对迁移距离为横坐标作图,得到标准曲线方程。根据样品蛋白质分子的相对迁移距离(蛋白质分子迁移距离cm/染料迁移距离cm),由标准曲线方程计算得到大豆多肽的相对分子质量。
1.5 大豆多肽含量计算
采用双缩脲法[14],回归方程为:Y=0.1259X+0.0137,相关系数R2=0.9962,蛋白质浓度在0~3.6mg/mL时,吸光度值呈良好线性。
1.6 抗氧化活性测定
1.6.1 DPPH·清除作用 参照文献[15]。
1.6.2 ·OH清除作用 采用邻菲罗啉法[16]。
1.6.3 脂质过氧化物抑制作用 参照文献[17]。
1.6.4 各种抗氧化体系的IC50值的确定 根据1.6.1~1.6.3的结果,用最小二乘法求得回归方程,由回归方程计算各抗氧化体系的IC50值。
2 结果与分析
2.1 不同菌种制备大豆多肽的含量
发酵是利用微生物体的代谢作用并借助于对代谢过程的控制来获得所需产品的过程。利用微生物发酵来产大豆多肽主要利用的是发酵菌株的产酶及酶解能力。通常是以大豆蛋白为底物,以能在生长代谢过程中大量分泌胞外蛋白酶的菌株为发酵菌株,在发酵过程中利用微生物所产蛋白酶的作用,将原料中的大豆蛋白水解,控制水解的进程,便可得到具有特定链长和对应功能的大豆多肽。许多豆制品、乳制品的发酵就是基于这一原理[18]。本实验分别以枯草芽孢杆菌、黑曲霉菌、啤酒酵母菌为发酵菌株,发酵豆粕制备出多肽,结果表明,不同菌种的产酶及酶解能力不同,黑曲霉菌发酵豆粕制备多肽含量高于枯草芽孢杆菌和啤酒酵母菌,分别高出9.12%、18.38%。
2.2 不同菌种Sephadex G-15凝胶层析法分离结果
不同菌种凝胶层析分离结果见图2。
2.3 抗氧化性
2.3.1 清除DPPH自由基能力测定 DPPH·是一种稳定的自由基,与抗氧化剂发生反应,提供H+被还原,颜色发生变化,由深紫色变为淡黄色。利用DPPH的溶液特征紫红色团的吸收峰,用分光光度法测定加抗氧化剂提取液后在波长517nm处吸收的下降表示其对自由基的清除能力。
结果表明(见图3),三种菌种制备的豆粕多肽及各组分清除DPPH自由基活性与其质量均呈良好的线性关系,通过比较IC50可以看出黑曲霉菌制备的豆粕多肽无论发酵原液还是2个组分,其清除DPPH自由基能力均好于其他菌种制备的豆粕多肽,且其组分1的清除能力与TBHQ相当。
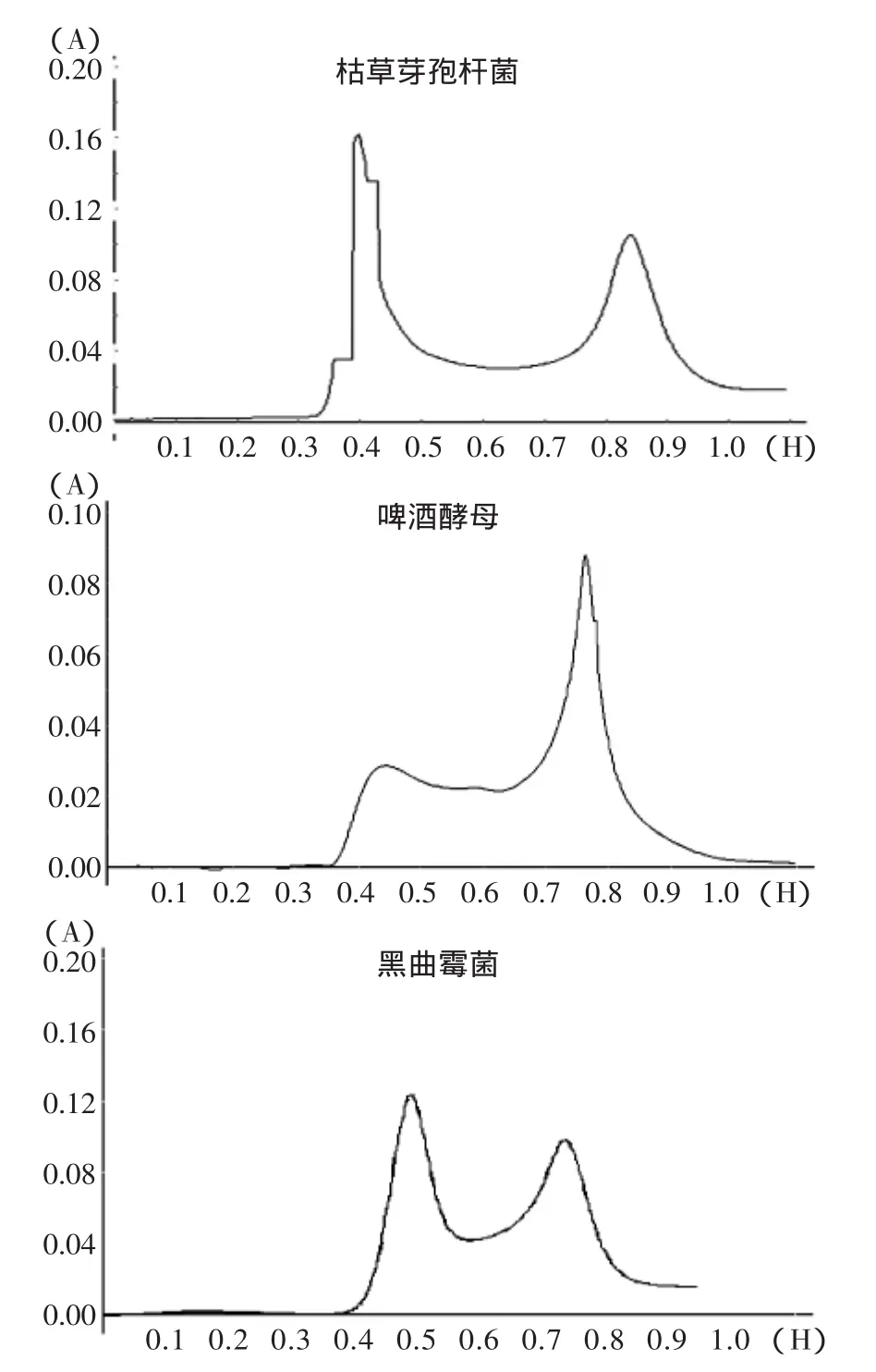
图2 不同菌种发酵豆粕多肽Sephadex G-15凝胶层析结果

图3 不同菌种豆粕多肽清除DPPH·IC50的比较
2.3.2 清除OH自由基能力的测定 用比色分析法测定Fenton反应体系产生的·OH,其中邻菲罗啉-Fe2+是该反应中的一种常用的氧化还原指示剂,其颜色变化可敏锐地反映溶液氧化还原状态的改变,如果向反应加入·OH的清除剂,则·OH减少,同时Fe2+增多,溶液颜色变红,由此可推算·OH的清除剂对·OH的清除效率。
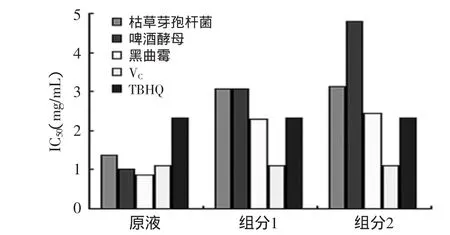
图4 不同菌种发酵豆粕多肽清除OH自由基IC50比较
结果表明(见图4),三种菌种制备的豆粕多肽及各组分清除OH自由基活性与其质量均呈良好的线性关系,通过比较IC50可以看出黑曲霉菌制备的豆粕多肽无论发酵原液还是2个组分,其清除OH自由基能力均好于其他菌种制备的豆粕多肽,且其发酵原液清除能力好于VC、TBHQ,组分1和组分2的清除能力与TBHQ相当。2.3.3 清除脂质过氧化物自由基的效果 油脂发生氧化酸败最终形成过氧化物丙二醛(MDN),TBA(硫代巴比妥酸)能与丙二醛在一定条件下反应生成粉红色物质,这种粉红的物质在532nm有最大吸收峰,这种物质的浓度与颜色成正比。因此,在特定波长下,测定粉红色物质的含量即可得知过氧化物丙二醛的含量。油脂中添加抗氧化剂,可使油脂的氧化酸败过程受到阻止或延缓,生成的丙二醛的含量就会降低,因而测定粉红色物质的含量也就降低。所以,通过在一定条件下测得TBA与丙二醛的生成物的含量即可推断抗氧化剂的性能。
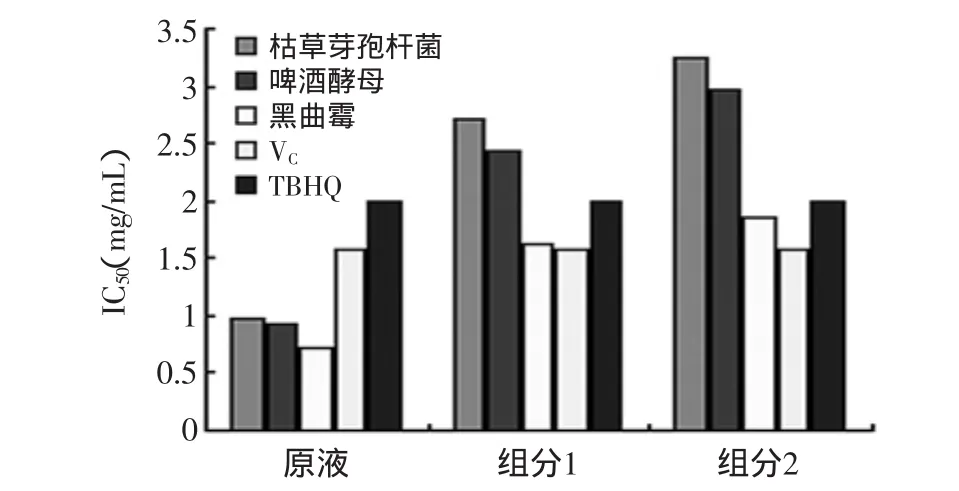
图5 不同菌种豆粕多肽清除脂质过氧化物自由基IC50的比较
结果表明(见图5),三种菌种制备的豆粕多肽及各组分清除OH自由基活性与其质量均呈良好的线性关系,通过比较IC50可以看出黑曲霉菌制备的豆粕多肽无论发酵原液还是2个组分,其清除OH自由基能力均好于其他菌种制备的豆粕多肽,且其发酵原液清除能力好于VC、TBHQ,组分1清除能力好于TBHQ,与VC相当,组分2的清除能力好于TBHQ。
2.4 豆粕多肽分子质量
以标准蛋白质相对分子量的对数(lgMr)为纵坐标,相对迁移距离为横坐标作图,得到标准曲线方程,经回归计算得回归方程为:y=-1.2705x+4.9897(R2=0.9902)。由此,得到不同菌种制备的豆粕多肽的各个组分的分子质量分别为:组分Ⅰ分子质量范围分布在1055.67、1374.16、675.58u,组分Ⅱ分子质量范围分布在2031.49、2283.46、1625.54u。
3 讨论
微生物的内源酶中存在着广泛的肽酶谱系,通过微生物生命活动中产酶将大豆蛋白降解为大豆肽并对某些基团进行修饰和重组,使小肽之间、小肽与氨基酸之间发生移接、重排,以改善大豆多肽的功能特性和加工特性[19]。菌种的选择对发酵效果有至关重要的作用,各菌种都有其独特的生理特性,它们的作用千差万别,同样,由于不同菌种生长繁殖环境不同,不同菌株发酵的最优条件也就不同。目前常用的菌种是乳酸菌、酵母菌、曲霉菌、产朊假丝酵母和枯草芽孢杆菌等[20-21]。吴胜华等[22]研究了从12株酵母菌中筛选出一株优质酵母菌,以普通生豆粕为原料,研究其对豆粕中胰蛋白酶抑制因子和小肽含量的影响,并对其发酵条件进行优化。姜曼等[23]等以豆粕为原料,采用黑曲霉、米曲霉混合菌种固态发酵法生产大豆肽,制得的大豆肽具有较好的理化特性和生理活性。
本研究确认各菌种发酵得到的大豆肽均有良好的抗氧化性能,其中黑曲霉发酵大豆肽的抗氧化性能最好。另外,组分Ⅰ的抗氧化活性要强于组分Ⅱ(图5)。Hsu、Lu和Jao[24]报道了用枯草芽孢杆菌(Bacillus subtilis)产生的orientase水解金枪鱼煮汁得到的肽具有良好的抗氧化活性,其中活性最高的三种肽,分子量是分别为1305、938、584u的10肽、7肽和4肽。柳杰等人[11]指出,花生粕的枯草芽孢杆菌发酵产物中2~6个氨基酸组成的短肽比例较高是发酵液具有较强的DPPH·清除率的原因所在。这与本研究结果分子量较小(<1000Da)时具有较高的抗氧化活性相一致。
本实验中各种菌种发酵的大豆肽清除DPPH·的IC50分别为0.887、2.562、0.614mg/mL,这与鞠兴荣等人[25]的结果基本相似。他们确认枯草芽孢杆菌固态发酵制备的菜籽肽对DPPH·自由基的IC50为328μg/mL。与VC相比的结果与庞宗文等人报道的毛霉发酵豆粕产生的大豆肽清除DPPH·的能力约为VC60%的结果并不相同,这可能是由于在发酵的过程中,不同的菌种所产生的蛋白酶不同,切割大豆蛋白的位点不同,因此所得的大豆肽的分子量分布也不同的缘故。
4 结论
4.1 不同菌种发酵制备豆粕多肽含量分别为13.512、12.462、14.752mg/mL,其中黑曲霉菌制备的豆粕多肽含量高于其他2个菌种。
4.2 SephadexG-15凝胶层析分离不同菌种豆粕多肽发酵液,在洗脱速度在15mL/min,缓冲溶液为蒸馏水时,均分别得到2个组分。
4.3 SDS-PAGE电泳结果显示:不同菌种豆粕多肽发酵液经层析后组分Ⅰ分子质量范围分布在1055.67、1374.16、675.58u,组分Ⅱ分子质量范围分布在2031.49、2283.46、1625.54u。
4.4 以清除DPPH自由基和羟自由基活性及对脂质过氧化反应产物的抑制作用等方法测定不同菌种发酵大豆多肽的抗氧化活性。结果表明:不同菌种发酵豆粕多肽均有一定的抗氧化活性,且大豆多肽的3种抗氧化活性与其质量均呈现良好的线性关系。黑曲霉菌制备多肽原液及各组分清除3种自由基的作用较强,且组分1的清除效果好于组分2,其中对脂质过氧化物清除能力大于TBHQ,并与VC相当。
[1]HUMISKI L M,ALUKO R E.Physicochemical and bitterness properties of enzymatic pea protein hydrolysates[J].Journal of Food Science,2007,72(8):S605-S611.
[2]万琦,陆兆新,高宏.脱苦大豆多肽产生菌的筛选及其水解条件的优化[J].食品科学,2003,24(2):29-32.
[3]万琦,陆兆新,吕凤霞,等.枯草芽孢杆菌生产大豆多肽溶液的加工功能特性研究[J].食品科学,2003,24(11):99-102.
[4]李理,潘进权,杨晓泉,等.液体发酵法制备风味良好的大豆多肽[J].食品与发酵工业,2003,29(1):23-26.
[5]邵伟,熊泽,何晓文.发酵大豆多肽及其功能研究[J].中国酿造,2005(6):23-25.
[6]张智,黄放,朱宏亮,等.枯草芽孢杆菌ls-45发酵法制取玉米肽的研究[J].中国粮油学报,2009,24(12): 36-41.
[7]李善仁,林新坚,蔡海松,等.混菌发酵豆粕制备大豆肽的研究[J].中国粮油学报,2009,24(12):52-56.
[8]陈学红,秦卫东,马利华,等.微生物发酵法制备芝麻蛋白肽的研究[J].食品工业科技,2010,31(6):237-238,241.
[9]周建新,张弘,何荣,等.雅致放射毛霉固态发酵法生产菜籽肽工艺条件研究[J].食品科学,2010,31(17):214-217.
[10]庞宗文,李敏,李树波,等.产蛋白酶毛霉的分离筛选及发酵豆粕产大豆肽的初步研究 [J].现代食品科技,2010,26(9):956-961.
[11]柳杰,张晖,郭晓娜,等.液态发酵制备花生抗氧化肽的优化研究[J].中国油脂,2011,36(2):25-30.
[12]WANGJianhao,WANGHaiqiao,ZHANHaili,etal.Purification of denatured bovine serum albumin coated CdTe quantum dots for sensitive detection of silver (I) ions[J].Analytical and Bioanalytical Chemistry,2007(4):969-974.
[13]郭宏彦.银杏营养贮藏蛋白质的分离鉴定及特性研究[D].南京林业大学,2007:63.
[14]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定[J].食品科学,2005,26(7):169-171.
[15]BRAND-WILLIAMS W,CUVELIER M E,BERSET C.Use of a free radical method to evaluate antioxidant activity[J].Lebensmittel-Wissenschaft und-Technogie,1995,28(1):25-30.
[16]ZHANG Liangshuan,WANG Xuan,DONG Lulu.Antioxidation and antiglycation of polysaccharides from Misgunus anguillicandatus[J].Food Chemistry,2010,124(1):183-187.
[17]秦卫东,陈学红,马利华,等.黑曲霉发酵豆粕制备抗氧化肽研究[J].食品科学,2010,31(23):289-293.
[18]余勃.枯草芽孢杆菌发酵豆粕生产大豆活性多肽的研究[D].南京农业大学,2006.
[19]莫重文,黄岗.固态发酵法生产发酵豆粕的研究[J].中国油脂,2007,32(7):38-40.
[20]付弘贇,李吕木,蔡海莹,等.菌种和发酵条件对豆粕中胰蛋白酶抑制因子、凝集素的影响[J].安徽农业通报,2008,14(13):31-32.
[21]陈丽娟,郑裴,徐玉霞,等.益生菌发酵豆粕产CLA及豆粕中抗营养因子降解的研究[J].中国油脂,2010,35(6):19-21.
[22]吴胜华,李吕木,张邦辉,等.酵母菌单菌固态发酵豆粕的研究[J].中国粮油学报,2009,24(7):41-44.
[23]姜曼,宋俊梅.双菌种固态发酵豆粕生产大豆肽的研究[J].粮食加工,2010,35(3):61-63.
[24]Hsu Kuo-Chiang ,Lu Geng-Hwang,Jao Chia-Ling.Antioxidative properties of peptides prepared from tuna cooking juice hydrolysates with orientase (Bacillus subtilis) [J].Food Research International,2009,42:647-652.
[25]鞠兴荣,何海艳,何荣,等.固态发酵菜籽肽功能特性研究[J].食品科学,2010,31(21):45-49.
Comparative study on antioxidative activities of soybean peptide produced by different microbiological strains
MA Li-hua,QIN Wei-dong,CHEN Xue-hong
(Food School of Xuzhou Institute of Technology,Xuzhou 221008,China)
Soybean peptides were prepared byBacillus subtili,Saccharomyces cerevisiaeandAspergillus niger.The Sephadex G-15 gel filtration chromatograph and SDS-PAGE electrophoresis were used for purifying the peptides.Antioxidative activities of the each peptide components obtained by purity were analyzed.The results indicated that content of the peptide produced byBacillus subtili,Saccharomyces cerevisiaeandAspergillus nigerwere 13.512,12.462,14.752mg/mL,respectively.The peptides was separated into two contents by Sephadex G-15 gel filtration chromatograph.The relative molarcular weight of first componentforBacillus subtili,Saccharomyces cerevisiaeandAspergillus nigerwere 1055.67,1374.16,675.58u,respectively,and that of second component were 2031.49,2283.46,1625.54u,respectively.The peptide solution prepared byAspergillus nigerhad the most high scavenging capacities for DPPH·,hydroxy free radical as well as lipid peroxide free radicals among all peptides prepared by three microorganism strains,moreover first component was more stronger than second component.The scavenging capacities for lipid peroxide free radicals of peptide byAspergillus nigerwas stronger than TBHQ and the effect was corresponded with Vc.
microorganism;soybean;peptide;antioxidative activities
TS201.2
A
1002-0306(2011)10-0201-04
2011-08-02
马利华(1966-),女,硕士,副教授,研究方向:食品加工。

