腹泻性贝类毒素DSP的磷酸酶抑制检测法研究
胡雪莲,曲勤凤,顾文佳
(上海市质量监督检验技术研究院,上海 200233)
腹泻性贝类毒素DSP的磷酸酶抑制检测法研究
胡雪莲,曲勤凤,顾文佳
(上海市质量监督检验技术研究院,上海 200233)
对腹泻性贝类毒素DSP的快速筛选方法——磷酸酶抑制法进行了研究,分析了该方法的检测原理,并提出了该方法的筛选检出限,对标准溶液、加标回收样品及市场采样样品进行了检测,并就该方法的重复性进行验证。检测结果显示,磷酸酶抑制法检测准确率高,重复性较好,提出的筛选检出限(200μg/kg)远低于我国相关标准的规定(600μg/kg),是一种对于腹泻性贝类毒素DSP较为理想的筛选方法。
腹泻性贝类毒素,磷酸酶抑制法,筛选检测
贝类毒素(Shellfish toxin)是一类由浮游藻类或微生物合成,通过食物链传给贝类,并在其体内富集而形成的脂溶性次生高分子化合物。其中,腹泻性贝类毒素的存在比较普遍[1]。DSP最早由Yasumoto等从紫贻贝的肝胰腺中分离获得[2],海产双壳类、棘皮类、腹足类等软体动物中都曾检出该贝类毒素。人类误食含DSP的水产品后,会产生以腹泻为主要特征的中毒症状。近年来对中国沿海部分海域贝类毒素的调查显示[3-5],中国沿海部分海域赤潮活动频繁,赤潮一旦产生,海产双壳贝类易受到贝类毒素的威胁。尽管目前还没有因DSP中毒致死的报道,但由于DSP中毒症状与细菌性胃肠炎类似,若是延误治疗,会对健康造成较大的伤害。目前我国DSP的检测方法及判定标准以小鼠法为主,该方法是AOAC (美国官方化学家协会)的标准方法,同时也是目前唯一被大多数国家所普遍接受的统一方法。但该方法存在着很多不足和缺陷,如∶仅能指出毒性的大小,无法确定毒素的组成和含量;所测得的毒性和小鼠品系有关,可比性较差,必须进行标准毒素校准才有可能相比;检测耗时较长,重复性差;需要受过专门训练的操作人员;小鼠维持费用较高,对实验场地要求较高等[6]。这些不足使得人们希望能有另外一些操作简便、可比性强、易于普及、对实验人员和检测场地要求相对较低的检测手段来替代小鼠法。本文探讨了一种腹泻性贝类毒素DSP的快速筛选检测方法——磷酸酶抑制法,旨在较短时间内对贝类样品中是否含有DSP进行快速筛查,以满足当前食品安全实时监控的需要。
1 材料与方法
1.1 材料与设备
高纯度DSP单标OA标准溶液 购自瑞士ALEXIS公司,质量为50μg;TOXINLINE-DSP腹泻性贝类毒素试剂盒 上海千慕生物科技有限公司,样品前处理及检测步骤匀按照试剂盒使用说明书进行。
全波长多功能微孔板分析系统 TECAN公司,M200型,选择激发波长(360±15)nm,发射波长(455±20)nm。
1.2 OA标准溶液的配制
将OA标准品以1mL 100%甲醇溶解,制成OA母液并分装,-18℃保存待用。使用时,母液以含NaCl(100mmol/L)的Tris-HCl(100mmol/L,pH8.2)稀释至2μmol/L(约1610ppb),作为标准品稀释液及加标添加液。
以含NaCl(100mmol/L)的Tris-HCl(100mmol/L,pH8.2)将上述标准品稀释液配制成浓度分别为80、100、160、200、240、300μg/kg的OA标准液,使用1.1所述试剂盒对上述OA标准液进行检测。
1.3 模拟阳性样品制作
以市售干贝为基质,将其高温灭活后,以5.0g/管分装于50mL离心管并高压处理。向基质中添加OA标准品添加液,使其OA终浓度分别为80、100、120、140、160、200、240、300μg/kg。使用1.1所述试剂盒对上述样品进行前处理并检测。
另选择市售扇贝、蛤蜊、牡蛎,将其洗净后去除贝壳,取出所有组织。用滤纸吸干贝肉上的水分,充分捣碎混匀,并5.0g/管分装至50mL离心管并高温灭活。向上述离心管中添加OA标准品添加液,使OA终浓度分别为100、240μg/kg,并将其作为盲样,分发给三名检验人员,由其分别使用1.1所述试剂盒对样品进行前处理并检测。
1.4 市场采样样品
在市场上选购了22批次的贝类产品,包括扇贝、文蛤、友蛤、花蛤、白蛤、贻贝、牡蛎等常见品种。将所选购的贝类样品洗净后,去除贝壳,取出所有组织。用滤纸吸干贝肉上的水分,充分捣碎混匀,以5.0g/管分装至50mL离心管并高压处理。使用1.1所述试剂盒对样品进行前处理并检测。
1.5 OA含量计算
以荧光读数值为Y轴,试剂盒内标准品OA浓度的对数值为X轴,绘制标准曲线,标准曲线计算得出所测样品中的OA含量。
2 结果与讨论
2.1 检测原理及筛选检出限的提出
磷酸酶抑制法检测腹泻性贝类毒素DSP的基本原理是∶磷酸酶可以水解为一种特殊的酶作用物并产生荧光反应,而DSP毒素的主要活性成分OA及其衍生物DTX可以抑制该酶的活性,其抑制程度与DSP含量相关。因此,由荧光信号的强弱可以检测磷酸酶水解受抑制的程度,从而确定出样品中DSP的含量。由于该检测原理基于DSP的生物毒性机理,因而具备较强的特异性,其它种类的贝类毒素不会对本检测形成干扰。
腹泻性贝类毒素是一类成分十分复杂的聚醚类或大环内酯类化合物,一般可分为∶酸性成分OA及其天然衍生物DTX 1~ 3;中性成分聚醚内酯(PTXs);其它成分,如YTX等[7-9]。目前已经证实与腹泻有关的组分是其中的酸性成分OA及其衍生物DTX-1和DTX-3[9]。其中,小鼠OA的i.v.LD50和i.p.LD99均为200μg/kg,DTX-1 的 i.v.LD50和 i.p.LD99约为160μg/kg,DTX -3 的 i.v.LD50和 i.p.LD99均 为500μg/kg[7,9]。有研究表明,通过共轭物的水解、氧化及非酸形式的酰化作用,可以实现DTX与OA之间的转化[10]。因此,选择OA(大田软海绵酸)作为腹泻性毒素的标准溶液进行加标回收或制备模拟染毒样品具有较强的代表性。在天然状态下,OA及其衍生物可能是在某些藻类的叶绿体中合成[11],并贮存于其胞质周围的液泡中[12],再通过生物链到达贝类的肠腺。新鲜贝肉中所可能存在的某些活性酶成分可以降解游离态的OA。在预实验过程中,曾选用新鲜贝肉作为基质,加标样品及模拟染毒样品的回收率均低于50%(数据未显示)。因此在后期实验中,均对以上样品的基质进行高温灭活处理。
目前已有13个国家或组织制定了贝类中DSP的限量标准,各国对于DSP的限量标准多数基于OA及其衍生物的小鼠i.v.LD50和i.p.LD99量而制定。如FDA、日本、加拿大、澳大利亚、新西兰、朝鲜等制定的DSP限量为20μg/100g(200μg/kg);EU、德国、葡萄牙、爱尔兰、英国等制定的DSP中主要毒性成分OA限量为 16μg/100g(160μg/kg)[13]。我国 GB/T 18406.4-2001《农产品安全质量无公害水产品安全要求》规定DSP的限量为60μg/100g(600μg/kg)。参考国内外对贝类中DSP的限量要求,并考虑到本方法的实际检出限及其主要应用于筛选检测的特点,将磷酸酶抑制法对贝类产品中DSP的阳性检出限暂定为200μg/kg。即将筛查结果低于200μg/kg的样品视为DSP阴性,而检测结果高于这一数值的样品视为可疑阳性。
2.2 标准溶液检测结果
为检验磷酸酶抑制法的可靠性,配制了一系列不同浓度的OA标准液,使用1.1所述试剂盒进行检测,结果如表1所示。
由表1可见,使用磷酸酶抑制法对同一浓度的OA标准溶液进行三次测试,结果具有较好的重复性。检测所得出的判定结果与标准溶液浓度一致,即∶标准溶液浓度≥200μg/kg的,检测结果均为阳性;标准溶液浓度低于200μg/kg的,检测结果为阴性,未出现阴阳性颠倒错判的情况。三次检测平均值与实际浓度之间的误差在±12%之间,即本方法的检测准确率接近90%。当OA浓度在200μg/kg附近时,判定结果可能出现假阴性或假阳性的情况。当标准溶液浓度较低(<80μg/kg)时,本方法不易获得准确的检测数据,但此现象对检测结果的判定无影响。
2.3 模拟阳性样品检测及重复性验证结果
考虑到本方法的实际检测对象为贝类样品,标准溶液与实物贝类样品可能会有一定差异。因此选用市售干贝,经高温灭活后添加OA标准溶液,配制成不同浓度的模拟阳性样品,使用1.1所述试剂盒进行检测,检测结果如表2所示。
由表2可见,对单个浓度的模拟阳性样品重复多次检测,结果显示了良好的重复性。检测的平均加标回收率在±14%之间。检测的阴阳性判定结果与加标情况相一致,即∶加标浓度在200μg/kg及以上的,检测结果均为阳性;加标浓度低于200μg/kg的,检测结果为阴性,未出现阴阳性颠倒错判的情况。

表1 标准溶液检测结果

表2 加标回收样品检测结果
以三种市售贝类(扇贝、蛤蜊、牡蛎)为基质,经灭活处理后,分别制成OA浓度为100、240μg/kg的模拟染毒样品,分别交由三名检验人员在盲样的情况进行检测,结果如表3所示。
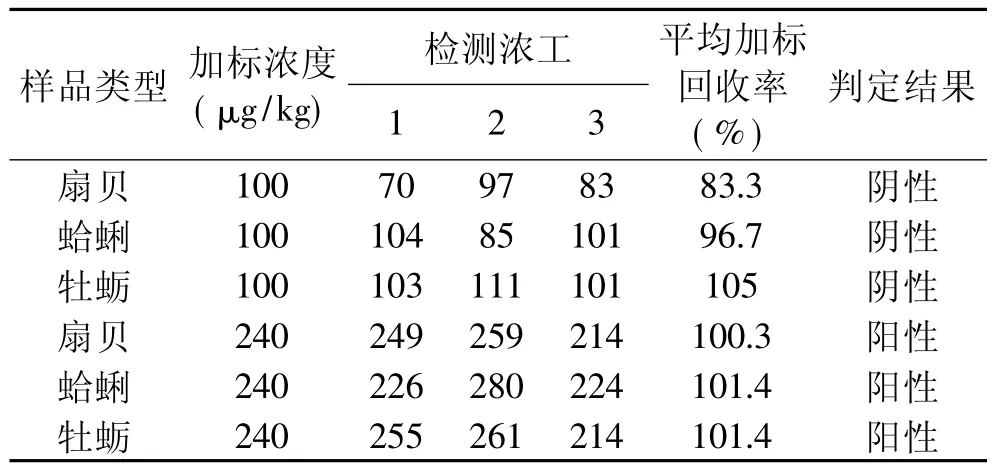
表3 重复性验证结果
对3种模拟染毒样品的检测结果显示出良好的重复性与较高的加标回收率。而在阴阳性判断方面,三名检验人员的检测结果完全一致,即∶对于加标浓度为100μg/kg的样品,判定结果均为阴性;加标浓度为240μg/kg的样品,判定结果均为阳性。此结果证明,对于DSP含量明显高于或低于筛选检出限(200μg/kg)的样品,磷酸酶抑制法的判定结果是完全正确的。
综合表1~表3的结果显示,使用磷酸酶抑制法可以对样品中是否含有腹泻性贝类毒素(DSP)进行定性检测,并可以对样品中贝类毒素的大致含量进行测定。该方法判定准确率高,仅当DSP浓度在(200±20)μg/kg时,才可能出现假阴性或假阳性,因此是一种行之有效的快速筛选方法。使用该方法,检测结果≤200μg/kg的样品,可判定为DSP阴性;而检测结果>200μg/kg的样品应判定为DSP可疑阳性,显示该水产品可能受到腹泻性贝类毒素DSP的污染。
2.4 市场采样样品检测结果
证明了磷酸酶抑制法是腹泻性贝类毒素DSP的有效筛查方法之后,在市场上选购了22批次的贝类产品,使用TOXINLINE-DSP腹泻性贝类毒素试剂盒进行检测,检测结果如表4所示。
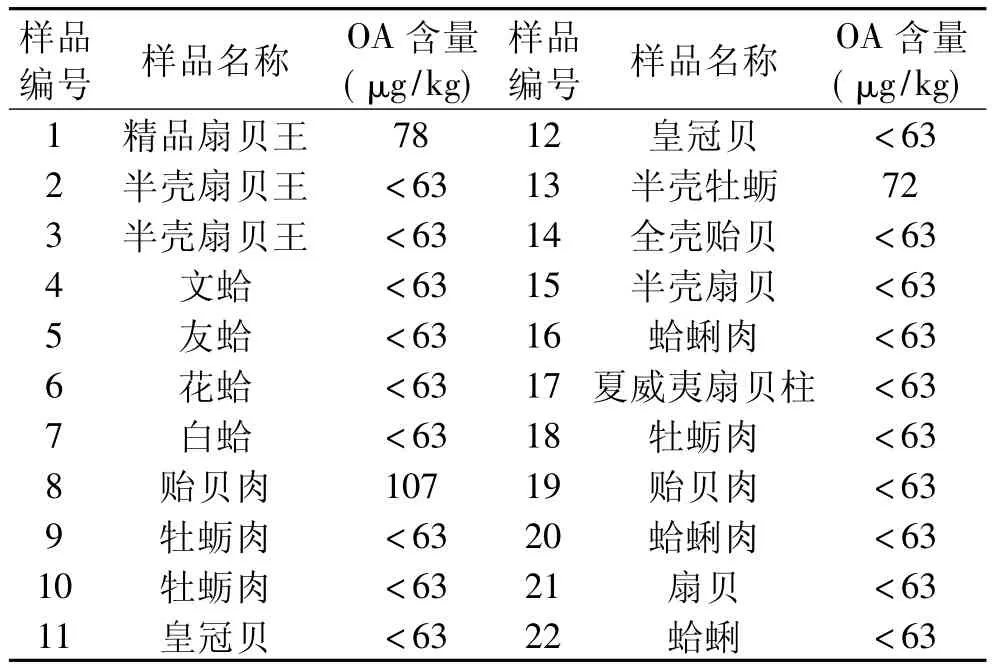
表4 市场采样贝类样品检测结果
表4结果显示,经检测,目前市售贝类水产品的DSP含量一般低于100μg/kg。由此可见,使用磷酸酶抑制法,以200μg/kg为阳性筛选检出限,可以做到将大批量的样品快速筛查,在尽可能短的时间内排除绝大部分的阴性样品,并筛选出可能受到污染的可疑阳性样品,送交有条件的实验室用其他方法进行进一步确认,从而在最大范围内节省检测时间与人力成本,提高检测效率。
3 结论
综上所述,使用磷酸酶抑制法可以对样品中是否含有腹泻性贝类毒素(DSP)进行定性检测,并可以对样品中贝类毒素的大致含量进行测定。本方法检测耗时较短(<4h),特异性、重复性较好。本文所提出的阳性筛选检出限(200μg/kg)远低于我国相关标准的规定(600μg/kg),是一种较为理想的筛选方法,能满足世博会等重大场合对食品安全保障的需求。值得指出的是,有研究表明,有些种类的贝类中可能含有某种成分能降低DSP的水解效率,使得本检验方法未必适合所有的贝类样品[14]。此外,由于天然含腹泻性贝类毒素DSP样品不易获得,缺乏由天然阳性样品中得出的检测数据,还需要在后期检测过程中对本检测方法进行完善与补充。
[1]杨维东,彭喜春,刘洁生,等.腹泻性贝毒研究现状[J].海洋科学,2005,29(5):66-72.
[2]Yasumoto T,Oshima Y,Yamaguchi M.Occurrence of a new shellfish poisoning in the Tohoku District[J].Bull Jpn Soc Sci Fish,1978,44:1249-1255.
[3]李伟才,栾刚,李立,等.我国沿海部分海区贝毒毒素的调查[J].海洋科学,2000,24(9):19-22.
[4]刘宁,潘国伟,李春盛,等.辽东湾赤潮污染海区贝类软海绵酸的染毒情况调查分析[J].中国公共卫生,1999,15(3): 209-210.
[5]周名江,朱明远,张经.中国赤潮的发生趋势和研究进展[J].生命科学,2001,13(2):54-59.
[6]曹际娟,卫锋,马惠蕊,等.贝类毒素检测技术及研究进展[J].检验检疫科学,2004,14(1):53-56.
[7]陈则玲,付云娜,巩宁.腹泻性贝毒及其高效液相色谱检测方法[J].海洋通报,2000,19(1):73-78.
[8]丁君.赤潮毒素中腹泻性贝毒和麻痹性贝毒的研究及进展[J].大连水产学院学报,2001,25(3):212-218.
[9]Burgess V,Shaw G.Pectenotoxins-an issue for public health (A review of their comparative toxicology and metabolism)[J]. Environment International,2001,27:275-283.
[10]Moroňo A,Arévalo F,Femández M L,et al.Accumulation and transformation of DSP toxins in mussels Mytilus galloprovincialis during a toxic episode caused by Dinophysis acuminate[J].Aquatic Toxicology,2003,62:269-280.
[11]Zhou J,Fritz L.Okadaic aid antibody localizes to chloroplasts in the DSP-toxin-producing dinoflagellatesProrocentrum limaDodge andProrocentrum maculoaum[J].Phycologia,1994,33 (6):455-461.
[12]Barbier M,Amzil Z,Mondeguer F,et al.Okadaic acid and PP2A cellular immunolocalization inProrocetrumlima(Dinophyceae)[J].Phycologia,1999,38(1):41-46.
[13]赵晓芳,计融.国内外腹泻性贝类毒素管理控制措施的比对分析[J].中国热带医学,2006,6(2):350-354.
[14]Villar-González M L,Rodríguez-Velasco B,Ben-Gigirey,et al.Assessment of the hydrolysis process for the determination of okadaic acid-group toxin ester:Presence of okadaic acid 7-0-acyl-ester derivates in Spanish shellfish[J].Toxion,2008,51 (5): 765-773.
Study on determination of diarrhetic shellfish poisoning(DSP) in shellfish by phosphatase inhibition method
HU Xue-lian,QU Qin-feng,GU Wen-jia
(Shanghai Institute of Quality Inspection and Technical Research,Shanghai 200233,China)
The application of phosphatase inhibition assay as a screening detecting method of diarrhetic shellfish poisoning(DSP)was studied.The principles of this method were explored and the threshold value for detection limit was determined in this study,as well as the standard solution,the artificially contaminated samples and the market-sell samples.The reproducibility of this method was also discussed.As a result,the method of phosphatase inhibition assay showed a high veracity and good reproducibility.The detection limit we reached(200μg/kg)was much lower than the set standard of relevant stipulate(600μg/kg).Therefore,the method of phosphatase inhibition assay is an ideal way to detect DSP in aquatic products.
diarrhetic shellfish poisoning(DSP);phosphatase inhibition assay;screening detecting method
TS207.3
A
1002-0306(2011)11-0437-04
2010-08-31
胡雪莲(1981-),女,硕士,工程师,研究方向:食品科学。

