芸豆蛋白酶解物不同脱盐工艺的比较研究
张 飞,任海伟,唐学慧,李 雪,袁亚兰,高瑜璟,苏雪艳
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
芸豆蛋白酶解物不同脱盐工艺的比较研究
张 飞,任海伟*,唐学慧,李 雪,袁亚兰,高瑜璟,苏雪艳
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
分别将离子交换树脂法和大孔吸附树脂法用于对芸豆蛋白酶解物(KBPHs)的脱盐工艺,并对其进行比较研究,分析脱盐前后KBPHs的理化成分和DPPH·清除活性。结果表明,大孔吸附树脂对KBPHs的脱盐效果优于离子交换树脂。静态吸附和解吸实验表明,H103树脂的吸附性能优于其他3种树脂。动态脱盐的最佳条件为:pH4.5、浓度45.5mg/mL的KBPHs液以1BV/h的流速上样、1BV/h的流速水洗、2mL/min的80%乙醇解吸。该条件下,H103大孔树脂对KBPHs的脱盐率为87.31%,回收率达82.37%。脱盐后KBPHs中灰分含量仅为1.81%,DPPH·清除活性的HSC50值为0.53mg/mL。
芸豆蛋白酶解物,离子交换树脂,大孔吸附树脂,脱盐,DPPH·清除活性
芸豆(Phaseolus vulgaris Linn.sp)学名菜豆,是普通菜豆和多花菜豆之总称,属豆科(Leguminosae)菜豆属(Phaseolus L.)的小宗杂粮作物。芸豆不仅蛋白含量高,而且必需氨基酸组成与FAO/WHO模式相近,具有很高的营养价值。芸豆蛋白酶解制备的抗氧化肽具有安全性高、消化吸收快等特点,但由于酶解过程中不断加入酸碱溶液来调节反应体系的pH,导致产品中残留大量无机盐。这些无机盐成分不仅影响最终产品的口感,而且影响其生物活性的进一步研究,因此必须进行脱盐处理。目前的脱盐方法有多种,如超滤、大孔吸附树脂、凝胶层析和离子交换树脂等,其中超滤适宜工业化生产,但由于多肽分子量较低,可能会造成低分子量多肽的损失,影响回收率;凝胶层析可用于实验室分析;离子交换树脂脱盐本质上是利用离子交换树脂与溶液中的离子发生交换反应进行分离纯化,分离效率高,适用于组份的富集和高纯物质的制备。大孔吸附树脂主要通过分子间作用力如范德华力或氢键等进行吸附,由于树脂与被分离成分间的吸附为物理吸附,被吸附的物质较易洗脱,所以成本低、效率高、稳定性好[1]。本文将离子交换树脂和大孔吸附树脂用于芸豆蛋白酶解物(KBPHs)的脱盐工艺,并对其进行比较研究,以期探寻一种适于KBPHs脱盐的新方法,分离得到活性强、纯度高的产品,从而为产业化开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
芸豆蛋白粉 以干基计,蛋白质含量95.47%,实验室自制;Alcalase碱性蛋白酶 酶活力2.4× 105U/mL,Novo公司;2,2-二苯基-1-苦味肼基自由基(DPPH·,C18H12N5O6) Sigma公司;001×7(732)强酸性苯乙烯型阳离子交换树脂、201×7(717)强碱性苯乙烯型阴离子交换树脂 上海树脂厂;D3520、H103、AB-8、S-8大孔吸附树脂 南开大学化工厂;其余试剂 均为分析纯。
ORION818pH计 美国奥立龙公司;FD-1型台式冷冻干燥机 北京博医康实验仪器有限公司; WFJ2000紫外可见分光光度计 尤尼柯(上海)仪器有限公司;DDS电导率仪 上海雷磁仪器厂。
1.2 实验方法
1.2.1 芸豆蛋白酶解物(KBPHs)的制备 将5%的芸豆蛋白溶液(w/v)于90℃预处理10min,冷却后调节pH为9. 0;然后加入Alcalase碱性蛋白酶(加酶量为2000U/g蛋白底物),50℃恒温水浴酶解6h,酶解过程中用1mol/L NaOH维持pH恒定。酶解结束后沸水浴10min钝化酶,冷却后调节pH为4.4,4000r/min离心10min,收集上清液备用。
1.2.2 离子交换树脂脱盐
1.2.2.1 树脂的预处理 树脂用酒精浸泡去除少量有机物质,再用超纯水将树脂中异物漂洗干净,浸泡12h充分吸水膨胀。732阳离子交换树脂采用酸-碱-酸方法处理,717阴离子交换树脂采用碱-酸-碱方法处理[2],处理后水洗至中性,湿法装柱(3.6× 50cm),待用。
1.2.2.2 离子交换树脂最佳装填量的确定 阴阳离子树脂初始装柱量各为300mL。将1L浓度为2% (w/v)酶解液先进入732阳离子柱,随时测定流出液pH,由于交换了H+在溶液里面,从阳离子柱流出的溶液呈酸性,记录阳离子交换树脂饱和(流出液与原液pH相当)时的进样量;同样由717阴离子柱交换下来的OH-进入溶液,使流出液pH升高,记录阴离子交换树脂饱和时的进样量,确定树脂的最佳装填量。
1.2.2.3 洗脱流速的确定 取1L浓度为2%(w/v)的酶解液在15℃条件下分别以1、3、5、8、10BV/h的流速依次通过阳、阴离子交换柱,并用少量超纯水淋洗后收集流出液,测其氮回收率和脱盐率。1
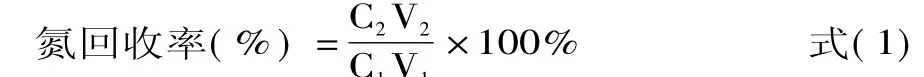
1
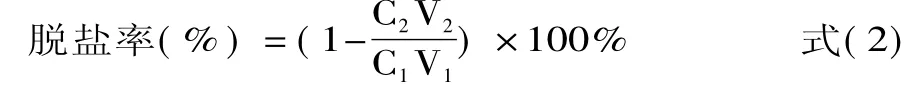
式中∶C1-原液盐浓度(g/100mL);C2-流出液盐浓度(g/100mL);V1-原液体积(mL);V2-流出液体积(mL)。
1.2.3 大孔吸附树脂脱盐
式中∶C1-原液含氮量(g/100mL);C2-回收液氮含量(g/100mL);V1-原液体积(mL);V2-回收液体积(mL)。
1.2.3.1 大孔吸附树脂的预处理 将一定量不同型号的大孔吸附树脂先用无水乙醇浸泡24h,使树脂充分溶胀后用无水乙醇洗至220nm处无吸收,再用超纯水充分漂洗,洗净乙醇,65℃下真空干燥,备用。
1.2.3.2 大孔吸附树脂的筛选 在选定的实验条件下对4种大孔吸附树脂分别进行静态吸附和解吸实验。向250mL锥形瓶中加入2g预处理后的干树脂,无水乙醇充分溶胀,用超纯水洗净乙醇。接着,加入浓度为30mg/mL的酶解液20mL,将锥形瓶放入摇床中室温振荡24h(振荡速度200r/min)。振荡结束后将树脂与样品溶液过滤分离,测定溶液中的肽浓度,并计算4种大孔吸附树脂对KBPHs的吸附率、吸附量。然后选择80%乙醇作为洗脱剂,对已经吸附酶解液的树脂进行解吸,计算解吸率。

1.2.3.3 H103树脂动态吸附及解吸特性的研究 将处理后的H103树脂装满层析柱(2.5cm×60cm)备用。首先进行预实验,确定H103树脂脱盐的部分参数,即标准上样溶液的最佳pH为4.5,KBPHs浓度为45.5mg/mL,解吸剂为80%乙醇。
动态吸附实验∶室温条件下,将上述标准上样溶液分别以1、1.5、2BV/h的流速流经层析柱,用紫外检测器检测流出液的 A220nm,以 A220nm=0.05为透过点。比较不同吸附流速时的穿透体积,确定最佳吸附流速[3]。
动态解吸实验∶将上述标准上样溶液以1BV/h流速流经层析柱,直至动态吸附平衡;然后用超纯水以1BV/h的流速洗涤层析柱,每5mL收集1管,测定电导率。当电导率与超纯水接近一致且流出液A220nm=0.05时,再用80%乙醇以2.0mL/min流速经过层析柱,每5mL收集一管,测定A220nm,直至吸光度接近0.01为止,绘制动态解吸曲线。将解吸液合并后测定其肽浓度,计算脱盐率和回收率[4]。

1.3 DPPH·自由基清除活性的研究
DPPH·自由基清除活性的测定方法参考文献[5]。HSC50为半清除浓度,即自由基清除率为50%时所需的肽浓度。HSC50值越小,表明达到半清除率所需浓度越低,自由基清除能力越强。
1.4 成分分析
氮含量测定∶参照GB/T5009.5- 2003;多肽含量测定∶Folin-酚法;灰分含量测定∶参照GB/T5009.4-2003。

表2 不同大孔吸附树脂对KBPHs的静态吸附和解吸性能
2 结果与讨论
2.1 离子交换树脂脱盐工艺的确定
2.1.1 离子交换树脂装柱量的确定 实验表明,当进样量为7.5倍柱体积(BV)时,阳离子树脂达到饱和;当进样量为5BV时,阴离子交换树脂达到饱和,故确定阴阳离子交换树脂装添量以2∶3装柱,即732阳离子装添量200mL,711阴离子交换树脂装添量为300mL。
2.1.2 流速的确定 酶解液的脱盐率与流速、柱长、柱径及温度有很大关系,当柱长较长、柱径较细时,脱盐率较高,因为柱径/柱高越小,柱的塔板数越高,离子在柱中达到交换平衡的次数越多。蛋白酶解液以不同流速通过离子交换柱后,其脱盐率和氮回收率变化情况如表1所示。
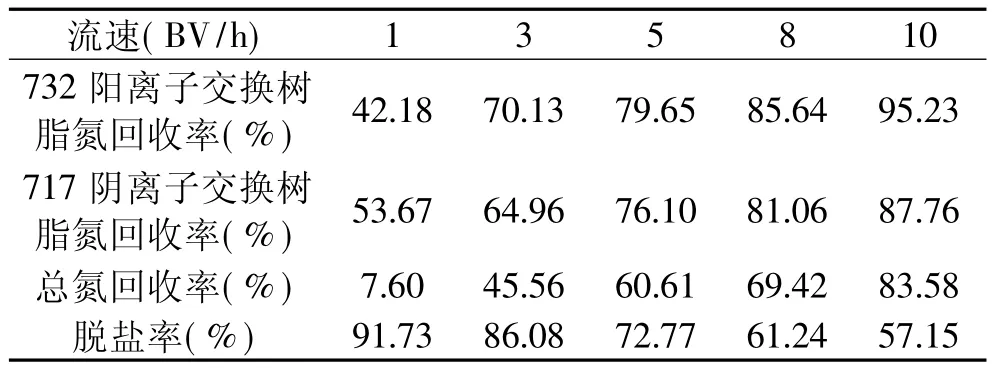
表1 离子交换树脂脱盐后的氮回收率和脱盐率
由表1可知,当洗脱流速从5BV/h增加到8BV/h时,总氮回收率从60.61%升高至69.42%,而脱盐率则由72.77%降低至61.24%,进一步增大流速至10BV/h时,总氮回收率虽然增加(83.58%),但脱盐率则进一步降至57.15%。这是由于当洗脱流速较小时,酶解液与树脂之间有较长的传质交换时间,部分离子化的肽可较大程度上被交换到树脂上造成蛋白回收率较低;当流速过大时,又有部分盐离子来不及交换到树脂上就被洗脱下来,导致脱盐效果不理想;综合考虑脱盐率和氮回收率两方面因素,选择5BV/h的洗脱流速进行脱盐较为合理。
2.2 大孔吸附树脂脱盐工艺的确定
2.2.1 大孔吸附树脂的筛选 本文考察了4种非极性大孔吸附树脂对KBPHs的静态吸附和解吸性能。结果见表2。
由表2可知,H103大孔吸附树脂的吸附性能最好,比较树脂的物理结构参数,发现其比表面积最大,这可能是影响树脂吸附效果的重要因素。因为比表面积决定了吸附剂的饱和吸附量,而孔径等其它物理结构特性对树脂的吸附效果影响不大[3],同时H103大孔树脂对KBPHs具有较强的选择吸附性。从静态吸附与解吸特性来看,H103树脂不仅具有较高的吸附率和较大的吸附量,而且解吸率较高,故选择该树脂对KBPHs进行脱盐研究。
2.2.2 不同吸附流速对H103大孔树脂吸附性能的影响 对于相同浓度的样品溶液,若吸附流速过大,被吸附物质来不及扩散到树脂内表面就提前泄露而造成样品流失,导致树脂吸附量下降;反之,吸附流速过小则吸附时间就会延长。所以确定最佳的吸附流速常常综合考虑树脂的吸附效果和工作效率。不同吸附流速下H103大孔吸附树脂对KBPHs的穿透曲线如图1所示。由图1可知,流速对吸附性能有明显的影响。随着吸附流速由1BV/h提高到2BV/h,穿透曲线斜率增大,说明吸附速度增大,穿透点明显提前,流出液的穿透点通液量减小了38.65%,因而本实验将吸附流速确定为1BV/h。

图1 不同吸附流速条件下穿透曲线
2.2.3 H103动态解吸特性 用80%乙醇以2.0mL/min的流速流经层析柱,对大孔吸附树脂吸附的KBPHs进行解吸,绘制动态解吸曲线,结果见图2。由图2可知,80%乙醇对H103树脂进行动态解吸时,随着解吸的进行,解吸液中多肽浓度逐渐增加,大约31min时出现洗脱峰。35min后解吸曲线趋于平缓,洗脱速度缓慢,可能是酶解液中相对分子质量较大的少量未水解蛋白组分在80%乙醇中的溶解度较低而不易洗脱下来所致。当解吸时间为100min时,KBPHs的回收率达82.37%。
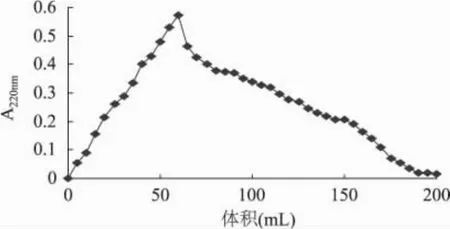
图2 80%乙醇对H103树脂动态解吸曲线
2.3 脱盐效果分析
从脱盐率、DPPH·清除活性以及理化成分等指标综合考察2种脱盐方法对KBPHs的脱盐效果,分析结果见表3。从表3可知,大孔吸附树脂法比离子交换树脂法脱盐更加有效,脱盐率达到87.31%,远高于离子交换树脂法(72.77%);同时大孔树脂脱盐后KBPHs的DPPH·清除活性有所提高,HSC50从脱盐前的1.58mg/mL降低到脱盐后的0.53mg/mL,也高于离子交换树脂法(0.74mg/mL),说明经大孔吸附树脂纯化脱盐后,相对分子质量较小的抗氧化活性肽得到了有效的富集。从脱盐前后产品的理化成分来看,脱盐后KBPHs的蛋白质和多肽相对含量都有所提高,灰分含量显著下降,尤其经过大孔树脂脱盐后,蛋白含量达到91.25%,符合一级大豆肽粉国家标准(GB/T22492-2008)的要求。
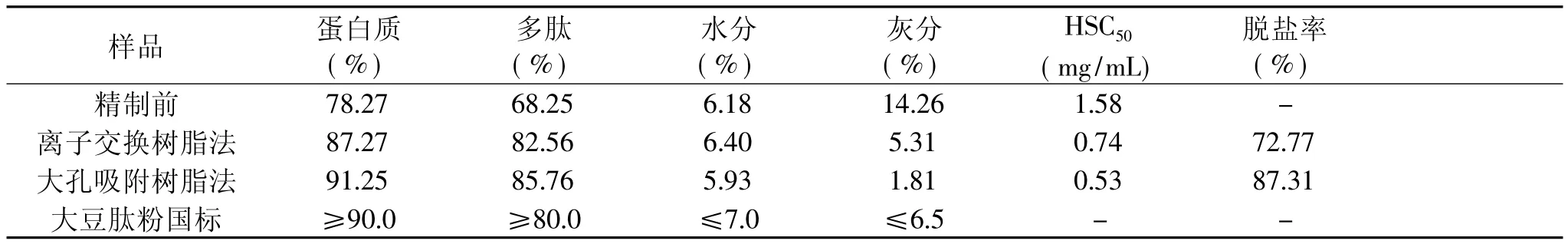
表3 不同方法对KBPHs脱盐的效果分析
3 小结
与离子交换树脂脱盐相比,采用大孔吸附树脂对芸豆蛋白酶解物进行脱盐纯化处理更加有效,产品纯度高,适宜于工业化生产。H103大孔吸附树脂脱盐最佳条件为pH4.5、浓度45.5mg/mL的KBPHs液以1BV/h的流速上样、1BV/h的流速水洗、2mL/min的80%乙醇解吸。该条件下,H103大孔树脂对KBPHs的脱盐率为87.31%,回收率达82.37%。脱盐后KBPHs中灰分含量仅为1.81%,DPPH·清除活性的HSC50值为0.53mg/mL。
[1]赵一明,王璋,许时婴.大孔吸附树脂对酪蛋白非磷肤脱盐效果的研究[J].食品与发酵工业,2007,33(11):22-25.
[2]国家技术监督局.GB/T5476-1996离子交换树脂预处理方法[S].北京:中国标准出版社,1996.
[3]袁晓晴,顾小红,汤坚.采用大孔吸附树脂对癫葡萄酶解物进行脱盐[J].食品与发酵工业,2008,34(6):57-61.
[4]任清,张晓平,赵世锋.利用大孔吸附树脂DA201-CⅡ对燕麦蛋白水解液脱盐的研究[J].食品科学,2009,30(10): 118-122.
[5]王玉丽,任海伟,李志忠.用清除DPPH自由基法评价药黑豆色素的抗氧化能力[J].食品工业科技,2009,30(8): 102-105.
Comparative study on desalinization process of kidney bean protein hydrolysates
ZHANG Fei,REN Hai-wei*,TANG Xue-hui,LI Xue,YUAN Ya-lan,GAO Yu-jing,SU Xue-yan
(College of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China)
In order to obtain optimal technological processing for desalinization of kidney bean protein hydrolysates (KBPHs),comparison between ion exchange resin(IER)and macroporous adsorption resin(MAR)was conducted and the optimal conditions of the two methods was determined.Physicochemical compositions and DPPH· scavenging activities of KBPHs using both desalinization methods were also compared.The results showed that the desalinization effect of MAR was better than that of IER.The experiments of static adsorption and desorption showed that MAR H103 had the highest adsorption-desorption capability to KBPHs among 4 resins.In further study,the optimal desalination conditions of KBPHs with the resin H103 were confirmed as follows:pH of KBPHs 4.5,concentration of KBPHs 45.5mg/mL,flow rate of water washing 1BV/h,and desorption rate of 80%ethanol 2.0mL/min.Under these conditions,the desaltion rate reached about 87.31%,and the recovery of KBPHs was about 82.37%.In the optimization of condition,KBPHs had a remarkable DPPH· scavenging activities,HSC50was 0.53mg/mL.
kidney bean protein hydrolysate(KBPH);ion exchange resin;macroporous adsorption resin; desalination;DPPH·scavenging activities
TS210.1
B
1002-0306(2011)11-0309-04
2010-01-04 *通讯联系人
张飞(1981-),男,助理研究员,研究方向:生物学。
2009年国家大学生创新计划项目;甘肃省青年科技基金(1107RJYA065)。

