菠萝皮果胶的提取及结构组成研究
冯 静,梁瑞红,刘成梅,刘 伟,夏天添,陈 军
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
菠萝皮果胶的提取及结构组成研究
冯 静,梁瑞红,刘成梅*,刘 伟,夏天添,陈 军
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
以菠萝皮为原料,采用漂烫灭酶、酸法提取和醇沉工艺提取果胶。对提取果胶的结构和组成进行分析,并与常见的双子叶植物(苹果、柑橘)果胶进行比较。结果表明:菠萝皮经10min漂烫灭酶后,在料液比1∶15、pH2.0、温度80℃条件下提取100min;提取液经2.5倍体积乙醇在pH3.7醇沉,此条件下果胶的得率为4.68%,半乳糖醛酸含量为68.73%。菠萝皮果胶中含有部分甲氧基和少量乙酰基,FCC滴定法测定其酯化度为48.73%,是一种含乙酰基的低酯果胶。果胶多糖中含有鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖6种单糖,其组成摩尔比为0.74∶0.79∶1.54∶0.92∶0.84∶1.00,与双子叶植物果胶存在很大差异。
菠萝皮,果胶,提取,结构,单糖
目前国内外果胶研究的来源几乎都是双子叶植物,包括柑橘、橙、苹果、向日葵、甜菜、马铃薯、薜荔等[1-6],而对单子叶植物的果胶组成及性质研究甚少。菠萝(Pineapple)又名凤梨,学名Ananas comosus(L)Merr,凤梨属凤梨科,多年生单子叶常绿草本果树。菠萝生长迅速,生产周期短,但果实不易贮存,除极少部分直接销售外,大部分用于加工成罐头和果脯,加工副产物——菠萝皮渣(包括外皮、两端和果眼)约占全果总重量的50%~60%,若不加以有效利用将会成为严重的环境污染源。果胶作为一种天然耐酸的理想胶凝剂,已广泛用于食品、生化、化妆品和制药工业。果胶提取方法主要有∶酸法、离子交换法、草酸铵法、微波法、超声波法、微生物法、酶法等[7]。菠萝皮中果胶物质含量丰富,占湿重的1.7%,干重的9.2%[8],远高于其他水果和蔬菜。目前,关于菠萝皮果胶提取的报道较少,张初署等采用草酸铵作为提取溶剂结合超声波振荡处理法从菠萝皮渣中提取果胶,提取率达到90%[8]。刘明绶研究了菠萝皮联产色素和果胶的工艺流程,菠萝皮浸提色素后提取果胶,果胶得率为1.32%[9]。本研究探讨酸法提取菠萝皮果胶的最佳条件,并通过改进醇沉条件改善提取效果。采用傅立叶变换红外光谱仪测定菠萝皮果胶的结构,毛细管气相色谱法测定果胶多糖的单糖组分,分析菠萝皮果胶的结构与组成,并与常用双子叶植物(苹果、柑橘)果胶进行比较,以期为菠萝皮果胶资源的开发提供科学依据。
1 材料与方法
1.1 材料与设备
新鲜菠萝皮 收集于江西南昌东湖区;间羟基联苯、半乳糖醛酸、苹果果胶、柑橘果胶 Sigma公司;溴化钾 阿拉丁公司,光谱纯;吡啶 阿拉丁公司,色谱纯;盐酸、无水乙醇、硫酸、鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、盐酸羟胺、乙酸酐、三氟乙酸 国产,分析纯。
AR224CN电子天平 美国 Ohaus公司; SevenMulti型 pH/电导率/离子综合测试仪 瑞士Mettler Toledo公司;Du640紫外可见分光光度计 美国Beckman Coulter公司;Nicolet FT-IR 5700型傅里叶红外光谱仪 美国Thermo Electron公司;6890N型气相色谱仪∶配有FID检测器 美国Agilent公司。
1.2 实验方法
1.2.1 菠萝皮果胶的提取工艺流程 菠萝皮→灭酶→干燥→粉碎→酸提→过滤→滤液→醇沉→果胶沉淀→纯化→菠萝皮果胶
1.2.2 操作要点
1.2.2.1 灭酶 高温高压、漂烫、酸洗三种灭酶处理的菠萝皮,提取果胶,通过对比果胶得率,比较三种灭酶方式的优劣。
高温高压灭酶∶采用高压灭菌锅在 121℃、0.1MPa对菠萝皮灭酶10min。
漂烫灭酶∶菠萝皮在沸水中热烫10min。
酸洗灭酶∶用pH3.5的蒸馏水(17℃)洗涤菠萝皮20min,重复三次,其间用HCl溶液保持pH3.5[10]。
1.2.2.2 酸提 将粉碎过60目筛的菠萝皮粉加入蒸馏水,调节pH,在恒温水浴中提取一定时间后,过滤得提取液。
1.2.2.3 乙醇沉淀 将提取液加入无水乙醇,调节pH,静置1h后,离心,收集沉淀,依次用浓度为70%、80%、90%的乙醇溶液洗涤纯化,烘干至恒重。
果胶得率(%)=(提取物干重/菠萝皮干粉重) ×100%
1.2.3 果胶性质分析
1.2.3.1 半乳糖醛酸含量测定 采用间羟基联苯比色法[11]。
1.2.3.2 果胶酯化度测定 采用 Food Chemical Codex(FCC)滴定法[12]和红外光谱分析确定果胶的酯化度(DE)。
1.2.3.3 果胶红外光谱分析 取干燥样品1mg与100mg KBr混合研磨后,制成透明压片,采用傅里叶变换红外光谱仪在400~4000cm-1区内进行光谱扫描[13]。
1.2.3.4 果胶单糖组成分析 采用糖腈乙酸酯衍生法[14]对单糖进行衍生,气相色谱法(GC)分析单糖组成及其物质的量比。
取鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖6种标准单糖各2mg置于安瓿管中,加入10mg盐酸羟胺,0.5mL吡啶溶解,加塞,90℃恒温水浴振荡30min,冷却至室温后,加入0.5mL乙酸酐,加塞,90℃恒温水浴振荡30min,冷却至室温,即得混合标准单糖糖腈乙酸酯衍生物。
称取12mg样品于安瓿管中,加入2mL浓度为2mol/L的三氟乙酸,真空封管,110℃水解3h,反应完成后冷却至室温,N2挥干,得到水解后的单糖混合物。将水解后的样品按照相同方法进行衍生,得菠萝皮果胶单糖糖腈乙酸酯衍生物。
色谱条件∶色谱柱∶DB-1701石英毛细管柱(30.3m×0.32mm×0.25μm);升温程序∶初始温度170℃,保持 2min,以 5℃/min升至 250℃,保持10min;色谱柱温度∶250℃;进样口和检测器温度∶250℃;进样量1μL,分流比20∶1。
2 结果与讨论
2.1 菠萝皮果胶制备工艺选择与优化
2.1.1 不同灭酶方式对果胶得率的影响 采用高温高压、漂烫、酸洗等不同的灭酶方式,其果胶得率分别为2.52%、3.96%、3.86%。菠萝皮原料经漂烫和酸洗处理,果胶得率明显高于高压灭酶处理。这可能是由于水分子的包围再结合高温或酸处理,能很好地使溶于水的果胶从不溶于水的纤维网中脱离出来,利于后续提取。Christensen报道在低于90℃的温度下,将柑橘果皮的pH调到3.2~3.9,可使果皮中的天然果胶酯酶失活[10],果胶不发生脱酯化,降低了其对钙的结合作用,降低提取难度;同时甲基的存在对多聚半乳糖醛酸酶产生空间阻隔作用,抑制了果胶的分解。漂烫是在高温下使酶灭活,得率略高于酸洗处理。
2.1.2 酸提取和醇沉工艺的确定 新鲜菠萝皮经漂烫10min灭酶后,烘干粉碎,采用酸提法提取果胶。结果表明,当提取料液比较低时,溶液粘度大,产品中包含较多杂质从而使果胶得率较高但纯度很低,在料液比达到1∶15后,半乳糖醛酸含量变化趋于平缓;料液比太大,使胶质在溶液中的浓度太低,醇沉效果不理想。pH在2.0时得率最高,pH太高不利于非水溶性原果胶转化为水溶性果胶,pH太低使果胶分子被破坏。当提取温度在50℃以上时,得率变化不大,但提取温度高于80℃,果胶的色泽得到明显改善。延长提取时间有利于提高得率,但长时间的酸性环境也会引起果胶分解。醇沉时随乙醇用量增加,果胶得率增加。这是由于乙醇浓度增加,使更多的杂质沉淀出来。当乙醇用量达到1.5体积,即沉淀体系的乙醇浓度为60%以上时,半乳糖醛酸含量显著增加。乙醇用量为2.5倍体积(乙醇浓度约为71%)时,半乳糖醛酸含量最高。
在醇沉pH3.0~4.0范围内,果胶得率随pH增加而提高,而半乳糖醛酸含量在pH3.7时最高。果胶作为一种酸性多糖,在水中会离解出氢离子,从而达到平衡。果胶的酸离解常数 pKa在3.55~4.10范围内[15],随酯化度(DE)不同而变化。DE为65%的果胶pKa为3.55,DE为0的果胶pKa为4.10[16]。果胶在pH为其pKa值时溶解度达到最小[17],因此通过控制醇沉体系的pH可以提高果胶的沉降得率。
由以上实验确定菠萝皮果胶的制备工艺为∶在料液比1∶15、pH=2.0、温度80℃条件下提取100min,提取液加入2.5倍体积无水乙醇,调节体系pH至3.7,静置离心。在此条件下果胶的得率为4.68%,半乳糖醛酸含量为68.73%。
2.2 菠萝皮果胶红外光谱分析
本实验提取的菠萝皮果胶与市购的苹果果胶及柑橘果胶的红外光谱如图1所示。菠萝皮果胶在3600~2500cm-1出现的宽峰是分子内或分子间O-H伸缩振动的结果;对于果胶,O-H区内的吸收主要来源于半乳糖醛酸聚合物分子内和分子间氢键[18]。2927cm-1附近的吸收峰为 C-H(包括 CH,CH2和CH3)的伸缩振动;对于果胶,半乳糖醛酸甲酯会在2950~2750cm-1之间产生 O-CH3的伸缩振动。1652cm-1和 1740cm-1处分别为自由羧基官能团(COO-)和酯化羧基官能团(-COOR)C=O的吸收峰。这两个特征峰值,可用于确定果胶的酯化度。菠萝皮果胶在1740cm-1处吸收峰很弱,1652cm-1处很强,为低酯果胶,这与酯化度测定结果相一致。在1532cm-1和1438cm-1处的弱峰分别为羧基的不对称伸缩和对称伸缩。另外在1375cm-1附近的弱峰为C-H弯曲振动,1300~1000cm-1之间为C=O伸缩振动弱峰。在1300~800cm-1之间中等强度的吸收峰为果胶的指纹区。经比较,菠萝皮提取物与果胶标品的红外图谱相似,证明其为果胶。
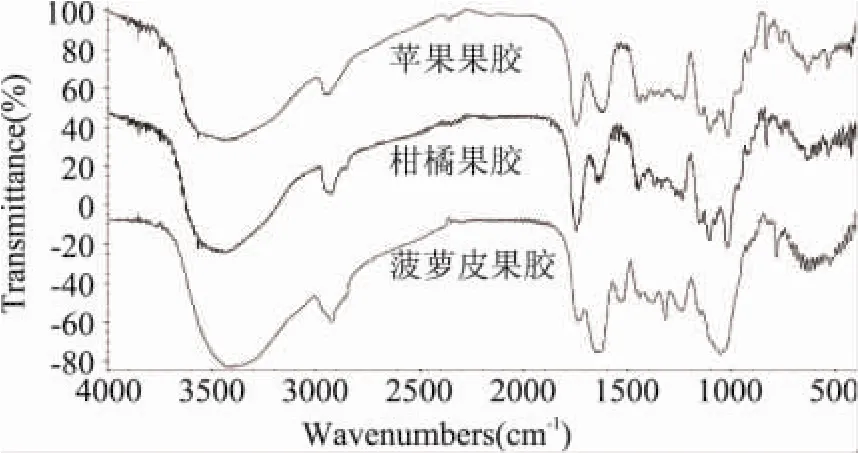
图1 不同来源果胶的红外光谱图
采用孙元琳等人[19]建立的 DE与 A1730/(A1730+ A1630)之间的线性回归方程,y=87.609x+25.768,计算得菠萝皮果胶的DE值为46.61%。FCC滴定法测定值为48.73%。两者间相对误差小于5%,可相互验证。
另外,比较菠萝皮果胶与苹果果胶和柑橘果胶的红外光谱,发现其在1650cm-1和1740cm-1的吸收峰值附近存在较大差异,这是由于不同来源果胶酯化度不同所引起的。菠萝皮果胶在1049cm-1处有吸收,这是苹果果胶和柑橘果胶所没有的。Synytsya[20]发现果胶的乙酰化使吡喃环构象发生变化从而在1064cm-1附近产生吸收峰。由此可知,菠萝皮果胶是一种含乙酰基的低酯果胶。
2.3 菠萝皮果胶单糖组成分析
采用气相色谱法分析菠萝皮果胶的单糖组成,混合标样在毛细管柱中得到了很好的分离,如图2所示。图3~图5分别为菠萝皮果胶、苹果果胶和柑橘皮果胶的单糖组成GC图。通过保留时间定性分析可知,菠萝皮果胶中含有6种单糖,从峰面积可知,鼠李糖,阿拉伯糖,木糖,甘露糖,葡萄糖和半乳糖的摩尔比为0.74∶0.79∶1.54∶0.92∶0.84∶1.00,以木糖和半乳糖居多。苹果果胶中含有五种单糖,以葡萄糖为主,未检出甘露糖;柑橘果胶中含有四种单糖,以半乳糖居多,还有少量鼠李糖、阿拉伯糖和葡萄糖,未检出木糖和甘露糖。
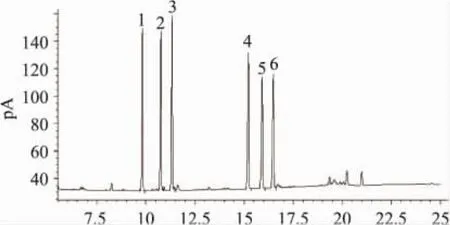
图2 混合标准单糖气相色谱图
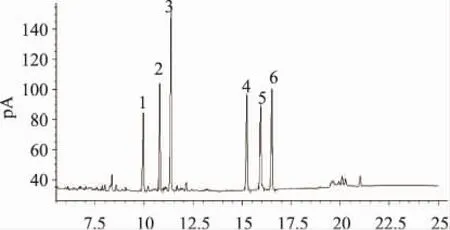
图3 菠萝皮果胶单糖气相色谱图
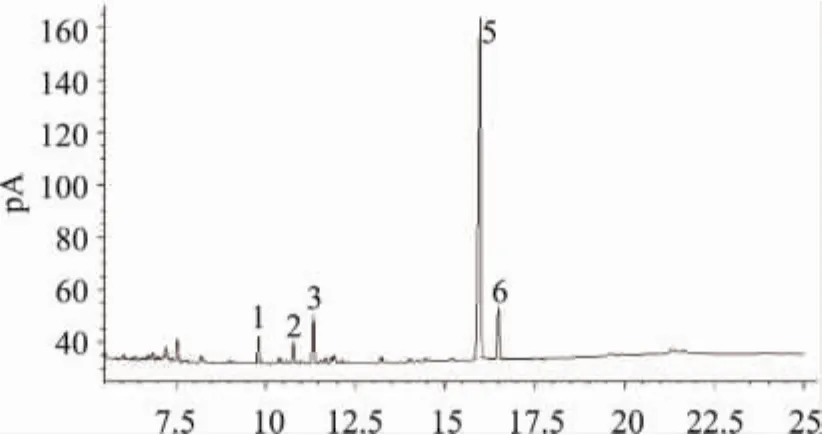
图4 苹果果胶单糖气相色谱图

图5 柑橘皮果胶单糖气相色谱图
Smith等人[21]称,单子叶禾本科植物的初生壁内含有大量的异木聚糖,主要是glucurononarabinoxylans (GAXs),而果胶含量通常较少;而双子叶植物中含有大量果胶多糖和少量的木葡聚糖。菠萝作为单子叶凤梨科的代表植物,其单糖组分中较高的木糖和阿拉伯糖含量表明其初生壁中的非纤维多糖以GAXs为主,组成与禾本科植物相似。
3 结论
本文对菠萝皮果胶的制备工艺进行了研究,以果胶得率和半乳糖醛酸含量作为考察指标,确定了最佳提取条件。在此条件下果胶的得率为4.68%,半乳糖醛酸含量为68.73%。通过傅立叶变换红外光谱仪测定了菠萝皮果胶的结构。其在1049cm-1处的吸收峰证明有乙酰基的存在,1740cm-1处的弱吸收和1652cm-1处的强吸收表明菠萝皮果胶为低酯果胶。FCC滴定法测定菠萝皮果胶的酯化度为48.73%。对菠萝皮果胶、苹果果胶和柑橘果胶的单糖组分分析表明∶菠萝皮果胶含有六种单糖成分,以木糖和半乳糖居多;而苹果果胶中含有五种单糖,以葡萄糖为主;柑橘果胶中含有四种单糖,以半乳糖居多。菠萝皮果胶的单糖组成与市购的双子叶果胶存在很大差异。鉴于菠萝皮果胶与传统双子叶果胶在组成上的差异,可进一步研究对比其凝胶和流变特性,探索不同种属果胶的结构组成对其凝胶机理的影响,从而为果胶胶凝机制提供更全面的理论依据。
[1]汪海波,汪芳安,潘从道.柑橘皮果胶的改进提取工艺研究[J].食品科学,2007,28(2):136-141.
[2]Kratchanova M,Pavlova E,Panchev I.The effect of microwave heating of fresh orange peels on the fruit tissue and quality of extracted pectin[J].Carbohydrate Polymers,2004,56(2): 181-185.
[3]田玉霞,乔书涛,仇农学,等.苹果果胶的结构、单糖组分和稳定性研究[J].食品工业科技,2009,30(11):160-163.
[4]张磊.向日葵盘果胶的制备及其理化性质的研究[D].石河子:石河子大学,2008.
[5]杨希娟,党斌.马铃薯渣中提取果胶的工艺优化及产品成分分析[J].食品科学,2011,32(4):25-30.
[6]梁瑞红,唐翠娥,刘伟,等.水法提取薜荔籽果胶工艺的优化[J].食品研究与开发,2008,29(2):1-5.
[7]岳贤田.国内果胶提取方法研究进展[J].安徽农业科学,2010,38(13):6932-6933,6960.
[8]张初署,秦小明,林华娟,等.菠萝皮渣果胶超声波提取工艺条件研究[J].食品工业科技,2007,28(3):147-149,152
[9]刘明绶.菠萝皮中色素、果胶的提取纯化及性质研究[D].厦门:集美大学,2010.
[10]Christensen J A S.Improved process for treating pectin containing plant material[P].DK:WO2004/020472,2004-03-11.
[11]Blumenkrantz N,Asboe-Hansen G.New method for quantitative determination ofuronic acids[J].Analytical Biochemistry,1973,54:484-489.
[12]Institute of Medicine of the National Academies.Food chemicals codex[M].3rd ed.Washington,D.C:National Academies of Sciences,1981:283-286.
[13]殷军艺,聂少平,林慧霞,等.大粒车前子多糖乙醇分级及其理化性质研究[J].食品科学,2009,30(17):34-37.
[14]张惟杰.糖复合物生化研究技术[M].第二版.杭州:浙江大学出版社,1994.
[15]Plaschina I G,Braudo E E,Tolstoguzov V B.Circulardichroism studies of pectin solutions[J].Carbohydrate Research,1978,60(1):1-8.
[16]Srivastava P,Malviya R.Sources of pectin,extraction and its applications in pharmaceutical industry-an overview[J].Indian Journal of Natural Products and Resources,2011,2(1):10-18.
[17]Kalapathy U,Proctor A.Effect of acid extraction and alcohol precipitation conditions on the yield and purity of soy hull pectin[J].Food Chemistry,2001,73(4):393-396.
[18]Gnanasambandam R,Proctor A.Determination of pectin degree of esterification by diffuse reflectance Fourier transform infrared spectroscopy[J].Food Chemistry,2000,68(3): 327-332.
[19]孙元琳,崔武卫,顾小红,等.傅里叶变换红外光谱法测定当归果胶多糖的酯化度[J].光谱学与光谱分析,2009,29 (3):682-685.
[20]Synytsya A,Copíková J,Matejka P,et al.Fourier transform Raman and infrared spectroscopy of pectins[J].Carbohydrate Polymers,2003,54(1):97-106.
[21]Smith B G,Harris P J.Polysaccharide composition of unlignified cell walls of pineapple[Ananas comosus(L.)Merr.]Fruit[J].Plant Physiology,1995,107(4):1399-1409.
Extraction,structural and compositional characterization of pineapple rind pectin
FENG Jing,LIANG Rui-hong,LIU Cheng-mei*,LIU Wei,XIA Tian-tian,CHEN Jun
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Pineapple rind pectin was prepared by acid extraction after blenching,followed by alcohol precipitation,and the optimal condition was investigated.The structure of pineapple rind pectin was characterized with monosaccharide composition analysis,methylation analysis,FT-IR spectroscopy,and was compared with pectin from dicotyledon.Pineapple rind was blenched for 10 min and pectin was extracted at pH2.0,80℃,for 100 min with solid-liquid ratio 1∶15,and precipitated with ethanol in the ratio 1∶2.5(v/v)at pH3.7.The yield,content of galacturonic acid and degree of esterification was 4.68%,68.73%and 48.73%,respectively.FT-IR spectroscopy of pineapple rind pectin suggested the presence of acetyl groups.Pineapple rind pectin consisted ofsix monosaccharides,and the composition was quite different from dicot pectins.
pineapple rind;pectin;extraction;structure;monosaccharide
TS255.1
B
1002-0306(2011)11-0241-04
2011-18-25 *通讯联系人
冯静(1987-),女,硕士研究生,研究方向:食品加工与保藏。
国家重点实验室目标导向项目(SKLF-MB-201004)。

