HA/ZrO2复合材料颗粒的体外基因毒性的初步研究*
全仁夫, 汤样华, 杨迪生, 黄忠名, 李 伟, 徐金渭, 吴晓春
(1 萧山中医院骨科,浙江 萧山 311200; 2浙江大学附属第二医院骨科,浙江 杭州 310009; 3上海大学材料学院, 上海 200072)
·短篇论著·
HA/ZrO2复合材料颗粒的体外基因毒性的初步研究*
全仁夫1△, 汤样华1, 杨迪生2, 黄忠名1, 李 伟1, 徐金渭1, 吴晓春3
(1萧山中医院骨科,浙江 萧山 311200;2浙江大学附属第二医院骨科,浙江 杭州 310009;3上海大学材料学院, 上海 200072)
目的采用体外微核法评价HA/ZrO2复合材料颗粒的基因毒性。方法按不同比例将羟基磷灰石与二氧化锆粉体混合在高温高压下烧结制备HA/ZrO2复合材料颗粒,纯HA和纯ZrO2颗粒作为对照。制备复合材料颗粒的悬液,分离和培养兔间充质干细胞。MTT法检测复合材料颗粒悬液对兔间充质干细胞增殖促进作用,体外微核试验(MNT) 检测复合材料颗粒悬液对兔间充质干细胞的基因毒性。结果MTT实验显示:纯HA和含HA的复合材料颗粒均对间充质干细胞增殖有一定促进作用,而纯ZrO2颗粒对间充质干细胞增殖没有促进作用,差异显著(P<0.05)。MNT实验显示:HA组与阴性对照组相比差异不显著(P>0.05),与阳性对照组比差异显著(P<0.05); ZrO2组与阴性对照组比差异显著(P<0.01),与阳性对照组比差异不显著(P>0.05)。结论HA/ZrO2复合材料颗粒的基因毒性随着ZrO2比例和复合材料浓度的增加而增加,30%wtHA/70%wtZrO2在200 mg/L时具有显著基因毒性(P<0.01)。
锆; 羟基磷灰石类; 复合材料; 基因毒性
生物材料属于永久性的植入材料,必须具有良好的生物相容性。任何一种新型生物材料在临床使用前,都必须进行生物相容性检测,包括组织学、细胞学、基因及分子学等不同水平的生物学评价。其中,基因毒性主要包括基因突变、染色体异常或基因组的改变,其检测可通过体外及体内实验进行,其中体外实验由于操作方便及代表性强而多用作初步筛选实验。细胞水平的基因毒性主要表现为染色体量及结构的异常,体外微核法(micronucleus testinvitro,MNT)是最常用于检测染色体异常的实验方法。本研究按国家标准GBPT16886 医疗器械生物学评价[1]的要求,拟通过体外微核法对新型生物复合材料-HA/ZrO2梯度复合材料的体外基因毒性进行初步评价,为其应用于临床的可行性做进一步的验证。
材 料 和 方 法
1材料
1.1HA/ZrO2复合材料颗粒的制备 由上海大学高分子材料研究所制备。(1) 纳米羟基磷灰石(hydroxyapatite,HA)粉体的制备:将Ca(NO3)2溶解在95%的乙醇中,制成0.5 mol/L的溶液,(NH4)2HPO4溶解于去离子水中,制成0.5 mol/L的溶液;用氨水调节2种溶液的pH值为10,各加入5滴乙醇胺;在剧烈搅拌下,先将少量的(NH4)2HPO4加入到Ca2+溶液中,使溶液中产生HA晶核,然后将(NH4)2HPO4溶液全部倒入Ca2+溶液中;反应温度为25 ℃,控制pH值为10,搅拌一段时间,陈化12 h;然后用99.7%乙醇洗涤3次,用微波炉快速干燥,最后在700 ℃焙烧1 h,得到HA粉体。(2)纳米ZrO2粉体的制备:配制含给定Y3+/Zr4+比率的氯化钇(Y2O3+HCl)和氯氧化锆的混合溶液(上海化学试剂厂),HCl浓度控制在0.2 mol/L,锆盐浓度选取1.0 mol/L。将混合溶液徐徐加入氨水中,并不断搅拌,保持体系pH值9-10,静止沉淀后得到共沉淀物。将共沉淀物过滤,用蒸馏水洗涤,去除氯离子(<10 mg/L);再用99.7%乙醇洗涤至少6次,去除H2O(使水含量小于4 vol%)。干燥后得到疏松的氢氧化物前驱剂。经750 ℃煅烧2 h后,得到3.0 mol/LY2O3稳定的ZrO2(Y2O3)超细粉末。(3)HA/ZrO2复合材料粉体的制备:按照不同比例将纳米HA粉体与纳米ZrO2粉体配备而成(具体配方设计见表1),将混合颗粒放入刚玉坩锅中,置于立式硅钼棒炉内常压下烧结,加热至1 600 ℃保温3 h,随后烧结体在炉内随炉冷却到室温后取出。
表1不同比例复合材料粉体的配方设计
Table 1. The recipe formulation of the different proportions of the composite particles
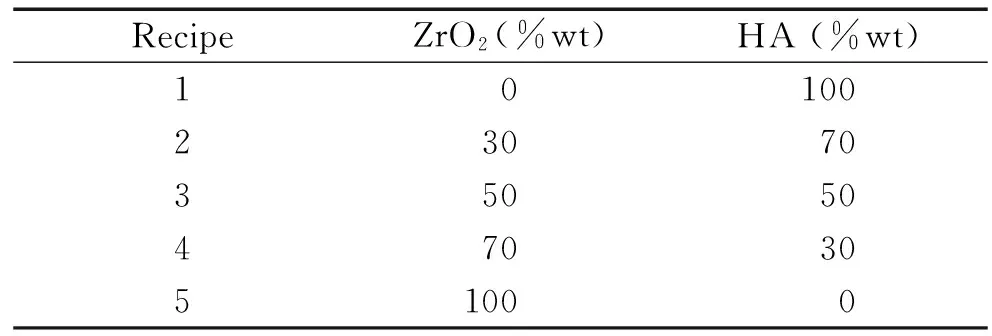
RecipeZrO2(%wt)HA(%wt)1010023070350504703051000
1.2复合材料颗粒悬液的制备 复合材料颗粒经高温高压消毒灭菌,DMEM培养基经滤过除菌,将材料粉、液振荡混匀后在细胞培养孵箱中37 ℃放置7 d,离心后取出上清液,再进行梯度稀释,滤过除菌后备用。
2主要试剂
淋巴细胞分层液(上海生化试剂厂),RPMI-1640培养液(Gibco),胎牛血清DMEM培养液(杭州四季青生物公司),MTT试剂盒(碧云天公司),Giemsa染液(上海生化试剂公司),丝裂霉素(Sigma)。
3间充质干细胞的分离培养及鉴定
新西兰兔经3%戊巴比妥钠1.5 mL/kg腹腔注射麻醉后,以8%硫化钠去除胫骨近端被毛。术野经碘伏及75%乙醇消毒后,以骨髓穿刺针从胫骨结节外侧穿刺,穿刺针旋转刺入髓腔,接5 mL注射器(注射器内预留肝素钠2 000 U),抽取骨髓液3-4 mL。吸出的骨髓液缓慢注入预先加入4 mL淋巴细胞分层液的试管内,密度梯度离心,2 500 r/min离心30 min, 离心后吸取中间的单个核细胞层,PBS洗1次,以3×105cells/cm2的密度接种于25 cm2培养瓶内,加15%胎牛血清DMEM培养液3 mL(含青霉素钠1×105U/L,链霉素100 mg/L,pH 7.2-7.4)。在5%CO2孵箱内37 ℃培养。48 h后弃除未贴壁的细胞,3-5 d后半量换液。继续培养且全量每周换液2次。待细胞长满底面后, 用0.25%胰酶消化5 min,即得到原代间充质干细胞(mesenchymal stem cells,MSCs)悬液, 再以1×104cells/cm2的密度传代培养。
3.1绘制细胞生长曲线图 从第1 d起,取贴壁细胞消化成单细胞悬液后,每天各取3孔计数,每孔计数3次,计算均值,连续6 d,描绘生长曲线。观察骨髓间充质干细胞生长状况。
3.2流式细胞术鉴定 取培养的骨髓间充质干细胞,经2.5 g/L 胰蛋白酶和1 mmol/L EDTA消化后,加入含1%小牛血清的PBS,调整细胞浓度至1×1010cells/L,分别加入CD45-PE、CD54-PE和CD90-FITC小鼠抗大鼠单克隆抗体,4℃孵育30 min,PBS清洗后进行流式细胞术分析鉴定。
4细胞毒性实验(MTT cytotoxicity test)
将第3代间充质干细胞以1×104cells/cm2密度种植于24孔板,将HA/ZrO2复合材料悬浮于培养液中配制成不同浓度的材料颗粒悬液(0、50、200 mg/L)将0.5 mL不同浓度的材料悬液加入到24孔板中,每种浓度重复6孔。5 d后以PBS洗去培养液及颗粒,每孔细胞样本加入100 μL 20%MTT,37 ℃孵育4 h后,吸弃孔内液体,每孔加入150 μL二甲基亚砜(DMSO),振荡10 min,用酶联检测仪在490 nm波长下检测吸光度值。
5体外微核实验
本实验分为实验组、阳性对照组和阴性对照组, 将MSCs以2×104cells/cm2接种于6孔板,培养至70%-80%覆盖底面,实验组在培养液中加入不同材料和浓度的材料悬液;阳性对照组在培养液中加入0.5 mg/L的丝裂霉素;阴性对照组只加入培养液,不加入任何材料或丝裂霉素。 48 h后各组细胞弃去培养液,消化后2 000 r/min离心10 min获得细胞团块,弃上清液,加入预温至37 ℃的0.1 mol/L KCl溶液,在温箱中静置10 min,向悬液中加新鲜1∶3冰醋酸、甲醇固定液,1/5体积于KCl,吹匀,离心吸除上清液,加新鲜固定液2-3 mL;轻轻吹匀,静置5 min,再离心后,吸除上清,据细胞数量,添加固定液0.1-0.5 mL滴片,Giemsa染色10 min,水洗、晾干、在显微镜下观察并计算微核的数目。
6统计学处理
结 果
1骨髓间充质干细胞的形态观察、生长曲线及表型鉴定
将用密度梯度法分离的细胞接种于培养瓶中,镜下可见大量悬浮的细胞,接种24 h后便有少量的细胞贴壁, 多为梭形或成纤维细胞样,经换液后,非贴壁细胞逐渐减少,贴壁细胞逐渐呈克隆样生长,约10 d后,细胞逐渐融合,呈放射样、爆花样或漩涡样。细胞长满瓶底约需10-15 d。传代培养细胞生长稳定,约3-4 d传代1次。随着不断传代细胞可以得到纯化。可传20代以上。MSCs以1×104cells/cm2接种时4 d可长满瓶底,传1代细胞可扩增4倍。增殖倍增时间约为24 h,见图1。

Figure 1. Growth curve of the MSCs.
图1骨髓间充质干细胞的生长曲线
流式细胞仪检测结果显示,MSCs高表达CD90和CD54,阳性率分别为94.8%和95.9%,低表达CD45,阳性率仅为12.7%。
2细胞毒性实验
结果显示:HA和含有HA的复合材料颗粒均对细胞增殖有一定促进作用,而单纯ZrO2颗粒对细胞增殖没有促进作用,HA组与ZrO2组比差异显著(P<0.05,n=6),见图2。


图2HA/ZrO2复合材料颗粒细胞毒性实验
3微核实验
图3显示HA组与阴性对照组差异不显著,与阳性对照组差异显著,提示HA不具有基因毒性;ZrO2组与阴性对照组比较差异显著,与阳性对照比较差异不显著,提示ZrO2具有一定基因毒性。HA/ZrO2复合材料的基因毒性随着ZrO2比例和复合材料浓度的增加而增加,30%HA/70%ZrO2在200 mg/L时有显著的基因毒性。


图3复合材料颗粒悬液体外微核实验结果差异比较
讨 论
随着生物材料的不断涌现,对生物材料的毒理研究也日益受到重视。作为长期存留于体内的生物材料,其生物相容性的好坏将直接影响复合材料对周围组织的修复反应。除了细胞及组织毒性的研究外,复合材料的基因毒性也被认为是评价新型材料的必须步骤[2]。微核实验是反映染色体损伤的重要实验方法,已广泛应用于遗传、食品、药物、环境等多领域的遗传毒性评估。但国内学者将其应用于生物支架材料基因毒性检测的文献报道不多,体外微核法作为检测基因毒性用于毒理研究已得到公认, 微核实验最大的优点是经济、简单、快速。微核是指位于细胞浆中独立于主核的核小体,主要由外界损伤因素作用细胞后,导致细胞染色体丢失或断裂,从而在胞浆中形成1个或数个小核,可选用的细胞系很广泛,如人淋巴细胞、大小鼠外周血和骨髓红细胞、生殖细胞、口腔黏膜细胞、肝细胞、中国仓鼠肺成纤维细胞、植物(包括紫露草和蚕豆)细胞等。故体外微核法已成为新型生物支架材料临床应用前生物相容性研究中不可缺少的一部分。大量研究表明,体外微核法对于检测新材料的基因毒性有很好的敏感性和特异性,且简单易行、可自动化计数及重复性好[3-5]。利用特殊的细胞系,它可敏感地表现在材料的影响下细胞所发生的染色体结构和数量上的异常变化。MSCs是一类具有分化潜能的细胞,在特定条件下可以分化为多种组织细胞,如成骨细胞、软骨细胞、肌腱、脂肪细胞、成纤维细胞以及神经星状细胞等,且具有极强的自我复制能力, 是一种重要组织工程种子细胞[6-9]。当其接触有基因毒性的材料时,其染色体分裂发生障碍,出现染色体的断裂或滞后,导致在分裂后期染色体不能正常分配到子代细胞中,从而表现出细胞质中的染色体样物质-微核,通过微核数量的多少可判断出材料的染色体毒性[10]。本实验采用了材料的颗粒悬液来评价材料的基因毒性,本实验为了避免其它化学提取液本身对MSCs作用的干扰,采用了细胞培养基作为材料的浸提液。在毒理实验中,通常需在进行基因毒性实验前先进行细胞毒性实验,以确定实验材料抑制细胞生长的浓度,再选其范围内的浓度作为基因毒性的实验浓度。在进行基因毒性实验时,我们采用了高浓度作为实验浓度参照,体外微核实验结果显示,HA组与阴性对照组差异不显著, 而阴性对照组仅为间充质干细胞培养基,与阳性对照组差异显著,说明HA不具有基因毒性;ZrO2组与阴性对照组差异显著,与阳性对照差异不显著, 说明ZrO2具有一定基因毒性。HA/ZrO2复合材料的基因毒性随着ZrO2比例和材料浓度的增加而增加。30%HA/70%ZrO2在200 mg/L时具有显著基因毒性。HA/ZrO2复合材料的基因毒性随着ZrO2比例的增加而增加,这可由材料的成分比例的不同得到解释。本研究中用于制备生物复合材料的2种原材料ZrO2和HA均为用于临床及实验研究多年的材料,其生物相容性均得到公认[11-13]。而且在前期的研究中也已证实作为两者复合物的新型生物复合材料―HA/ZrO2梯度复合材料也具有良好的生物相容性和生物活性、无细胞毒性等[14]。本实验的结果为该材料应用于临床提供了进一步的客观评价分析。

Figure 4. Giemsa dyeing of the micronucleus formed in each experimental group. Arrows indicate the micronuclei,the intracytoplasmic dyed objects. A: amplified figure of the micronucleus. B: negative control; C: positive control; D: pure HA group; E: 70%HA composite group; F: 50%HA composite group; G: 30%HA composite group; H: pure ZrO2group, 200 mg/L.Bar=10 μm.
图4各实验组所形成的微核Giemsa染色
[1] 孙 皎.生物材料和医疗器械生物学评价[J].中国医疗器械杂志,2003,27 (1):1- 3.
[2] Heil J, Reifferscheid G, Waldmann P, et al. Genotoxicity of dental materials[J]. Mutat Res, 1996,368(3-4): 181-194.
[3] Kocaman AY, Topaktas M.Invitroevaluation of the genotoxicity of acetamiprid in human peripheral blood lymphocytes[J]. Environ Mol Mutagen, 2007,48(6): 483-490.
[4] Dönmez-Altuntas H, Dumlupinar G, Imamoglu N, et al. Effects of the mycotoxin citrinin on micronucleus formation in a cytokinesis-block genotoxicity assay in cultured human lymphocytes[J].J Appl Toxicol, 2007,27(4): 337-341.
[5] Miller B, Potter-Locher F, Seelbach A, et al. Evaluation of theinvitromicronucleus test as an alternative to theinvitrochromosomal aberration assay: position of the GUM Working Group on theinvitromicronucleus test[J]. Mutat Res, 1998,410(1): 81-116.
[6] Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues[J]. Science, 1997, 276(5309): 71-74.
[7] Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999,284(5411):143-147.
[8] 王跃春,张 洹.人胎肝MSCs的分离培养及其类ESCs特性的研究[J].中国病理生理杂志,2009,25(2):409-412.
[9] 李映红,吴正治,吴伟康,等.天然脑活素定向诱导大鼠骨髓间充质干细胞向神经元样细胞分化的实验研究[J].中国病理生理杂志,2009,25(8):1548-1553.
[10]Schweikl H, Schmalz G. The induction of micronuclei in V79 cells by the root canal filling material AH plus[J]. Biomaterials, 2000,21(9):939-944.
[11]全仁夫,杨迪生,吴晓春,等.二氧化锆梯度复合羟基磷灰石生物陶瓷的制备及其体外免疫相容性[J].生物医学工程学杂志,2006,23(5):1056-1061.
[12]全仁夫,杨迪生,苗旭东,等.二氧化锆梯度复合羟基磷灰石生物材料对大鼠成骨细胞体外活性的影响[J].中华创伤杂志,2006,22(11):852-857.
[13]张 敏,汪宏斌,全仁夫,等.羟基磷灰石-二氧化锆生物复合材料的制备及其生物相容性[J].复合材料学报,2006,23(2):115-121.
[14]全仁夫,杨迪生,苗旭东,等.二氧化锆梯度复合羟基磷灰石的生物相容性研究[J].中国修复重建外科杂志,2006,20(5):569-573.
PreliminarystudyofgenotoxicityofHA/ZrO2compositeparticlesinvitro
QUAN Ren-fu1, TANG Yang-hua1, YANG Di-sheng2, HUANG Zhong-ming1, LI Wei1, XU Jin-wei1, WU Xiao-chun3
(1DepartmentofOrthopedics,XiaoshanTCMHospital,Xiaoshan311200,China;2DepartmentofOrthopedics,SecondAffiliatedHospitalofZhejiangUniversity,Hangzhou310009,China;3MaterialCollegeofShanghaiUniversity,Shanghai200072,China.E-mail:quanrenf@263.net)
AIM: To evaluate the genotoxicity of the hydroxyapatite/ZrO2(HA/ZrO2) composite particles by using theinvitromicronucleus test (MNT).METHODSThe HA/ZrO2composite particles prepared by sintering at high temperature and pressure using the powder of HA and ZrO2with different proportions were compared with the pure HA particle and pure ZrO2particle. The suspension of the composite particles was made. The rabbit mesenchymal stem cells were isolated and cultured. The promotive effect of the composite particles on the proliferation of the rabbit mesenchymal stem cells was detected by MTT method. The genotoxicity of the composite particles to the rabbit mesenchymal stem cells was measured by MNT method.RESULTSThe MTT test showed that both of the pure HA particle and the composite particles containing HA promoted the proliferation of rabbit mesenchymal stem cells. However, no promotive effect of the pure ZrO2particle on the proliferation of rabbit mesenchymal stem cells was observed. The MNT test showed no significant difference between HA group and negative control group (P>0.05), and significant difference between HA group and positive control group (P<0.05). The difference between ZrO2group and negative control group was significant (P<0.01), and the difference between ZrO2group and positive control group was insignificant (P>0.05).CONCLUSIONThe increase in genotoxicity of HA/ZrO2composite particle is dependent on the proportion of ZrO2and the concentration of the composite. The 30%wt HA/70%wt ZrO2composite at the concentration of 200 mg/L shows significant genotoxicity.
Zirconium; Hydroxyapatites; Composite materials; Genotoxicity
R318
A
10.3969/j.issn.1000-4718.2011.01.034
1000-4718(2011)01-0175-04
2010-05-09
2010-09-29
浙江省医学科研基金资助项目(No.2007A170);杭州市科技发展计划资助项目(No.20080333B23)
△通讯作者 Tel: 0571-82727212; E-mail:quanrenf@263.net

