定量蛋白质组学技术构建系统性红斑狼疮疾病的蛋白质组差异表达图谱*
王林纤, 戴 勇△, 文锦丽, 涂植光, 张 丽, 齐素文
(1深圳市人民医院,暨南大学第二临床医学院临床医学研究中心,广东 深圳 518020; 2重庆医科大学临床检验诊断学教育部重点实验室,重庆 400016)
定量蛋白质组学技术构建系统性红斑狼疮疾病的蛋白质组差异表达图谱*
王林纤1, 戴 勇1△, 文锦丽1, 涂植光2, 张 丽1, 齐素文1
(1深圳市人民医院,暨南大学第二临床医学院临床医学研究中心,广东 深圳 518020;2重庆医科大学临床检验诊断学教育部重点实验室,重庆 400016)
目的应用定量蛋白质组学技术对系统性红斑狼疮(SLE)病人外周血单个核细胞中的“全组”蛋白进行鉴定和定量分析,获得SLE的蛋白质组差异表达图谱。方法利用基于四重相对和绝对定量的等量异位标签结合多维液相色谱-串联质谱分析SLE稳定期和活动期病人以及类风湿关节炎病人和健康人的外周血单个核细胞总蛋白,用肽质量指纹谱经数据库检索鉴定蛋白质,并比较这些蛋白的表达差异。结果共鉴定了400多个蛋白质。其中,与健康对照组相比,SLE稳定组和SLE活动组共发现2倍以上表达差异的蛋白质44个,上调的9个,下调的35个;与类风湿关节炎疾病组相比,SLE稳定组和SLE活动组2倍以上表达差异的蛋白共有52个,上调的19个,下调的33个;SLE活动组与SLE稳定组相比,表达上调和下调的蛋白分别为17个和13个。结论定量蛋白质组学技术可有效地用于人外周血单个核细胞蛋白鉴定和相对定量;采用该技术获得了SLE病人外周血单个核细胞的蛋白质组差异表达图谱;深入研究这些蛋白的分子机制将有助于进一步阐明SLE的发病机制,为SLE的诊断和治疗提供新途径。
定量蛋白质组学; 红斑狼疮,系统性; 单个核细胞
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种累及全身多个系统、复发和缓解交替出现的自身免疫性疾病。该病的病程长,结果不可预知,更严重的是SLE可导致包括肾、肺、心脏、脑等多器官的病理损害,有约15%的患者在发病5年内死亡或出现肾功能衰竭。自从糖皮质激素与免疫抑制剂被用于治疗SLE后,患者的预后虽有明显改善,但总的来说该病治疗现状仍不容乐观,因为糖皮质激素或免疫抑制剂的应用同时也从整体上抑制了机体的免疫功能,同时复发也是治疗过程中面临着的一个严峻问题。究其根本原因,还是我们还没有把握住SLE发病的关键环节,对导致SLE免疫功能紊乱的源头机制还不清楚。目前认为,SLE的发病机制涉及遗传、T/B细胞调节性功能缺陷、感染、激素、环境因素等多种因素的复杂作用[1,2]。其中,淋巴细胞异常凋亡及活化、Th1和Th2调节失衡,淋巴细胞分泌功能及其免疫通路异常等在SLE的致病中发挥了非常重要的作用[3]。由于SLE临床表现复杂,其早期和准确诊断仍然很难。现有的实验室诊断方法包括抗核抗体的检查等无论是特异性还是敏感性都不能有效地满足临床需求,也没有发现能较好地反应SLE疾病活动情况的标志物来监测SLE的疾病进程。 因此,有必要用创新的方法寻找和发现新的SLE疾病标志物或能代表SLE疾病活动情况的蛋白分子。
相对和绝对定量的等量异位标签(isobaric tags for relative and absolute quantitation, iTRAQ)是由Applied Biosystems公司新近研发的一种功能强大的体外多肽标记技术。该技术采用4种或8种同位素编码的标签,通过特异性标记多肽的氨基基团,尔后进行串联质谱分析,可同时比较4种或8种不同样品中蛋白质的相对含量或绝对含量。结合多维液相色谱分离和串联质谱分析,近几年,iTRAQ技术已成为差异蛋白质组学定量研究主要工具之一,被用于多种疾病标志物的发现及疾病进程和预后分析。研究证明,iTRAQ标记技术是研究细胞或组织不同生理状态,或比较正常和病理状态下蛋白质组异同的一种有效方式[4]。但是,目前国内外尚无将iTRAQ技术用于人单个核细胞(主要成分为淋巴细胞)或SLE疾病蛋白组学的相关报道。鉴于淋巴细胞调节通路异常被认为广泛地参与SLE的病理过程,我们用iTRAQ标记技术对SLE活动组和SLE稳定组外周血单个核细胞的蛋白质组学进行了分析比较,获得SLE的蛋白质组差异表达图谱,为进一步阐明SLE的发病机制提供新线索。
材 料 和 方 法
1材料
1.1试剂与设备 质谱级超纯水、乙腈(Merck);三氟乙酸(TFA)、丙酮 (Sigma);外周血单个核细胞分离液Lympholyte®-H (Cedarlane);M-PER®蛋白抽提试剂盒、BCA蛋白定量试剂盒(Pierce);三乙基碳酸氢铵、氯化钾(Sigma);质谱级胰蛋白酶(Promega);iTRAQ 4-plex 标记试剂及缓冲液(Applied Biosystems);超高速低温离心机、紫外分光光度仪(Eppendorf);真空冷冻干燥机(Martin Christ);Agilent 1100 series色谱分离系统(Agilent);TempoTMLC MALDI 高效液相色谱仪、4800 Plus MALDI TOF/TOF串联质谱分析仪(Applied Biosystems)。
1.2研究对象 所有病例均来自深圳市人民医院。实验共分为4组,即SLE稳定组、SLE活动组、类风湿性关节炎(rheumatoid arthritis,RA)疾病对照组和健康对照组。SLE的诊断依据1982美国ACR(American College of Rheumatology)修订的诊断标准[5],并按疾病活动性指数(systemic lupus erythematosus disease activity index,SLEDAI)[6]将SLE分为稳定组(SLEDAI ≤ 8)和活动组(SLEDAI > 8);RA的诊断符合1987年美国ARA(American Rheumatism Association)修订的诊断标准[7]。SLE稳定组女5例,男1例,平均年龄(33.67±9.24)岁;SLE活动组女5例,男1例,平均年龄(31.83±7.96)岁;RA组女5例,男1例,平均年龄(40.17±10.19)岁;健康对照组女5例,男1例,平均年龄(35.67±8.14)岁。各组资料除SLE相关指标外,其它指标差异无显著(P>0.05)。
2方法
2.1样本准备 静脉采集空腹8 h以上肝素锂抗凝全血约10 mL,用Lympholyte®-H分离液分离外周血单个核细胞,M-PER®Mammalian 蛋白抽提试剂抽提细胞总蛋白,BCA蛋白定量试剂盒测定蛋白浓度。所有步骤均按厂家提供的说明书进行。
2.2iTRAQ标记 按厂家说明书操作。每组各取100 μg蛋白,加入6倍体积,-20 ℃预冷的丙酮沉淀过夜,真空燥后逐步加入溶解缓冲液、变性剂和还原剂,混匀,60 ℃孵育1 h;加入半胱氨酸封闭剂,室温孵育10 min;加入胰蛋白酶,37 ℃酶解过夜。酶解缓冲液为pH 8.5的0.5 mmol/L三乙基碳酸氢铵。然后进行iTRAQ标记:iTRAQ114-健康对照组,iTRAQ115-SLE稳定组,iTRAQ116-SLE活动组,iTRAQ117-RA组。室温反应1 h后混合所有标记样品,真空干燥。
2.3强阳离子交换 上述标记样品用上样缓冲液(10 mmol/L KH2PO4,25%乙腈,pH 3.0)稀释10倍,上样到强阳性离子交换预装柱(35 mm×0.3 mm, 300 Å, 3.5μm,Zorbax Bio-SCX),用Agilent 1100 series 进行自动梯度洗脱,流速设定为20 μL/min。先用0-20% 缓冲液B(10 mmol/L KH2PO4,1 mol/L KCl,25%乙腈,pH 3.0)洗脱40 min,每5 min收集1次各盐浓度洗脱下的多肽;再用20%-50% 缓冲液B继续洗脱20 min,每10 min收集1次洗脱液。
2.4反相液相色谱分离 洗脱下来各多肽组分经TempoTMLC MALDI在线分离系统进行自动上样、反相洗脱和点靶。C18反相柱规格为150 mm× 0.2 mm,200 Å,3μm (Michrom Bioresources)。流动相B由98% 乙腈和0.1% TFA组成,流速设定为2μL/min,洗脱时间为100 min,每块MALDI靶板可点样380个点左右。洗脱梯度设定如下:0-5 min,流动相B为5%,5-65 min,流动相B从5%线性增至40%,65-75 min,流动相B从40%线性增至60%,75-80 min,流动相B从60%线性增至95%,80-90 min,流动相B为95%,90-95 min,流动相B从95%线性减至5%,至100 min停止洗脱。
2.5质谱检测和相对定量分析 采用4800 Plus MALDI TOF/TOF蛋白质分析仪进行多肽的串联质谱鉴定和相对定量分析。一级质谱激光激发800次,在阳离子模式下用反射模式进行检测,选择信噪比大于40的母离子做二级质谱(MS/MS)分析,每个样品点上最多选择40个母离子。二级MS/MS激光激发1 600次,碰撞能量1 kV,碰撞诱导解离(collision-induced dissociation,CID)小室内的氮气压力维持在2.0×10-4Pa。采用Applied Biosystems公司提供的ProteinPilotTM3.0软件进行报告离子的相对定量分析,选用IPI (International Protein Index) human V 3.62 蛋白数据库进行蛋白的检索和鉴定,同时用质荷比(m/z) 114、115、116、117报告离子的峰面积积分进行相对定量分析,以m/z 114为对照,按115∶114、116∶114、117∶114的比值,选择比值≥2或≤0.05的结果进行报告。蛋白置信度设定为>95%或ProtScore>1.3。
结 果
以蛋白置信度>95%或ProtScore>1.3为限,共鉴定了4 056个肽段,452个非冗余蛋白。经ProteinPilotTM3.0软件分析,获得SLE疾病的蛋白质组差异表达图谱。
1SLE稳定组与健康对照组的蛋白质组差异表达图谱
与健康对照组相比,SLE稳定组有3个蛋白表达显著上调,6个蛋白表达显著下调,见表1。
2SLE活动组与健康对照组的蛋白质组差异表达图谱
与健康对照组相比,SLE活动组有20个蛋白表达显著上调,15个蛋白表达显著下调,见表2。
3SLE稳定组与RA对照组的蛋白质组差异表达图谱
与RA对照组相比,SLE稳定组有11个蛋白表达显著上调,8个蛋白表达显著下调,见表3。
4SLE活动组与RA对照组的蛋白质组差异表达图谱
与RA对照组相比,SLE活动组有13个蛋白表达显著上调,20个蛋白表达显著下调,见表4。
5SLE活动组与SLE稳定组的蛋白质组差异表达图谱
与SLE稳定组相比,SLE活动组有17个蛋白表达显著上调,13个蛋白表达显著下调,见表5。

表1 SLE稳定组与健康对照组相比有显著表达差异的蛋白质

表2 SLE活动组与健康对照组相比有显著表达差异的蛋白质

表3 SLE稳定组与RA对照组相比有显著表达差异的蛋白质
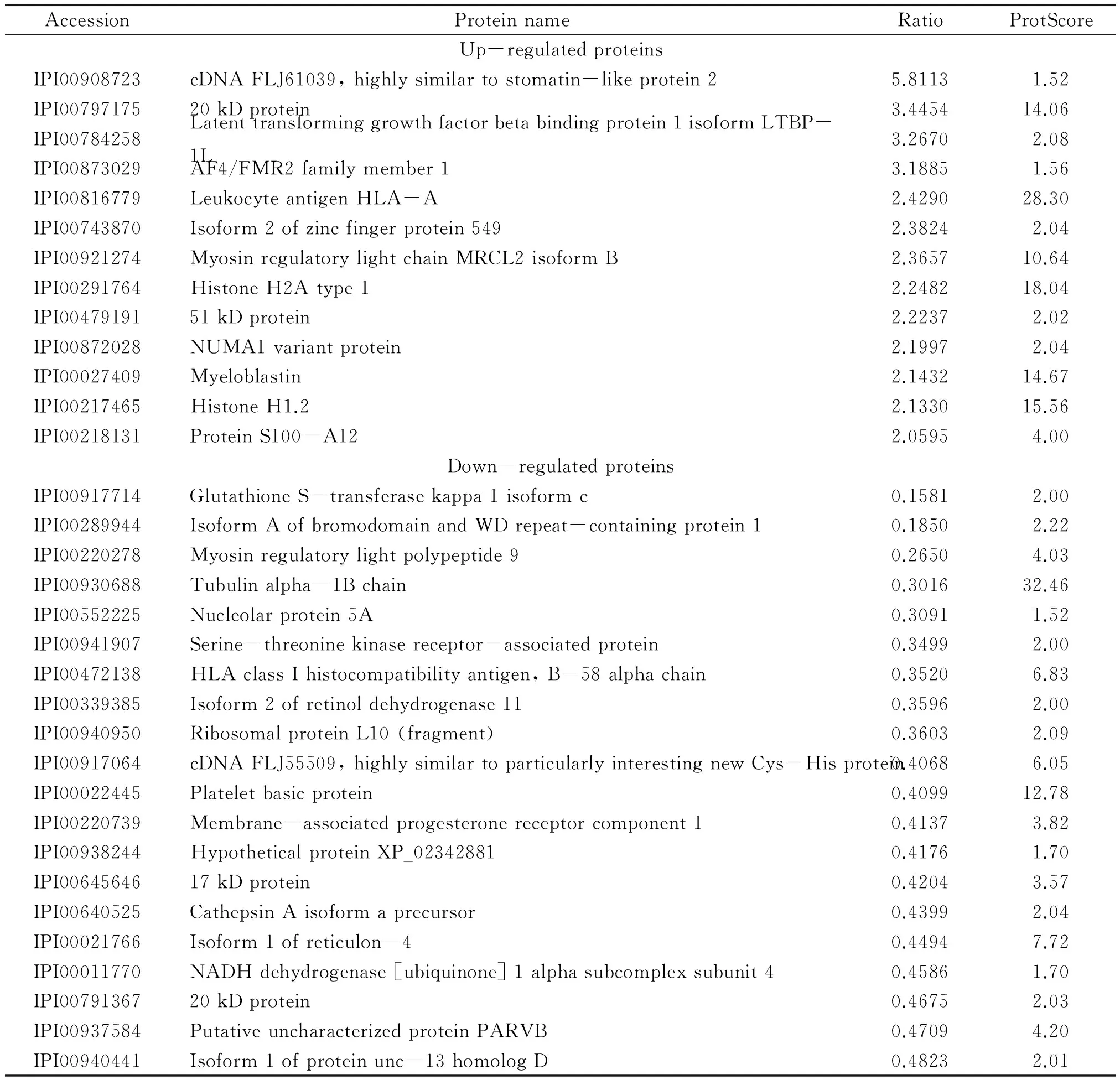
表4 SLE活动组与RA对照组相比有显著表达差异的蛋白质

表5 SLE活动组与SLE稳定组相比有显著表达差异的蛋白质
在上述126个出现差异表达的蛋白中,除去39个跨组差异表达的“交叠”蛋白,共有不重复差异表达蛋白67个。其中,某些蛋白,如histone H2A type 1、myeloblastin(图1)等在SLE活动组中的表达比其它各组都高;另一些蛋白在SLE活动组中的表达比其它各组都低,如:myosin regulatory light polypeptide 9, nucleolar protein 5A等。与RA组或健康对照组相比,AF4/FMR2 family member 1等在SLE稳定组和SLE活动组均出现高表达,而glutathione S-transferase kappa 1 isoform c(图2)则相反;与健康对照组相比,cDNA FLJ55107, highly similar to cell division control protein 42 homolog在SLE稳定组和SLE活动组都表达上调,但是与RA组相比,该蛋白表达并无显著差异。与其它各组比,structural maintenance of chromosomes protein 3 在SLE稳定组的表达水平显著降低。

Figure 1. Myeloblastin sequencing and quantification using iTRAQ. A representative MALDI-TOF-MS with fragmented b-ions and y-ions of peptide PHNICTFVPR belonging to myeloblastin. The labeled ion assignments are as follows: healthy control-iTRAQ 114; stable SLE-iTRAQ 115; active SLE iTRAQ-116; RA-iTRAQ 117.
图1序列为PHNICTFVPR的myeloblastin特异性多肽的鉴定及iTRAQ报告离子相对定量的二级质谱图
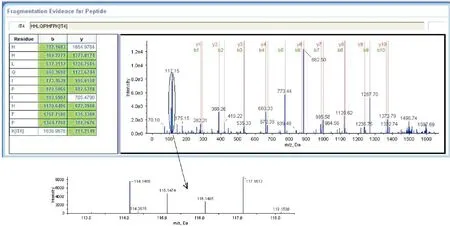
Figure 2. Glutathione S-transferase kappa 1 isoform c sequencing and quantification using iTRAQ. A representative MALDI-TOF-MS with fragmented b-ions and y-ions of peptide HHLQIPIHFPK belonging to glutathione S-transferase. The labeled ion assignments are as follows: healthy control-iTRAQ 114; stable SLE-iTRAQ 115; active SLE-iTRAQ-116; RA-iTRAQ 117.
图2序列为HHLQIPIHFPK的glutathioneS-transferasekappa1isoformc特异性多肽的鉴定及iTRAQ报告离子相对定量的二级质谱图
讨 论
近年来, 为满足定量蛋白质组学研究的需要,基于高度敏感性和精确性的串联质谱分析进行蛋白质定量的相关标记技术发展迅速,iTRAQ标记串联质谱技术是这些新进展中的一大主力[8]。本研究中,我们采用iTRAQ相关技术对SLE病人外周血单个核细胞总蛋白进行鉴定和比较蛋白组学相对定量分析,共鉴定了452个蛋白,其中有67个蛋白在不同组间出现显著差异表达,表明将iTRAQ标记串联质谱技术用于SLE病人外周血单个核细胞的比较蛋白组学分析是一种行之有效的方法。
与健康对照组相比,SLE活动组出现差异表达的蛋白为35个,远远多于SLE稳定组出现差异表达的蛋白9个,说明SLE疾病活动期炎性活动加剧,炎性损害加强,有更多的蛋白分子参与淋巴细胞异常调节和SLE的疾病活动过程。
与RA相比,SLE稳定组和SLE活动组分别有11、13个蛋白表达显著上调,有8、20个蛋白表达显著下调。对这些蛋白进行进一步的验证分析和研究将有助于阐明SLE和RA在发病机制上的异同,为SLE的鉴别诊断与个性化治疗打下基础。
以往的研究表明,以血清或组织为样本的iTRAQ标记技术在疾病活动性标志物的发现和对疾病的预后评价中具有积极作用[4]。依据SLE疾病的严重程度而采取不同的治疗方案在临床上非常重要,但是目前临床上还没有可靠的可用于SLE疾病活动性分析的生物标志物。我们用iTRAQ标记技术对SLE活动组和SLE稳定组外周血单个核细胞进行相对定量分析,共鉴定了17个在SLE活动组中表达显著上调的蛋白和13个表达显著下调的蛋白。这些阶段特异蛋白可能参与SLE疾病的缓解和复发过程,有望作为SLE的疾病活动性指标,评估SLE疾病的严重性。
本次比较蛋白组学研究发现了多个在SLE中差异表达的蛋白,其中有些蛋白分子已被证明参与SLE的潜在致病过程,如抵抗素(resistin)、S100蛋白家族等。Almehed等[9]研究发现抵抗素与SLE病人的全身性炎症、肾脏病变及骨丢失等显著相关。在本研究中,我们检测到抵抗素在SLE稳定组的表达并无显著改变,但在SLE活动组出现高表达,提示抵抗素作为一种促炎症因子,可促进SLE的复发。S100蛋白家族是钙结合蛋白家族成员,可结合toll样受体4(TLR4)。越来越多的证据表明它们是一类新的促炎蛋白(pro-inflammatory proteins),在关节炎疾病的炎性过程中具有多向性[10]。Soyfoo等[11]发现SLE患者血清中S100 A8/A9的浓度升高,且升高幅度与SLE的疾病活动指数相关。Yang等[12]报道神经精神性狼疮患者血清和脑脊液中S100 B的浓度升高。值得注意的是,我们检测到S100 P和S100 A12蛋白的表达在SLE活动组中显著增加,而S100 A8、S100 A9和S100 A12的含量在SLE稳定组则显著降低,提示S100 P和S100 A12可能与SLE疾病活动的严重程度相关,而S100 A8、S100 A9和S100 A12则可能发挥协同抑制作用,参与SLE的炎症修复并维持SLE的缓解过程。有些在SLE中出现显著差异表达的蛋白,如BASP 1(brain acid soluble protein 1)和Ras相关C3肉毒梭菌毒素底物蛋白3等,已被证实与其它疾病的凋亡通路相关[13,14],但它们在SLE疾病发展进程中的作用尚不清楚。
本研究首次运用iTRAQ多重标记技术结合串联质谱分析,在“整体”蛋白组范围内对SLE患者的外周血单个核细胞的“全组”蛋白进行鉴定,从整体上建立了SLE疾病蛋白组数据库。同时,通过对这些蛋白质进行比较和相对定量分析,初步筛选在SLE中出现差异表达的蛋白分子,获得了有关SLE疾病和SLE阶段特异性的蛋白质组差异表达图谱和相对定量分析结果,为进一步深入研究SLE的发病机制提供了新的依据。由于篇幅所限,在此不对筛选出来的蛋白逐一讨论。今后的工作将着重于对筛选出的某些有价值的蛋白分子进行大样本的验证试验和功能研究,为SLE的临床诊断和治疗提供新途径。
[1] Lee HY, Hong YK, Yun HJ, et al. Altered frequency and migration capacity of CD41+CD25+regulatory T cells in systemic lupus erythematosus[J]. Rheumatology,2008,47(6):789-794.
[2] 袁 敏,沈 南,唐元家,等. DNA甲基化与系统性红斑狼疮[J]. 中国病理生理杂志,2009,25(11):2217-2220,2224.
[4] 王林纤,戴 勇,涂植光. iTRAQ标记技术与差异蛋白质组学的生物标志物研究[J]. 生命的化学,2010,30(1):135-140.
[5] Tan EM, Cohen AS, Fries JF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum,1982,25(11):1271-1277.
[6] Gladman DD, Ibanez D, Urowitz MB. Systemic lupus erythematosus disease activity index 2000[J]. J Rheumatol,2002,29(2):288-291.
[7] Arnett FC, Edworthy SM, Bloch DA, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J]. Arthritis Rheum,1988,31(3):315-324.
[8] Elliott MH, Smith DS, Parker CE, et al. Current trends in quantitative proteomics[J]. J Mass Spectrom,2009,44(12):1637-1660.
[9] Almehed K, d’Elia HF, Bokarewa M, et al. Role of resistin as a marker of inflammation in systemic lupus erythematosus[J]. Arthritis Res Ther,2008,10(1):R15-R24.
[10]Perera C, McNeil HP, Geczy CL. S100 calgranulins in inflammatory arthritis[J]. Immunol Cell Biol,2010,88(1):41-49.
[11]Soyfoo MS, Roth J, Vogl T, et al. Phagocyte-specific S100A8/A9 protein levels during disease exacerbations and infections in systemic lupus erythematosus[J]. J Rheumatol,2009,36(10):2190-2194.
[12]Yang XY, Lin J, Lu XY, et al. Expression of S100B protein levels in serum and cerebrospinal fluid with different forms of neuropsychiatric systemic lupus erythematosus[J]. Clin Rheumatol,2008,27(3):353-357.
[13]Dolores Sanchez-Nio M, Sanz AB, Lorz C, et al. BASP1 promotes apoptosis in diabetic nephropathy[J]. J Am Soc Nephro,2010,21(4):610-621
[14]Yi L, Zeng X, Tan H, et al. Proteomics analysis of apoptosis initiation induced by diallyl disulfide in human leukemia HL-60 cells[J]. Ai Zheng,2009,28(1):33-37.
Differentialexpressionprofilingofproteomeforsystemiclupuserythematosuswithquantitativeproteomictechnique
WANG Lin-qian1, DAI Yong1, WEN Jin-li1, TU Zhi-guang2, ZHANG Li1, QI Su-wen1
(1ClinicalResearchCenteroftheSecondClinicalMedicalCollege,JinanUniversity,ShenzhenPeople’sHospital,Shenzhen518020,China;2KeyLaboratoryofLaboratoryMedicalDiagnostics,MinistryofEducation,ChongqingMedicalUniversity,Chongqing400016,China.E-mail:daiyong22@yahoo.com.cn)
AIM: To identify and quantify the total proteins in peripheral blood mononuclear cells (PBMC) of systemic lupus erythematosus (SLE) patients with quantitative proteomic technique, and to establish a differential expression profile of proteome for SLE.METHODSFour-plex isobaric tags for relative and absolute quantification coupled with multiple chromatographic fractionation and tandem mass spectrometry were used to analyze the total proteins in PBMC from healthy controls and the patients of stable SLE, active SLE and rheumatoid arthritis. The proteins were identified by database searching with peptide mass fingerprinting. The differential expression of the proteins was compared.RESULTSMore than 400 proteins were identified. Compared with healthy controls, 44 proteins were discovered to be significantly expressed by more than 2 folds in stable SLE and active SLE, among which 9 proteins were up-regulated and 35 proteins were down-regulated. Compared with rheumatoid arthritis group, 52 proteins displayed 2 or more folds of changes in stable SLE and active SLE, including 19 up-regulated proteins and 33 down-regulated ones. The up-and down-regulated proteins between active SLE and stable SLE were 17 and 13, respectively.CONCLUSIONQuantitative proteomic technique is efficiently applicable for protein identification and relative quantitation in human peripheral blood mononuclear cells. Determination of the differentially expressed proteomic profile of SLE is helpful for better understanding the pathogenesis of SLE and developing new strategies for diagnosis and treatment of SLE.
Quantitative proteomics; Lupus erythematosus, systemic; Mononuclear cells
R34
A
10.3969/j.issn.1000-4718.2011.01.030
1000-4718(2011)01-0153-08
2010-07-01
2010-09-25
深圳市科技计划重点资助项目(No.201001001)
△通讯作者 Tel:0755-25626750; E-mail:daiyong22@yahoo.com.cn

