超排卵对大鼠卵巢组织结构及生殖内分泌的影响*
王志新, 张 芳
(暨南大学附属第一医院妇产科, 广东 广州 510630)
超排卵对大鼠卵巢组织结构及生殖内分泌的影响*
王志新△, 张 芳
(暨南大学附属第一医院妇产科, 广东 广州 510630)
目的探讨超排卵对大鼠卵巢组织结构和生殖内分泌功能的影响,为临床合理使用超排卵提供理论依据。方法30只雌性SD大鼠随机分为3组: 实验A组接受孕马血清和人绒毛膜促性腺激素重复6次超排卵,实验B组 给予3次生理盐水注射及孕马血清和人绒毛膜促性腺激素重复3次超排卵,对照组接受6次生理盐水注射。15 d及30 d后分别处死各组一半大鼠,观察卵巢组织形态学变化,采用放射免疫法检测血清雌二醇(E2)、卵泡刺激素(FSH)、黄体生成素(LH)水平,并计算FSH/LH水平,比较各组间的差异。结果实验A和B组大鼠卵巢始基卵泡和初级卵泡计数明显低于对照组(P<0.05),但各组大鼠体内血清基础激素水平无显著差异(P>0.05)。结论超排卵会引起大鼠卵巢的卵泡发育受限,且随着超排卵次数的增加而加重,但尚未导致生殖内分泌激素水平的显著改变。
超排卵; 卵泡; 大鼠; 生殖内分泌
应用促排卵药物促使多个卵泡发育并成熟即超排卵(superovulation),是治疗女性不孕症的重要手段之一。自上世纪60年代以来,促排卵药物被广泛应用在各种不孕症患者的治疗中,而且随着近年不孕症发病率的增高和辅助生育技术的普及,超排卵越来越普遍。超排卵通常用于有排卵障碍的患者以及辅助生育技术等的促排卵周期,目的是通过增加获取的成熟卵子的数量,以提高妊娠率。但由于促排卵药物毕竟使卵巢处于非生理状态的刺激下,所以超排卵是否会影响卵巢的储备功能从而导致患者卵巢早衰,甚至使患者过早进入更年期,一直是临床医生和科研工作者共同关注的课题[1]。本研究通过对大鼠进行超排卵,观察卵巢组织形态学及生殖内分泌的变化,旨在探讨超排卵对卵巢组织结构和功能的影响,为临床合理选择超排卵治疗提供直接的理论依据。
材 料 和 方 法
1动物及分组
清洁级雌性成年未孕spague-Dawley(SD)大鼠,鼠龄60-70 d,体质量为(230±20)g,由广东省医学实验动物中心提供。标准条件下饲养5 d熟悉环境后,每天晨8∶00至9∶00取阴道分泌物涂片,显微镜观察动情周期,选择30只有正常动情周期的动物,随机分为实验A组:重复超排卵6个周期(10只); 实验B组:重复超排卵3个周期(10只); 对照组:生理盐水注射(10只)。
2超排卵方案
参照卢庆等[2]的方法,用棉签沾生理盐水后, 取阴道脱落细胞涂片,显微镜下观察到角化上皮细胞、白细胞和少许有核上皮细胞视为动情后期,实验A组在动情后期腹腔注射孕马血清40 IU/1 mL(宁波市第二激素厂,1 000 IU/支),48 h后再次腹腔注射人绒毛膜促性腺激素40 IU/1 mL(宁波市第二激素厂,1 000 IU/支)进行超排卵。2 d后重复同样操作,共6次; 实验B组在实验A组前3个超排卵周期的同时,只重复腹腔注射生理盐水1 mL,后3个超排卵周期进行与实验组A同样的操作; 对照组同时重复腹腔注射生理盐水1 mL,共6个周期。
3卵巢组织形态学观察及卵泡数目计数
超排卵后15 d及30 d后,分别处死各组一半大鼠,剖腹迅速取下双侧卵巢,去除卵巢周围脂层,置于4%多聚甲醛溶液中固定,常规石蜡包埋,4 μm连续切片;每间隔9张取1张切片(即第10张),HE染色,显微镜观察组织学变化;按Myers等[3]计数卵泡的方法以卵母细胞核为计数标志,根据卵泡形态,计数始基卵泡和初级卵泡数目。采用单盲法独立观察所有切片。
4放射免疫法检测血清基础激素水平
麻醉大鼠后,暴露腹主动脉,用注射器取血3 mL,3 000 r/min离心15 min分离血清,取血清置于-20 ℃待测。严格按照试剂盒说明书进行放射免疫法检测血清中血清雌二醇(estrodiol,E2)、卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)水平,并计算FSH/LH比值。3种性激素放射免疫分析试剂盒均购于北京华英生物技术研究所,同一种激素检测均同一批进行。
5统计学处理
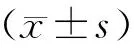
结 果
1超排卵对大鼠卵巢组织形态学及各级卵泡数目的影响
超排卵后15 d及30 d,对照组(图1E-F)可见较多生长卵泡,直径大小不等,卵巢皮质下见较多始基卵泡和初级卵泡分布。实验A和B组(图1A-D)生长卵泡数目较少,未见较大直径卵泡,闭锁卵泡数目较多,卵巢皮质下始基卵泡和初级卵泡可见。

Figure 1. The hematoxylin-eosin staining showed the number of primordial follicles and primary follicles in the rats treated with superovulation by injecting PMSG and HCG for 6 times and the rats treated with superovulation for 3 times was significantly less than that in the control rats, which were treated with normal saline for 6 times.The more frequently used,the more seriously superovulation caused ( HE staining,×25). A: experimental group A(15 d after 6-time superovulation); B: experimental group A (30 d after 6-time superovulation); C: experimental group B (15 d after 3-time superovulation); D:experimental group B(30 d after 3-time superovulation); E: control group after 15 d; F: control group after 30 d.
图1大鼠卵巢组织苏木素-伊红染色
超排卵后15 d,实验A组始基卵泡和初级卵泡数明显少于实验B组和对照组(P<0.05),实验B组亦明显低于对照组(P<0.05)。超排卵后30 d,实验A和B组始基卵泡和初级卵泡数均明显少于对照组(P<0.05),但两实验组之间无显著差异(P>0.05)。实验B组随时间变化,始基卵泡和初级卵泡数显著降低(P<0.05),见表1。
2超排卵对血清E2、FSH、LH、FSH/LH的影响
超排卵后30 d, 实验A组 E2水平低于对照组,但差异无显著(P>0.05);实验A、B两组FSH水平均高于对照组,但无显著差异(P>0.05);实验B组 LH水平高于对照组,但差异无显著(P>0.05); 实验A组 FSH/LH值高于对照组,但无显著差异(P>0.05)。超排卵后15 d实验A、B两组FSH/LH值均低于对照组,但无显著差异(P>0.05),见表2、3。
表1各组大鼠始基卵泡和初级卵泡计数变化


Group15daftersuperovulation30daftersuperovulationControl461±50467±92ExperimentalA351±59*#321±51*ExperimentalB417±27*362±58*
*P<0.05vscontrol group;#P<0.05vsexperimental B group.

表2 超排卵对大鼠血清基础激素水平的影响
表3超排卵对大鼠血清FSH/LH的影响


Group15daftersuperovulation30daftersuperovulationControl0.90±0.160.77±0.18ExperimentalA0.73±0.160.84±0.07ExperimentalB0.67±0.180.73±0.15
讨 论
近年来不孕症的发生率也不断升高,辅助生殖技术(assisted reproductive technology,ART)的临床运用及研究都取得了巨大进步,获得足够数量的成熟卵母细胞是决定辅助生殖技术治疗周期成败的重要环节,一般通过合理选择超排卵来解决。但超排卵是否会引起卵巢早衰,一直备受关注。本研究用SD大鼠为研究对象,对其进行重复超排卵,通过观察大鼠的卵巢组织形态学及卵泡发育的变化、检测血清中E2、FSH、LH水平及FSH/LH比值,为合理选择超排卵治疗提供直接的理论依据。
周期性是雌性生殖的特点,卵子的成熟和性激素的分泌都呈周期性波动。动情周期则是性腺功能是否正常的客观标志之一[4]。阴道黏膜上皮为复层扁平上皮,会发生周期性脱落。动情周期中阴道脱落细胞形态的变化主要是受动情周期中雌激素变化的影响[5],故研究选择在动情后期实施超排卵处理。
卵巢储备功能反映女性的生育能力,从形态学上看,主要包括卵巢内存留的卵泡数目和卵子质量两个方面。卵巢储备的基本形式是始基卵泡和初级卵泡,其数量是反映卵巢储备的客观指标,对评估卵巢储备功能具有重要价值。但临床上难以对卵巢内存留的卵泡数或卵子质量进行直接检测,多通过综合评判基础血清E2、FSH、LH水平、FSH/LH比值等,间接反映卵巢储备功能[6]。
正常情况下,妇女卵巢中卵泡的储备在新生儿出生时就已经确定,除了在生育期大约有300-400个卵母细胞发育成熟并经排卵过程排出外,其余卵泡均在发育过程中逐渐退化闭锁。但在超排卵时,由于大量的卵泡同时募集发育,所以每个周期的排卵量大大增加。本研究通过观察大鼠卵巢组织连续切片,计数始基卵泡和初级卵泡数,结果显示超排卵后15 d,实验A组始基卵泡和初级卵泡数明显少于实验B组和对照组(P<0.05),实验B组亦明显低于对照组(P<0.05)。超排卵后30 d,实验A和B组始基卵泡和初级卵泡数均明显少于对照组(P<0.05),但两实验组之间的差异无显著(P>0.05)。实验B组随时间变化,始基卵泡和初级卵泡数显著降低(P<0.05)。证实超排卵降低了大鼠卵巢的储备功能。
目前生殖医学专家学者普遍认为反复的卵巢刺激及卵巢穿刺手术本身不影响卵巢的储备功能,其原因可能是促性腺激素主要是通过卵泡膜细胞/颗粒细胞上的FSH及LH受体来发挥促进卵泡生长的生理作用,而只有当卵泡发育至窦卵泡前期时颗粒细胞才出现特异性FSH的表达,此时卵泡已经完成由卵泡池中的始基卵泡的募集过程。因此,每次超排卵募集并不消耗作为卵巢储备功能基本功能单位的始基卵泡,而是通过外源性的给予大量的FSH/HMG,减少已募集的卵泡发生闭锁,从而使得更多的同簇卵泡生长发育。所以患者在接受多个周期的促排卵治疗后卵巢的储备功能并没有出现过度消耗[7]。但是本实验结果却证实超排卵会消耗卵泡资源,这可能与高彦等[8]的研究结果有关,他们认为促排卵时,不同于自然生理周期的FSH和LH升高,可使停滞于黄体晚期的早期窦状卵泡阶段得到进一步的发育,从而实现在黄体晚期达到对卵泡的提前募集,使卵泡的募集提早到前一周期的黄体中期,从而引起窦卵泡池中卵泡数量的减少。而始基卵泡提早凋亡的机制可能与李忠香等[9]的研究有关,他们应用末端标记法(TUNEL)和免疫组织化学方法研究生育年龄女性早期卵泡内细胞凋亡和Bcl-2/Bax蛋白表达,发现早期卵泡内卵细胞凋亡以及凋亡调节蛋白Bax在卵细胞表达,提示Bax介导的卵细胞凋亡可能是生育年龄女性早期卵泡闭锁的机制。超排卵过程可能触发了相关凋亡机制,从而导致作为储备功能的始基卵泡和初级卵泡大量凋亡。
通常情况下随着卵巢储备功能的下降,卵泡颗粒细胞分泌的抑制素会减少,导致月经第3 d的基础FSH水平逐渐升高,促进一定数量窦卵泡的发育生长,由此所分泌的E2水平也会逐渐升高,因此在基础状态下的FSH和E2水平某种程度上可以间接反映卵巢的储备功能。但是与其他实验结果相比较,虽然本研究中实验A组超排卵治疗后30 d大鼠血清E2水平较对照组降低,FSH升高,FSH/LH比值增高,但均无显著差异(P>0.05),在激素水平上尚不支持超排卵导致大鼠卵巢储备功能降低。Nelson等[10]发现有些卵巢早衰患者会有暂时性的卵巢功能恢复,经连续测定血清性激素,结果显示几乎半数卵巢早衰妇女表现有间断性卵巢功能恢复,E2水平可达183 pmol/L以上。因此徐苓等[11]认为这种现象的病理生理特点和绝经过渡期相似,此间卵巢内残存的卵泡仍有间断活动,可导致性激素水平的波动性和不稳定性。因此,仅1次测定显示FSH水平升高并不能断定卵巢功能一定完全衰竭,有时需重复测定,FSH持续升高才提示卵巢早衰可能。应该注意的是,血清FSH水平并不能够一定反应卵巢中原始卵泡的数目,FSH升高只是窦状卵泡在发育过程中缺乏雌激素和抑制素的负反馈作用时的表现。本研究结果提示血清基础激素水平已有所变化,但尚无显著差异(P>0.05),可能与样本量尚较少,放免法灵敏度高以及实验误差有关。
综上所述,本研究认为,超排卵可影响卵巢卵泡发育,使其储备能力下降。因此,在临床应用中,在提高妊娠率的同时,合理应用促排卵药物,合理安排超排卵周期及其间隔时间,防止卵巢早衰的发生。
[1] Kolibianakis E, Osmanagaoglu K, Camus M, et al. Effects of repeated assisted reproductive technology cycles on ovarian response[J]. Fertil Steril, 2002, 77(5): 967-970.
[2] 卢 庆,曹爱巧,刘丽均,等. SD大鼠超数排卵及早期胚胎体内发育[J]. 动物医学进展, 2005, 26(10): 68-72.
[3] Myers M, Britt KL, Wreford GM, et al. Methods for quantifying follicular numbers within the mouse ovary[J]. Reproduction, 2004, 127(5): 569-580.
[4] Miller LJ, Girgis C, Gupta R. Depression and related disorders during the female reproductive cycle[J]. Womens Health(Lond Engl), 2009, 5(5): 577-587.
[5] 张 森, 王 新, 韦旭斌. 大鼠发情周期各阶段的阴道细胞变化观察[J]. 动物医学进展, 2006, 27(2): 69-72.
[6] Maheshwaril A, Fowler P, Bhattacharya S. Assessment of ovarian reserve-should we perform tests of ovarian reserve routinely?[J]. Hum Reprod, 2006, 21(11): 2729-2735.
[7] Lekamge DN, Barry M, Kolo M. Anti-Müllerian hormone as a predictor of IVF outcome[J]. Reprod Biomed Online, 2007, 14 (5): 602-610.
[8] 高 彦, 冒韵东, 王 炜,等. GnRH-a对卵巢黄体期生殖激素水平及卵泡募集的影响[J]. 现代生物医学进展, 2009, 9(12): 2295-2296.
[9] 李忠香, 王自能. 生育年龄妇女早期卵泡细胞凋亡和Bcl-2/BAX蛋白表达[J]. 中国病理生理杂志, 2004,20(10): 1908-1911.
[10]Nelson LM, Anasti JN, Kimaey LM, et al. Development of luteinized graafian follicles in patients with karyotypically normal spontaneous premature ovarian failure[J]. Clin Endocrinol Metab, 1994, 79(2): 1470-1475.
[11]徐 苓, 宋亦军. 卵巢早衰的临床表现和诊断标准[J]. 实用妇产科杂志, 2003, 19(4): 195-196.
Effectsofsuperovulationonhistologicalchangesandfunctionsofreproductiveendocrineinratovary
WANG Zhi-xin, ZHANG Fang
(DepartmentofObstetricsandGynecology,TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510630,China.E-mail:wangzhixin6666@126.com)
AIM: To study the effects of superovulation on the histological changes and reproductive endocrinic functions of rat ovary.METHODSThirty female SD rats were randomly divided into 3 groups: the rats in experimental group A were treated with pregnant mare serum gonadotropin (PMSG) and human chorionic gonadotropin (HCG) for 6 times; the rats in experimental group B were treated with normal saline for 3 times, subsequently stimulated with the same reagents in experimental group A for 3 times; the control rats were treated with normal saline for 6 times. Half of the rats were killed on the 15th day of the experiment, and the others were killed at the end of the experiment. The ovarian morphology and follicle number were observed. The serum estrodiol-2 (E2), follicle stimulating hormone (FSH), luteinizing hormone (LH) and FSH/LH levels were determined by radioimmunoassay.RESULTSThe number of primordial follicles and primary follicles in the two experimental groups were significantly lower than those in control group (P<0.05). However, no significant difference of the serum basal hormone level among the 3 groups was observed (P>0.05).CONCLUSIONSuperovulation can restrain the development of the follicles in a frequency-dependent manner.
Superovulation; Follicle; Rats; Reproductive endocrine
R71
A
10.3969/j.issn.1000-4718.2011.01.031
1000-4718(2011)01-0161-04
2010-10-27
2010-11-24
广东省医学科学技术研究基金资助项目(No.A2010325)
△ 通讯作者 Tel:020-38688105; E-mail: wangzhixin6666@126.com

