高脂饮食叙利亚金黄地鼠胰岛局部血管紧张素Ⅱ的生成途径研究*
叶文慧, 孙 侃, 孙 嘉, 张 桦, 陈 宏, 蔡德鸿
(南方医科大学珠江医院内分泌科, 广州 广东 510282)
高脂饮食叙利亚金黄地鼠胰岛局部血管紧张素Ⅱ的生成途径研究*
叶文慧, 孙 侃, 孙 嘉, 张 桦, 陈 宏, 蔡德鸿
(南方医科大学珠江医院内分泌科, 广州 广东 510282)
目的观察不同抑制剂阻断局部肾素血管紧张素系统(RAS)后,对血脂谱异常血症叙利亚金黄地鼠胰岛细胞生成血管紧张素Ⅱ(AngⅡ)的影响,探讨高脂饮食下胰岛局部血管紧张素的不同生成途径。方法挑选分离纯化后血脂谱异常及正常叙利亚金黄地鼠胰岛细胞,各分为对照组和卡托普利组、糜蛋白酶抑素组、抑肽酶组、α-抗胰蛋白酶组和卡托普利+糜蛋白酶抑素组共12个组,加入血管紧张素Ⅰ后再按组别加入卡托普利、糜蛋白酶抑素、抑肽酶、α-抗胰蛋白酶及卡托普利联合糜蛋白酶抑素干预胰岛细胞。用酶联免疫吸附测定法(ELISA)检测上清中AngⅡ的含量。结果各干预组AngⅡ均较对照组减少。其中正常地鼠组中卡托普利组、糜蛋白酶抑素组、α-抗胰蛋白酶组、抑肽酶组和卡托普利联合糜蛋白酶抑素组的AngⅡ分别较对照组减少了39.98%、50.10%(P<0.01)、23.04%、20.85%(P<0.05)和82.78%(P<0.01);高脂组地鼠上述各值分别为42.12%、56.96%(P<0.01)、26.11%、22.68%(P<0.05)和83.59%(P<0.01),正常组与高脂饮食地鼠糜蛋白酶组中AngⅡ差异显著(P<0.05)。结论血脂谱异常雄性叙利亚金黄地鼠胰岛局部血管紧张素Ⅱ的生成仍以经典的血管紧张素转换酶途径和糜蛋白酶途径为主。在血脂异常病理状态下,相比较血管紧张素转化酶抑制剂而言,糜蛋白酶抑素对局部AngⅡ生成的抑制更为强烈。
胰岛; 高脂饮食; 肾素-血管紧张素系统; 糜蛋白酶
目前,关于局部肾素-血管紧张素系统(renin-angiotensin system, RAS)的研究在国内外逐渐受到重视[1]。胰岛已被证实存在局部的RAS系统[2]。在本课题组早期研究中我们发现,胰岛局部血管紧张素Ⅱ的生成除经典的血管紧张素转换酶(angiotensin-converting enzyme, ACE)途径之外还存在有糜蛋白酶途径[3]。而在血脂异常、高血压及糖尿病等病理状态下,除ACE介导的血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)生成之外,糜蛋白酶同样介导局部AngⅡ的产生,既往关于病理状态下胰岛糜蛋白酶途径相关的报道少之又少,本文旨在研究高脂饮食导致血脂异常病理情况下对叙利亚金黄地鼠胰岛局部血管紧张素Ⅱ生成的影响并探讨其可能机制。
材 料 和 方 法
1材料
1.1动物及主要材料 健康SPF级雄性叙利亚金黄地鼠,封闭群,体重150-200 g(北京维通利华实验动物技术有限公司)。双硫腙(DTZ,上海试剂三厂);10%小牛血清(海克隆生物化学制品有限公司);胶原酶V、Ficoll400、CMRI-1066培养基、血管紧张素Ⅰ、卡托普利粉剂、糜酶抑制剂、α-抗胰蛋白酶(Sigma),抑肽酶(Amresco);叙利亚金黄地鼠血管紧张素Ⅱ ELISA试剂盒(ADL)。4 ℃立式冷冻离心机(上海安亭公司);CO2细胞培养箱(Sanyo);酶标检测仪(Bio-TeK ELx808)。基础饲料:蛋白质18.50%,水分9.80%,灰分5.60%,粗脂肪4.20%,粗纤维3.20%,钙1.22%,磷0.84%。高脂饲料:10%猪油,10%玉米油,1%胆固醇,0.25%胆酸钠+基础饲料,均购买于广东省动物实验中心。
2方法
2.1动物分组及高脂地鼠模型建立 雄性叙利亚金黄地鼠30只,普通饲料适应性喂养1周后随机分为正常对照组(普通饲料),高脂组(高脂饲料),每组15只。第0、1、2、6、12周测定血浆葡萄糖(glucose, Glu)、甘油三酯(triglyceride, TG)、胆固醇(cholesterin, TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterin, HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterin, LDL-C)的水平。金黄地鼠过夜禁食12 h,第2 d清晨测体重,水合氯醛腹腔注射麻醉,玻璃毛细管自内眦眼眶静脉丛取血1.5 mL,肝素化的离心管3 000 r/min离心10 min,分离血清做生化分析检测。12周末,分离胰岛完毕后,肉眼观察肝脏,肝脏称重,计算肝指数(肝指数=肝脏质量/体质量×100%)。留取肝脏叶,立即投入10%甲醛溶液固定,各级乙醇脱水,二甲苯透明,石蜡包埋切片,苏木精和伊红染色,光学显微镜下观察。肝组织病理均由2个病理科医生在光学显微镜下检查, 作出双盲判断。每张切片观察5个肝小叶, 以平均每个肝小叶内脂肪变性的肝细胞所占百分比表示肝脏脂肪变性程度,根据美国肝病协会(AASLD)2002年拟定的NAFLD诊断标准中的组织学诊断标准进行。
2.2地鼠胰岛的分离纯化与染色 地鼠禁食过夜后麻醉,作腹部“个”字型切口。近十二指肠端结扎胆总管,于近夹闭点用课题组自制穿刺针顺行胆管内插管。缓慢注入胶原酶Ⅴ溶液5 mL,使胰腺充分膨胀。摘取胰腺后38 ℃水浴静止消化约15 min。取出后用力振摇使胰腺散开呈细沙状颗粒,终止消化后收集沉淀。将分离好的胰岛细胞加入50 mL离心管中,再加入预先配好不同浓度的Ficoll液,利用密度梯度法纯化胰岛。纯化后胰岛经DTZ染色后置于倒置显微镜下观察。
2.3不同抑制剂干预对胰岛局部RAS生成AngⅡ的影响 倒置显微镜下手工挑取直径150-200 μm(即1个胰岛当量)的胰岛加于24孔板中,按健康及高脂分为对照组、卡托普利组、糜蛋白酶抑素组、抑肽酶组、α-抗胰蛋白酶组以及卡托普利+糜蛋白酶抑素组共12个组,每组各4个复孔,每孔加入20胰岛当量(IEQ)的胰岛后补加含10%胎牛血清及5 mmol/L葡萄糖的CMRI-1066培养基0.5 mL,预孵育30 min后用PBS液冲洗胰岛细胞3次,去除培养液中的血清,各组均加入0.02 μmol/L AngⅠ 50 μL。然后依据分组情况,对照组直接加入100 μL PBS;卡托普利组、糜蛋白酶抑素组、抑肽酶组、α-抗胰蛋白酶组均加入50 μL PBS后分别加入50 μL 2 mmol/L卡托普利;50μL 0.1mmol/L糜蛋白酶抑素;50 μL 1 mmol/L抑肽酶;50 μL 0.1 mg/L α-抗胰蛋白酶;卡托普利+糜蛋白酶抑素组加入50 μL 2 mmol/L卡托普利和50 μL 0.1 mmol/L糜蛋白酶抑素。待添加完成后将24孔板置于37 ℃、5% CO2的恒温培养箱中孵育120 min。120 min后收集各孔上清,采用竞争法ELISA检测上清中AngⅡ浓度,于波长450 nm的酶标仪上读数。
3统计学处理
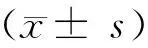
结 果
1高脂模型建立
高脂喂养组金黄地鼠出现明显的乳糜血,高脂组TC、TG、HDL-C和LDL-C与对照组相比均升高,差异均显著(P<0.01)。高脂组地鼠肝指数升高,差异显著(P<0.01);高脂组地鼠与对照组相比肝指数升高,差异显著(P<0.05),见表1。正常组地鼠肝脏呈鲜红色,边缘锐利,表面光滑,质地柔软,体积无增大;高脂组地鼠肝脏颜色黄、紫、红色相交,边缘圆钝,包膜紧张,体积明显增大。光镜观察:对照组肝小叶结构清晰,肝细胞排列整齐,体积正常,肝脏边缘薄,形态未见明显变化,见图1A。高脂组肝细胞明显肿胀增大,有脂肪滴即脂肪囊存在,部分肝细胞呈空泡状,肝细胞间见炎症细胞,见图1B。
表112周时2组金黄地鼠血脂及肝指数比较


GroupTC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)Hepatosomaticindex(%)Control2.36±0.521.80±2.301.26±0.501.16±0.312.95±0.26High-fat8.23±1.22**10.52±1.20**2.09±0.2*3.02±0.12**5.62±0.51**
*P<0.05,**P<0.01vscontrol.TC:total cholesterol; TG:triglyceride; HDL-C:high-density lipoproteol cholesterol; LDL-C: low-density lipoprotein cholesterol.
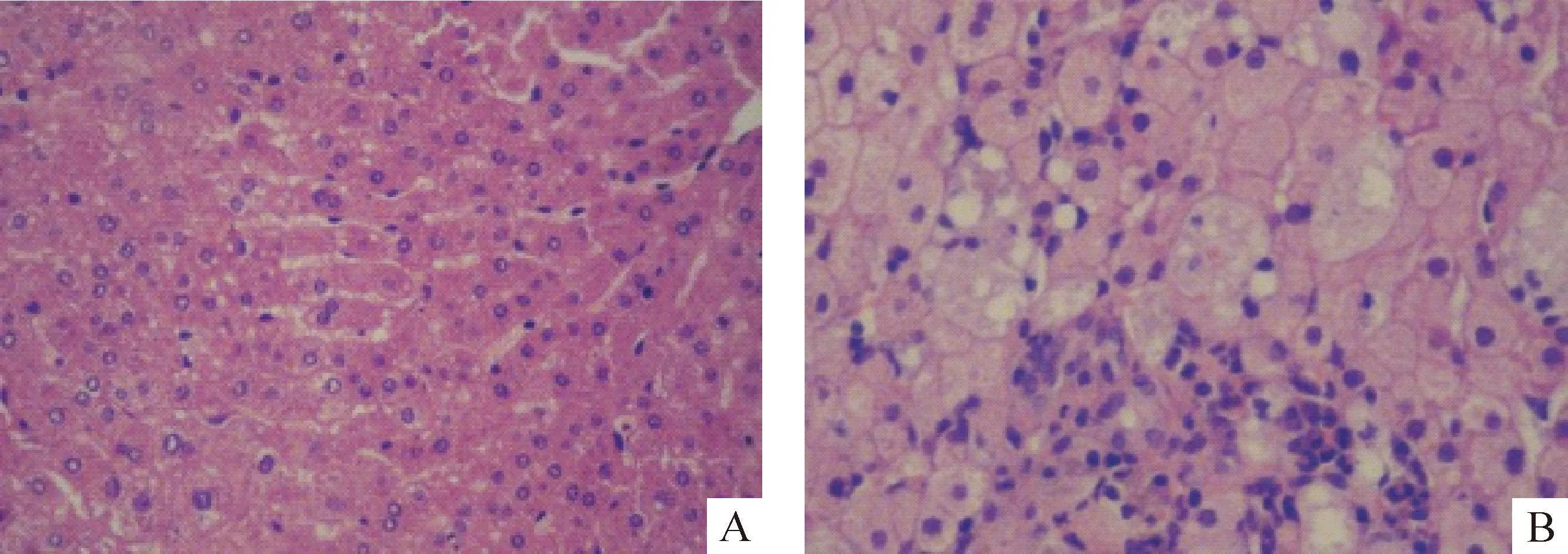
Figure 1. Histopathological changes in the liver (HE staining,×200). A:control group;B:high-fat diet group.
图1各组肝组织病理变化
2胰岛分离与纯化
按本课题组早期纯化方法[3,4],纯化后的胰岛包膜完整,基本不含外分泌腺组织,见图2。胰岛细胞纯度>90%,胰岛细胞存活率>90%。

Figure 2. Hamster islets of Langerhans after purification (DTZ, ×400).
图2初步纯化后的地鼠胰岛细胞团
3各组抑制剂正常组地鼠胰岛细胞AngⅡ产生的影响
各组抑制剂中血管紧张素Ⅱ浓度差异显著。卡托普利组、糜蛋白酶抑素组、抑肽酶组、α-抗胰蛋白酶组以及卡托普利+糜蛋白酶抑素组中的AngⅡ均较对照组减少。其中卡托普利组和糜蛋白酶抑素组中的AngⅡ分别较对照组减少了39.98%和50.10%,P<0.01,但2组间的差异无显著。而α-抗胰蛋白酶组和抑肽酶组的抑制效果虽不如前2组强,但也较对照组减少了23.04%和20.85%(P<0.05)。卡托普利+糜蛋白酶抑素联合组较对照组AngⅡ减少了82.78%(P<0.01),见图3。
4各组抑制剂对高脂饮食地鼠胰岛细胞AngⅡ产生的影响
卡托普利组、糜蛋白酶抑素组、抑肽酶组、α-抗胰蛋白酶组以及卡托普利+糜蛋白酶抑素组中的AngⅡ均较对照组减少,其中卡托普利组和糜蛋白酶抑素组中的AngⅡ分别较对照组减少了42.12%和56.96%,P<0.05,卡托普利组和糜蛋白酶抑素组中AngⅡ的差异显著。α-抗胰蛋白酶组和抑肽酶组的抑制效果仍然不如上述2组明显,分别较对照组减少了26.11%和22.68%,P<0.05,卡托普利联合糜蛋白酶抑素组较对照组AngⅡ的生成减少了83.59%,P<0.05,见图4。糜蛋白酶抑素组中,血脂谱异常血症地鼠胰岛局部AngⅡ的生成与健康地鼠分别减少了50.10%和55.86%,P<0.05,2个糜蛋白酶抑素组中AngⅡ的差异显著,见图5。

图3正常金黄地鼠不同抑制组对胰岛细胞局部产生血管紧张素Ⅱ的比较

图4高脂喂养金黄地鼠不同抑制组对胰岛细胞局部产生血管紧张素Ⅱ的比较

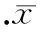
图5正常组及血脂异常组金黄地鼠胰岛细胞局部产生血管紧张素Ⅱ的比较
讨 论
研究发现,在局部RAS中,AngⅡ可由局部组织丝氨酸蛋白酶家族(包括糜蛋白酶、胰蛋白酶、紧张肽、组织蛋白酶G等)非ACE途径生成[5]。本课题组前期研究发现[3,6]:叙利亚金黄地鼠胰岛细胞主要由糜蛋白酶和ACE途径来产生AngⅡ,卡托普利+糜蛋白酶抑素组对AngⅡ产生的抑制远超过2种抑制剂单独使用,糜蛋白酶和ACE分别通过不同作用位点来刺激局部胰岛产生AngⅡ。生理状态下胰岛细胞由ACE与糜蛋白酶途径生成的AngⅡ作用相似。除糜蛋白酶以外,由丝氨酸蛋白酶家族其它途径所生成的AngⅡ量占1/5左右,由糜蛋白酶途径生成的AngⅡ并未占据主导地位。本研究应用高脂饮食喂养构建叙利亚金黄地鼠血脂紊乱模型,观察在血脂紊乱疾病状态下对不同AngⅡ生成途径的影响。
本研究经过12周高脂喂养叙利亚金黄地鼠,成功建立高脂地鼠模型,经高脂喂养地鼠出现血脂紊乱、肝指数水平升高及肝内脂肪样变病理情况与文献[3]研究结果相类似。目前国内外关于高脂高热量饲养的研究多取材于大鼠和小鼠。大鼠在血脂代谢上与人类存在很大差异,有种属差异所致的局限性。大鼠和小鼠均具有抗动脉粥样硬化发生的能力。大鼠血脂水平个体差异较大,经肝外合成的内源性胆固醇比例仅占35%,人类为90%,叙利亚金黄地鼠肝外合成内源性胆固醇的比例为85%,与人类的十分接近。雄性叙利亚金黄地鼠因在脂类代谢及脂蛋白代谢受体基因序列上更接近人类,在给予高脂饲料时容易进展成血脂代谢紊乱、脂肪肝及动脉硬化。另外,研究发现,在人、猴、狗和地鼠中,某些组织局部90%的AngⅡ都是通过糜蛋白酶途径生成,该途径所产生的AngⅡ主要参与局部组织病理性重构。相比较而言,大鼠、兔等动物则无法通过糜蛋白酶途径来产生AngⅡ[7]。因此,本研究选用金黄地鼠作为血脂代谢紊乱模型观察AngⅡ生成影响。
近期的研究发现在机体病理过程中,体循环经典RAS系统多参与急性调节,而局部RAS更多与亚急性、慢性调节相关[8],并将局部RAS进一步细分为细胞内RAS和细胞外RAS,细胞内RAS的AngⅡ合成在高糖持续刺激下更为显著[9]。研究者们还发现,受损血管糜蛋白酶活性较正常血管明显增高,而ACE通路作用产生的AngⅡ并没有显著变化。此外,糜蛋白酶抑制剂和ARB类药物可明显减少缀生血管及相关内皮细胞的爬行,而ACEI组并未观察到类似形态学改变[10]。本研究中,我们应用高脂模型观察到在血脂紊乱的病理状态下,对照组地鼠的AngⅡ与健康对照组相比较无显著差异,但卡托普利组和糜蛋白酶抑素组中的AngⅡ分别较对照组减少了42.12%和56.96%,二者对AngⅡ的抑制呈现明显差异。糜蛋白酶抑素在此时能较卡托普利抑制更多的AngⅡ生成。并且血脂紊乱组糜蛋白酶组与正常组糜蛋白相比,AngⅡ较对照组减少了56.96%和50.10%,差异明显,虽然这与国外报道的糜蛋白酶可阻止局部90%的AngⅡ生成的结果有所差别[7],但本研究已说明糜蛋白酶在病理状态下存在局部的高表达,在高脂血症等疾病状态下被加强激活,介导生成过量的AngⅡ并最终导致病理状态下局部组织的损伤。血脂谱异常血症雄性叙利亚金黄地鼠胰岛局部血管紧张素Ⅱ的生成仍存在经典的血管紧张素转换酶途径和糜蛋白酶途径,在此状态下,叙利亚金黄地鼠由糜蛋白酶途径所生成的AngⅡ比血管紧张素转化酶途径所生成的AngⅡ多,即糜蛋白酶抑素能较ACEI类药物更强地抑制胰岛局部AngⅡ的产生。
胰岛为高密度毛细血管网络化的微器官,局部RAS系统拥有体循环经典RAS系统的全部组分[11,12],肾素、ACE、ACE2、AT1及AT2受体等均有表达[2,13]。而且,局部RAS系统多在糖脂紊乱、高血压等疾病状态下被过度激活,而此时体循环的肾素和AngⅡ水平并不显著上升[2]。既往实验及本课题组研究均提示糜蛋白酶超过ACE成为介导某些局部组织AngⅡ生成的主要途径,在病理状态下局部RAS的激活可能是由于糜蛋白酶高表达又或者是糜蛋白酶和ACE二者协同作用所致。
综上所述,胰岛作为机体血供极其丰富的微器官之一,除体循环RAS外还存在局部RAS。局部RAS多在血脂紊乱、糖尿病、高血压等疾病状态下被过度激活,而此时体循环的肾素、AngⅡ和ACE水平并不显著上升,而且部RAS中的 AngⅡ在不同生理和病理状态下的产生途径也存在明显差别。血脂紊乱的病理状态体下糜蛋白酶途径被进一步激活,比正常健康状态下局部产生更多的AngⅡ。糜蛋白酶途径在病理状态下加强,提示我们在研究RAS相关疾病病理生理的时候应注意局部RAS的独立性和重要性。此外,糜蛋白酶及血脂代谢的种属特异性还提示在研究RAS相关血脂紊乱病理状态下局部组织重构时应选择合适的动物模型。但要进一步了解整个RAS,仍需更多的研究。
[1] Kumar R, Boim MA. Diversity of pathways for intracellular angiotensin II synthesis[J]. Curr Opin Nephrol Hypertens,2009,18(1): 33-39.
[2] Tikellis C, Cooper ME, Thomas MC. Role of the renin-angiotensin system in the endocrine pancreas: Implications for the development of diabetes[J]. Int J Biochem Cell Biol, 2006, 38(5-6): 737-751.
[3] 孙 侃,孙 嘉,陈 宏,等.叙利亚金黄地鼠胰岛局部血管紧张素Ⅱ的生成途径与机制探讨[J].解放军医学杂志,2009,34(8):974-976.
[4] 孙 嘉,张 桦,蔡德鸿.大鼠胰岛微血管内皮细胞分离、纯化与培养的改进[J].中国病理生理杂志,2008,24(7):1454-1456.
[5] Leung PS. The peptide hormone angiotensin Ⅱ its new functions in tissues and organs[J]. Curr Protein Pept Sci, 2004, 5(4): 267-273.
[6] 孙 嘉,蔡德鸿,张 桦,等.血管紧张素Ⅱ与人离体胰岛功能研究[J].中华内分泌代谢杂志,2005,21(6):569-572.
[7] Miyazaki M, Takai S, Jin D, et al. Pathological roles of angiotensin II produced by mast cell chymase and the effects of chymase inhibition in animal models[J]. Pharmacol Ther, 2006, 112(3): 668-676.
[8] Paul M,Poyan Mehr A,Kreutz R.Physiology of local renin-angiotensin systems[J]. Physiol Rev, 2006, 86(3): 747-803.
[9] Magliano DJ, Shaw JE, Shortreed SM,et al. Lifetime risk and projected population prevalence of diabetes [J]. Diabetologia, 2008, 51(12): 2179-2186.
[10]Takai S, Jin D, Muramatsu M, et al. Chymase as a novel target for the prevention of vascular diseases [J]. Trends Pharmacol Sci,2004,25(10): 518-522.
[11]Tikellis C, Cooper ME, Thomas MC. Role of the renin-angiotensin system in the endocrine pancreas: Implications for the development of diabetes[J]. Int J Biochem Cell Biol, 2006, 38(5-6): 737-751.
[12]李晓永, 苏 青. 胰岛内肾素-血管紧张素系统的研究进展[J]. 上海交通大学学报(医学版), 2008, 28(7): 901-904.
[13]Leung PS. The physiology of a local renin-angiotensin system in the pancreas[J]. J Physiol,2007, 580(Pt 1): 31-37.
PathwaysoflocalangiotensinIIgenerationinisletsofLangerhansinSyriangoldenhamsterfedwithhigh-fatdiet
YE Wen-hui, SUN Kan, SUN Jia, ZHANG Hua, CHEN Hong, CAI De-hong
(DepartmentofEndocrinology,ZhujiangHospital,SouthernMedicalUniversity,Guangzhou510282,China.E-mail:cai_deng_hong@126.com)
AIM: To investigate the diverse pathways of local angiotensin Ⅱ (Ang Ⅱ) generation in islets of Langerhans in Syrian golden hamsters with dyslipidemia.METHODSThe Syrian golden hamsters were fed with high-fat diet to induce dyslipidemia. Purified islet cells from dyslipidemia and normal Syrian hamsters were prepared and divided into control group, captopril group, chymotrypsin endostatin group, aprotinin group, α-antitrypsin group and captopril+chymotrypsin endostatin group by adding respective reagents into the cultured cells after treated with angiotensin I. The Ang Ⅱ levels in the supernatants of each group were examined by ELISA.RESULTSCompared with the control animals, Ang Ⅱ levels decreased in all groups with interventions. Compared with the normal hamsters islet cells, the Ang Ⅱ levels in captopril group, chymotrypsin endostatin group, α-antitrypsin group, aprotinin group and captopril+chymotrypsin endostatin group were decreased by 39.98%, 50.10% (P<0.01), 23.04%, 20.85% (P<0.05) and 82.78% (P<0.01), respectively. Compared with high-fat group, the corresponding data were 42.12%, 56.96% (P<0.01), 26.11%, 22.68% (P<0.05) and 83.59% (P<0.01), respectively. The levels of Ang Ⅱ in chymotrypsin group between normal and high-fat diet hamsters were significantly different (P<0.05).CONCLUSIONUnder the condition of dyslipidemia, the classic angiotensin-converting enzyme-based pathway and chymotrypsin pathway are still the main approaches of producing Ang Ⅱ in male Syrian hamster islet to produce angiotensin. The effect of chymotrypsin endostatin is comparatively stronger in inhibiting the production of local Ang Ⅱ than the effect of angiotensin-converting enzyme inhibitor.
Islets of Langerhans; High-fat diet; Renin-angiotensin system; Chymotrypsin
R587.1
A
10.3969/j.issn.1000-4718.2011.01.026
1000-4718(2011)01-0134-05
2010-07-06
2010-10-19
广东省科技计划资助项目(No.2007-Z-005)
△通讯作者 Tel: 020-62782330; E-mail: cai_deng_hong@126.com

