C反应蛋白对人外周血CD14+单核细胞TLR4信号转导的影响*
彭 隆, 罗艳婷, 刘金来
(中山大学附属第三医院心内科,广东 广州 510630)
C反应蛋白对人外周血CD14+单核细胞TLR4信号转导的影响*
彭 隆, 罗艳婷, 刘金来△
(中山大学附属第三医院心内科,广东 广州 510630)
目的观察C反应蛋白(CRP)对CD14+单核细胞Toll样受体4(TLR4)表达的影响,以探讨CRP在急性冠脉综合征(ACS)致炎机制中的作用。方法不同浓度(5、25、50、100 mg/L)和不同作用时间(6、12、24、48 h)的CRP刺激正常人外周血CD14+单核细胞,或者不同浓度TLR4抑制剂预先干预CD14+单核细胞后,再给予CRP刺激。应用流式细胞仪检测细胞表面TLR4蛋白的表达,定量PCR方法检测TLR4 mRNA和髓样分化蛋白2(MD-2)mRNA表达,ELISA检测刺激前后细胞上清液肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、金属蛋白酶9(MMP-9)水平。结果CRP可剂量依赖和时间依赖地增加CD14+单核细胞表达TLR4和MD-2,高浓度TLR4抑制剂可完全阻断CRP对TLR4、MD-2的影响。TNF-α、IL-6、MMP-9与TLR4、MD-2也呈现相同的变化。结论CRP可激活正常人CD14+单核细胞TLR4信号转导途径,并诱导产生TNF-α、IL-6、MMP-9,提示CRP可作为病原相关分子模式(PAMP),通过TLR4模式受体介导而产生炎症反应,参与动脉粥样硬化形成,促进ACS炎症的发展。
C-反应蛋白质; 受体,Toll样; 单核细胞; 急性冠脉综合征
研究表明C反应蛋白(C-reactive protein,CRP)不但是机体的一种炎症标志物,同时还参与了炎症反应。大量证据显示,CRP参与了动脉粥样硬化的形成,与急性冠脉综合征(acute coronary syndrome, ACS)关系密切,是心血管事件强有力的预测因子[1]。CRP在粥样斑块区聚集,诱导炎症因子、金属蛋白酶及组织因子的表达[2, 3],导致斑块的不稳定[4]。但目前尚不清楚CRP是怎样在易损斑块及斑块破裂的炎症机制起作用。Toll样受体是一类介导天然免疫,识别病原相关分子模式(pathogen associated molecular pattern, PAMP)的信号传递受体家族,在免疫防御反应中起着重要的作用。Toll样受体4(Toll-like receptor 4,TLR4)是机体识别细菌脂多糖(lipopolysaccharide, LPS)的主要信号转导分子[5],能激活核转录因子κB(nuclear factor κB, NF-κB)、活化蛋白1(activating protein 1,AP-1),引起炎症因子的大量释放,存在于内皮细胞、单核细胞、中性粒细胞、树突状细胞及心肌细胞中。多项研究证明:TLR4在动脉粥样硬化斑块中高表达,参与其炎症的发生与发展。本文主要探讨CRP是否作为一种PAMP通过TLR4模式受体介导炎症反应,参与动脉粥样硬化斑块炎症的发生发展。
材 料 和 方 法
1材料
CRP购自Calbiochem;脂多糖(lipopolysaccharide,LPS)购自Sigma;藻红蛋白(phycoerythrin,PE) mouse IgG2a K isotype control、PE anti-human Toll-like receptor 4 (CD284)和藻蓝蛋白(allophycocyanin,APC) anti-human CD14均购于eBioscience;逆转录试剂盒购于Fermentas;荧光定量PCR试剂盒购自TaKaRa;胎牛血清来自Hyclone、RPMI-1640培养基购于Gibco;Trizol试剂为Invitrogen产品;淋巴细胞分离液来自GE Healthcare;ELISA试剂盒为R&D产品。
2方法
2.1细胞培养 收集健康志愿者外周静脉血,用PBS缓冲液1∶1稀释。用尖头吸轻铺于比重1.077淋巴细胞分离液表面,稀释血与淋巴细胞分离液体积比为1∶1,形成清晰界面。2 000 r/min离心20 min,用吸管轻轻将处于分层液面白膜状的单个核细胞吸入另一管内,PBS清洗2次。将细胞重悬于RPMI-1640培养基 (含25 mmol/L HEPES、1 nmol/L谷氨酰胺、10%胎牛血清、1×105U/L青霉素、100 mg/L链霉素)。台盼蓝拒染实验发现活细胞>95%。将细胞接种于培养皿24 h后,第2 d用培养基轻轻清洗2次,将未贴壁细胞洗脱,用0.5%的胰酶消化贴壁细胞,以FITC-反义-人-CD14标记,流式细胞术检测鉴定单核细胞阳性率约80%。调整细胞密度为1×109cells/L,并接种于6孔培养板,每孔1 mL。
2.2细胞分组处理 实验分为3组进行。CRP量效组:将CRP 5、25、50、100 mg/L,分别与CD14+单核细胞孵育24 h,空白对照不加任何试剂,阳性对照加入LPS 10 mg/L。CRP时效组:将CRP 50 mg/L分别与CD14+单核细胞孵育6、12、24、48 h。TLR4阻断剂干预组:将PE anti-human TLR4配成5 mg/L、20 mg/L和30 mg/L 3个浓度分别与CD14+单核细胞孵育2 h,再加入CRP 50 mg/L孵育24 h。
2.3流式细胞仪检测CD14+单核细胞上TLR4蛋白表达 收集不同处理的单核细胞400 μL,PBS缓冲液冲洗2次,加APC anti-human CD14 20μL及PE anti-human Toll-like receptor 4 20 μL,室温避光孵育15 min,PBS缓冲液冲洗2次后,500 μL PBS缓冲液重悬,移入测定管。阴性对照标本不加以上单克隆抗体,而加入PE mouse IgG2a K isotype control。流式细胞仪收集细胞10 000个,检测TLR4蛋白表达的阳性率。
2.4RT-PCR测定CD14+单核细胞TLR4 mRNA及髓样分化蛋白2(myeloid differentiation protein 2,MD-2) mRNA的表达 分别收集每孔细胞,1 500 r/min离心10 min,去上清。每管加入1 mL Trizol,按照 Trizol说明书提取各组细胞的总 RNA后,1%的琼脂糖凝胶电泳鉴定 RNA的完整性,微量分光光度计检测 RNA的纯度及含量,而后在 37 ℃、Olig (dt) 作为引物,将 RNA逆转录为 cDNA, cDNA逆转录按试剂盒说明书进行。PCR引物设计参考文献,由上海英骏公司合成。TLR4正义序列为5’-AGATGGGGCATATCAGAGC3’,反义序列为5’-CCAGAACCAAACGATGGAC-3’,产物长度500 bp;MD-2正义序列为5’-ATTGGGTCTGCAACTCATCC-3’,反义序列为5’-ATTGGGTCTGCAACTCATCC-3’,产物长度234 bp;内参照β-actin正义序列为5’-GCTCGTCGTCGACAACGGCTC-3’,反义序列为5’-CAAACATGATCTGGGTCATCTTCTC-3’,产物长度359 bp。
PCR扩增条件为:94 ℃预变性5 min,94 ℃ 45 s,58 ℃退火30 s,72 ℃延伸30 s,共 35个循环,最后72 ℃10 min。产物用2%的琼脂糖胶进行检测。用数码凝胶图像分析系统作条带密度扫描,结果以目的条带与对应的β-actin吸光度值表示。
2.5荧光定量PCR 用上述逆转录的cDNA为模板,使用SYBR®Green I嵌合荧光法,按试剂盒进行操作。95 ℃ 30 s 预变性后, 95 ℃ 30 s, 60 ℃ 31 s, 40个循环,最后95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s溶解。根据2-△△Ct值计算mRNA表达的相对量。以甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参照,正义链为5’-AGGGCTGCTTTTAACTCTGGTAAA-3’,反义链为5’-CATATTGGAACATGTAAACCATGTAGTTG-3’,产物大小91 bp。
2.6ELISA检测 细胞经分组处理培养后收集上清液,步骤严格按照试剂盒操作说明进行,分别检测细胞上清液中肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素 6(interleuki 6,IL-6)、金属蛋白酶 9(matrix metalloproteinase 9,MMP-9)水平。
3统计学处理
结 果
1CRP诱导人外周血CD14+单核细胞TLR4蛋白的表达
采用流式细胞术检测CD14+单核细胞经不同浓度、不同时间的CRP刺激后细胞表面TLR4表达变化。CD14+单核细胞在CRP浓度为5、25、50、100 mg/L培养24 h,细胞表面TLR4蛋白表达分别为(32.22±2.80)%、(49.94±5.58)%、(74.82±3.24)%和(90.82±2.88)%。当细胞在5 mg/L CRP培养24 h后,TLR4阳性细胞数开始增加,随着CRP浓度的增加,TLR4阳性细胞呈现增长趋势,并在CRP 100 mg/L时,TLR4阳性细胞百分比达到高峰。阳性对照组LPS 10 mg/L组为(98.91±0.74)%,P<0.01,见图1。当单核细胞在CRP 50 mg/L刺激下,随着孵育时间的增加, TLR4阳性细胞百分比逐渐增加,24 h时TLR4表达达高峰[(81.71±2.92)%]后,TLR4表达缓慢下降,48 h时TLR4阳性细胞百分比为(50.57±3.34)%,P<0.01,见图2。

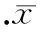
图1不同剂量CRP对CD14+单核细胞表达TLR4蛋白的影响
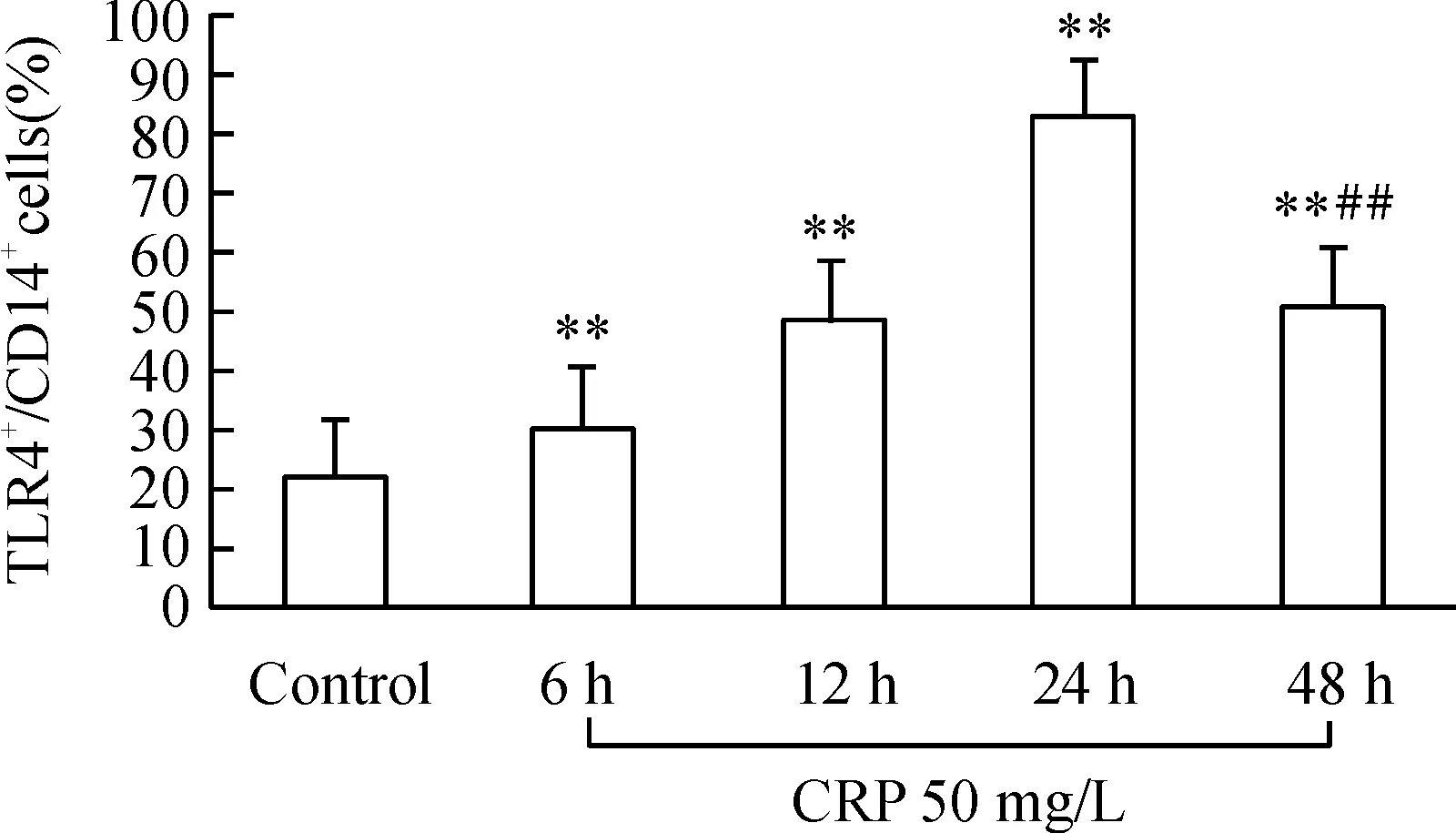
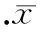
图250mg/LCRP不同时间刺激CD14+单核细胞后TLR4的表达
2CRP对外周血CD14+单核细胞TLR4及MD-2mRNA表达的影响
采用荧光定量PCR技术检测细胞内TLR4和MD-2 mRNA表达,经过GAPDH标准化后,单核细胞分别在CRP浓度为5、25、50、100 mg/L培养24 h,TLR4 mRNA表达增加达159%、211%、320%和390%,MD-2 mRNA表达增加达146%、236%、311%和416%。单核细胞在CRP 50 mg/L培养6、12、24、48h,TLR4 mRNA表达增加162%、264%、354%和208%,MD-2 mRNA表达增长147%、241%、311%和190%。TLR4及MD-2 mRNA在CRP 50 mg/L孵育24 h时达高峰,之后逐渐降低,P<0.01,见图3、4。

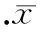
图3不同剂量CRP对CD14+单核细胞表达TLR4及MD-2mRNA的影响
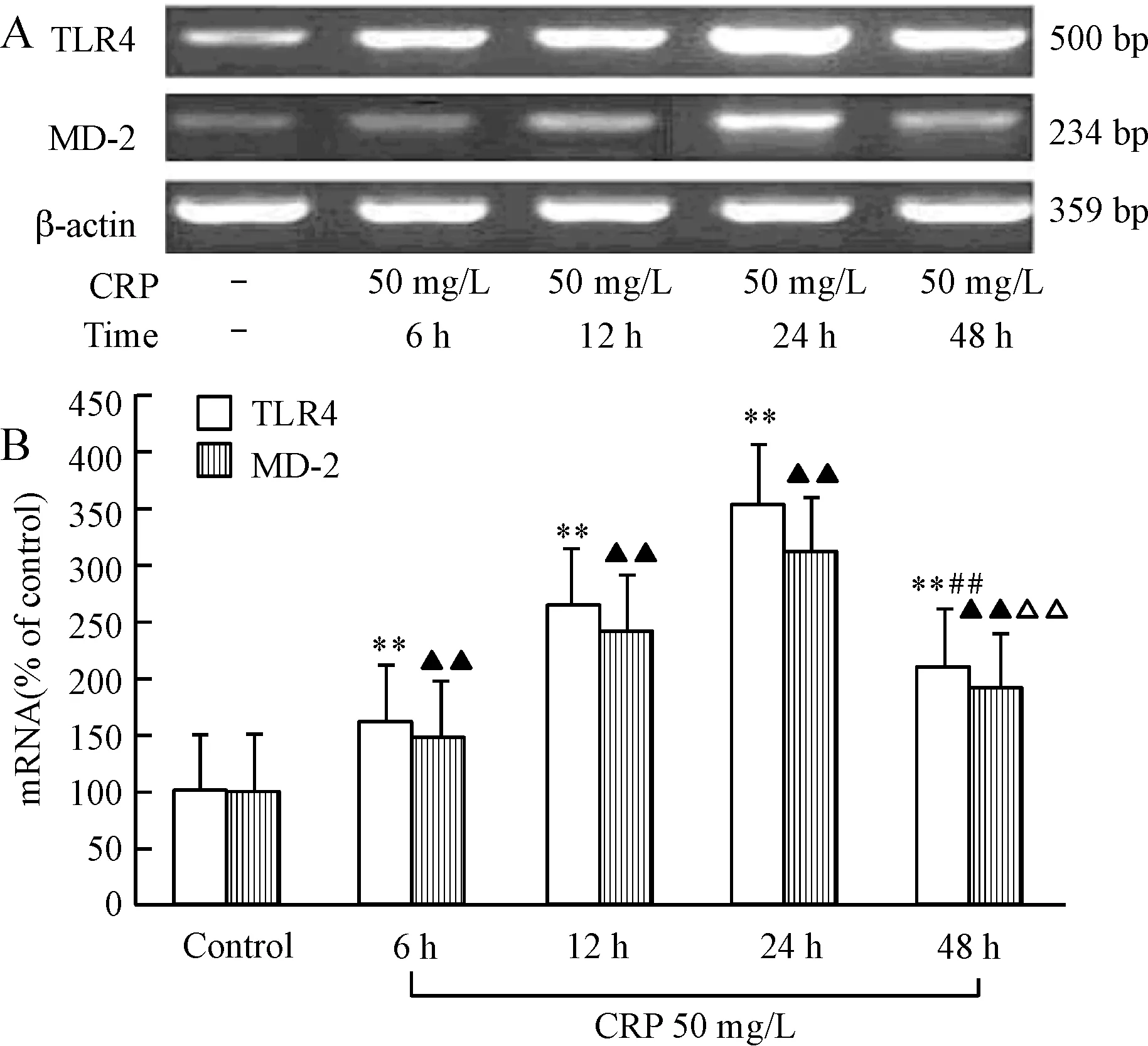
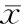
图4不同时间CRP对CD14+单核细胞表达TLR4及MD-2mRNA的影响
3细胞上清液中TNF-α、IL-6、MMP-9的变化
ELISA法测定不同浓度CRP刺激CD14+单核细胞后TNF-α、IL-6和MMP-9的结果见表1。随着CRP浓度的增加,单核细胞分泌TNF-α、IL-6和MMP-9含量逐渐增加,当CRP 100 mg/L时,TNF-α、IL-6和MMP-9含量均较空白对照组升高,差异显著(P<0.01);而作为阳性对照组,单核细胞经LPS 10 mg/L刺激后,TNF-α、IL-6和MMP-9含量分别增加10.1倍、31.5倍和5.1倍,见表1。
观察50 mg/L CRP通过不同时间刺激CD14+单核细胞发现:IL-6、TNF-α和MMP-9表达量均受CRP孵育时间延长而增加,IL-6于48 h达峰值;而 TNF-α和MMP-9峰值出现在24 h,较空白对照组分别增加8.1倍和2.8倍,然而继续孵育至48 h时,两者表达有所下降,见表2。
为了解CRP刺激TNF-α、IL-6和MMP-9表达是否受TLR4信号转导的影响,采用不同浓度TLR4抑制剂与50 mg/L CRP共孵育CD14+单核细胞。与50 mg/L CRP刺激而未加TLR4抑制剂的单核细胞相比,当TLR4抑制剂浓度为20 mg/L时,单核细胞分泌TNF-α、IL-6和MMP-9开始显著减少(均P<0.01);当TLR4抑制剂浓度为30 mg/L时,TNF-α、IL-6和MMP-9含量分别减少88.9%、89.1%和74.4%,见表3。

表1 不同浓度CRP刺激CD14+单核细胞后TNF-α、IL-6和MMP-9的变化
**P<0.01vscontrol.
表250mg/LCRP不同时间刺激CD14+单核细胞后TNF-α、IL-6和MMP-9的变化


CRP50mg/L0h6h12h24h48hTNF-α(ng/L)12.8±2.432.6±3.3**60.5±0.9**98.3±8.3**86.5±2.9**IL-6(ng/L)107.4±30.0172.0±45.4**312.0±32.7**511.3±76.2**511.8±46.5**MMP-9(μg/L)141±12193±12314±14**406±30**360±18**
**P<0.01vs0 h.
表3TLR4抑制剂对50mg/LCRP刺激CD14+单核细胞后TNF-α、IL-6和MMP-9的影响


TLR4inhibitor(mg/L)052030TNF-α(ng/L)96.1±6.080.5±7.933.9±3.2**10.6±2.7**IL-6(ng/L)537.6±26.2433.8±18.2173.8±59.6**58.5±25.0**MMP-9(μg/L)466±45362±28210±23**119±38**
**P<0.01vs0 mg/L TLR4 inhibitor.
讨 论
炎症贯穿动脉粥样硬化过程的始终。易损斑块与斑块破裂、继发血栓形成是ACS主要的发病机制[6]。活动性炎症为判断易损斑块的主要标准之一[4]。各种危险因素引起斑块局部炎症,巨噬细胞浸润、吞噬脂质形成泡沫细胞引起脂质核心的扩大[7];炎症因子刺激单核/巨噬细胞分泌大量的MMP-9,降解纤维帽内胶原,导致纤维帽变薄,斑块极不稳定、容易破裂而引起急性冠脉事件的发生[8]。
TLR是一类介导天然免疫的跨膜信号转导受体家族,其信号转导可以通过核因子кB(NF-кB)激活细胞因子基因转录,是炎症信号传递的门户蛋白,在免疫防御反应中起重要作用。近年研究发现,不稳定型心绞痛和急性心肌梗死患者外周血单核细胞TLR4表达及其下游信号的转导显著高于正常人和稳定型心绞痛[9],且在动脉粥样硬化斑块中巨噬细胞和内皮细胞上TLR4表达增加,氧化低密度脂蛋白(ox-LDL)能上调巨噬细胞TLR4的表达[10]。LPS是TLR4外源性配体[11],在MD-2协助下与TLR4结合,通过髓样分化因子88(MyD88)介导下游的信号转导,激活NF-κB,诱导细胞因子及前炎症因子如TNF-α、IL-6的产生。MD-2是结合在TLR4胞外区的一种髓样分化蛋白,它直接与LPS结合而将LPS信号传至TLR4,可增强单核细胞经TLR4对LPS的反应,实现LPS信号的胞内转导。王红艳等[12]研究表明TLR4经LPS激动后,可增加单核细胞及内皮细胞上黏附因子氧化低密度脂蛋白受体(LOX-1)的表达,介导ox- LDL促动脉粥样硬化作用。以上证据说明TLR4介导的免疫反应在动脉粥样硬化发生发展中起重要作用。因此,寻找TLR4内源性配体,以及阻断TLR4介导的信号转导则显得尤为重要。
Tanaka等[13]报道高敏C反应蛋白(hs-CRP)水平与斑块破裂数目呈正相关,提出CRP在斑块破裂及继发血栓的形成中起关键作用。大剂量的CRP能抑制过氧化物酶体增生物激活受体(peroxisome proliferator-activated receptors,PPARs)[14],此受体具有抗血管炎症反应的作用,促进胆固醇逆向转运,升高循环中的高密度脂蛋白(HDL)水平,反映出CRP在动脉粥样硬化斑块形成过程的重要作用。Nomoto等[15]研究发现,hs-CRP水平在ACS组较稳定型心绞痛和对照组显著增高(分别为44.5 mg/L、2.1 mg/L和0.6 mg/L)。Pasceri等[16]用CRP 10 mg/L处理培养的主动脉内皮细胞24 h后,细胞间黏附分子(ICAM-1),血管细胞黏附因子(VCAM-1)及E-选择素表达增加,从而证实在动脉粥样硬化斑块形成过程中,CRP浓度的增加可促进巨噬细胞和T细胞向血管壁迁移。
研究发现CPR能以剂量依赖性增加肺动脉平滑肌上NF-κB 表达,而NF-κB 作为TLR4信号转导的媒介因子,势必将会引起TLR4信号通路激活[17]。我们的研究直接证明:CRP可剂量依赖和时间依赖地诱导CD14+单核细胞表达TLR4和MD-2。CRP在浓度为5 mg/L时,即对TLR4表现出一定的促进作用,随着剂量增加效应增强,100 mg/L时达最大效应。CRP 50 mg/L在作用24 h时达峰值,随后逐渐下降,我们推测由于CRP的半衰期为19 h,CRP逐渐降解或被受体介导清除,其诱导TLR4表达的作用降低。
TNF-α、IL-6是重要的炎症细胞因子,与机体的免疫炎症反应关系密切,均参与动脉粥样硬化的发生、发展。我们的研究证明:外周血单核细胞在不同浓度CRP蛋白刺激24h后,TNF-α、IL-6在CRP浓度为5 mg/L时便随之升高,并在CRP达100 mg/L 时分别增加8.37倍和19.9倍。在50 mg/L CRP条件下培养6 h、12 h、24 h和48 h,TNF-α于24 h内均随着培养时间越长,表达量越高,而在48 h时,表达量降低;而IL-6在48 h达到峰值。应用TLR4特异性阻断剂后,TNF-α、IL-6表达量则显著减少,甚至降至基础水平。由此可见,CRP可以通过上调TLR4的表达,激活TLR4介导的固有免疫,促进炎症细胞因子基因的表达,促进ACS发生及发展。
CRP还能通过TLR4信号传导途径呈剂量和时间依赖性增加MMP-9的释放,MMP-9在受CRP 25 mg/L刺激时逐渐升高,当CRP浓度增加到50 mg/L以上时,MMP-9增加非常显著;在50 mg/L CRP浓度下培养6 h、12 h、24 h后,MMP-9均随着培养时间越长,表达量越高,但培养48 h,MMP-9水平反而呈下降趋势。Inokubo等[18]、刘金来等[19]均有研究结果证实:ACS患者MMP-9血浆水平较正常对照组显著升高。MMP-9是动脉粥样硬化斑块内巨噬细胞分泌的主要基质金属蛋白酶,可以降解粥样斑块内细胞外各型胶原及明胶,是动脉粥样硬化形成和粥样斑块破裂的重要促进因素。
总之,我们的研究证实:CRP能激活正常人单核细胞TLR4信号转导途径,并诱导TNF-α、IL-6及MMP-9的产生,提示CRP可作为病原相关分子模式(PAMP),通过TLR4模式受体介导而产生炎症反应,在易损斑块形成和发展过程中起重要作用,从而促进ACS的进展。
[1] Paffen E, deMaat MP. C-reactive protein in atherosclerosis: a causal factor [J].Cardiovasc Res, 2006, 71(1): 30-39.
[2] Cermak J, Key NS, Bach RR, et al. C-reactive protein induces human peripheral blood monocytes to synthesize tissue factor[J]. Blood, 1993, 82(2): 513-520.
[3] Williams TN, Zhang CX, Game BA, et al. C-reactive protein stimulates MMP-1 expression in U937 histocytes through FcγRII and extracellular signal-regulated kinase pathway: an implication of CRP involvement in plaque destabilization[J]. Arterioscler Thromb Vasc Biol, 2004, 24(1): 61-66.
[4] Naghavi M, Libby P, Falk E, et al. From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part I[J]. Circulation, 2003, 108(14): 1664-1672.
[5] Akashi S, Shimazu R, Ogata H, et al. Cutting edge: cell surface expression and lipopolysaccharide signaling via the Toll- like receptor 4- MD-2 complex on mouse peritoneal macrophages[J]. J Immunol, 2000, 164(7): 3471-3475.
[6] Fuster V. Elucidation of the role of plaque instability and rupture in acute coronary events[J]. Am J Cardiol, 1995, 76(9): 24C-33C.
[7] Falk E, Shah PK, Fuster V. Coronary plaque disruption[J]. Circulation,1995,92(3):657-671.
[8] Loftus IM, Naylor AR, Goodall S. Increased matrix metalloproteinase 9 activity in unstable carotid plaques. A potential role in acute plaque disruption[J]. Stroke, 2000, 31(1):40-47.
[9] Methe H, Kim JO, Kofler S, et al. Expansion of circulating Toll-like receptor 4-positive monocytes in patients with acute coronary syndrome[J]. Circulation, 2005, 111(20):2654-2661.
[10]Xu XH, Shah PK, Faure E, et al. Toll-like receptor-4 is expressed in murine and human lipidrich atherosclerotic plaques and up regulated by oxidized LDL[J]. Circulation, 2001, 104(25): 3103-3108.
[11]Hoshino K, Takeuchi O, Kawai T, et al. Cutting edge: Toll-like receptor 4(TLR4)-deficient mice are hyporesponsive to lipopolysaccharide: evidence for TLR4 as the LPS gene product[J]. J Immunol, 1999, 162(7): 3749-3752.
[12]王红艳,曲 鹏,于志宏,等. TLR4激动对内皮细胞黏附功能的影响及阿托伐他汀的干预研究[J].中国病理生理杂志, 2006, 22(8): 1514-1518.
[13]Tanaka A, Shimada K, Sano T, et al. Multiple plaque rupture and C-reactive protein in acute myocardial infarction[J]. J Am Coll Cardiol, 2005, 45(10): 1594-1599.
[14]Mahajan N, Dhawan V.Invitromodulation of peroxisome proliferator-activated receptor-gamma and its genes by C-reactive protein. Role of atorvastatin[J]. Arch Med Res,2010, 41(3): 154-161.
[15]Nomoto K,Oguchi S,Watanabe I,et al. Involvement of inflammation in acute coronary syndromes assessed by levels of high-sensitivity C-reactive protein, matrix metalloproteinase-9 and soluble vascular cell adhesion molecule-1[J]. J Cardiol, 2003, 42(5): 201-206.
[16]Pasceri V, Cheng JS, Willerson JT, et al. Modulation of C-reactive protein-mediated monocyte chemoattractant protein-1 induction in human endothelial cells by antiatherosclerosis drugs[J]. Circulation, 2001, 103(21): 2531-2534.
[17]Li J, Li JJ, He JG, et al. Atorvastatin decreases C-reactive protein-induced inflammatory response in pulmonary artery smooth muscle cells by inhibiting nuclear factor-κB pathway[J]. Cardiovasc Ther, 2010, 28(1): 8-14.
[18]Inokubo Y, Hanada H, Ishizaka H, et al. Plasma levels of matrix metalloproteinase- 9 and tissue inhibitor metalloproteinase-1 are increased in patients with acute coronary syndrome[J]. Am Heart J, 2001, 141(2): 211-217.
[19]刘金来,关良劲,谢旭晶,等. 急性冠状动脉综合征患者血浆基质金属蛋白酶及其抑制因子的变化[J]. 中国病理生理杂志, 2004, 20(10): 1921-1922.
EffectsofC-reactiveproteinonsignaltransductionofToll-likereceptor4inCD14+monocytes
PENG Long, LUO Yan-ting, LIU Jin-lai
(DepartmentofCardiology,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:lj.lai@medmail.com.cn)
AIM: To observe the influence of C-reactive protein (CRP) on Toll-like receptor 4 (TLR4) expression in CD14+monocytes, and to investigate the role of CRP in the inflammatory mechanism of acute coronary syndrome (ACS).METHODSMonocytes were isolated from peripheral blood of healthy volunteers by Ficoll density gradient centrifugation. The cells were stimulated with CRP at different doses (5, 25, 50, 100 mg/L) and different exposure time (6 h, 12 h, 24 h or 48 h). TLR4 inhibitor at different doses was co-incubated with the cells in the presence of CRP. The protein expression of TLR4 was measured by flow cytometry, and the mRNA expression of TLR4 and MD-2 was determined by quantitative real-time reverse transcription-polymerase chain reaction (qRT-PCR). The levels of tumor necrosis factor α(TNF-α), interleukin 6(IL-6) and matrix metalloproteinase 9(MMP-9) in the supernatants of cultured medium were measured by ELISA.RESULTSCRP increased the proteins of TLR4 and MD-2 in CD14+monocytes in dose-dependent and time-dependent manners. TLR4 inhibitor at high dose completely blocked the up-regulation of TLR4 and MD-2 induced by CRP. The same changes were found in the levels of TNF-α, IL-6 and MMP-9.CONCLUSIONCRP activates the signal transduction of TLR4 on CD14+monocytes, and induces the production of TNF-α, IL-6 and MMP-9, indicating that CRP may be as a pathogen associated molecular pattern (PAMP) to induce the inflammatory response via TLR4, and may contribute to the plaque vulnerability in atherosclerosis.
C-reactive protein; Receptors,Toll-like; Monocytes; Acute coronary syndrome
R363
A
10.3969/j.issn.1000-4718.2011.01.011
1000-4718(2011)01-0056-06
2010-08-06
2010-10-21
广东省自然科学基金资助项目(No.07001556)
△通讯作者 Tel:020-85252168;E-mail:lj.lai@medmail.com.cn

