c-Jun氨基末端激酶在脑缺血再灌注损伤中的作用*
刘莎莎, 高维娟
(承德医学院病理生理学教研室,河北 承德 067000)
c-Jun氨基末端激酶在脑缺血再灌注损伤中的作用*
刘莎莎, 高维娟△
(承德医学院病理生理学教研室,河北 承德 067000)
在生物体内,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是信号从细胞表面转导至细胞核内部的重要传递者,是一类丝/苏氨酸残基的蛋白激酶。目前在真核生物细胞中,已明确了4条MAPK信号转导通路[1],即细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinases,ERK)通路、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路、p38通路及ERK5通路。JNK信号通路作为MAPK信号通路中重要的通路之一,参与了多种生理、病理过程,目前诸多研究表明其在脑缺血/再灌注损伤过程中尤其是程序性细胞死亡过程中起着重要的调控作用[2],本文就近年来对JNK通路的研究及JNK在脑缺血再灌注诱导的细胞凋亡中的作用及机制作一综述。
1 JNK信号通路概述
1.1JNK及编码JNK的基因 JNKs家族是1990年发现的MAPKs家族成员之一,属于进化上保守的丝氨酸/苏氨酸蛋白激酶。在脊椎动物,编码JNK的基因包括jnk1、jnk2和jnk3[3,4],其相应的编码产物JNK1和JNK2在各种组织细胞中广泛表达,而JNK3则仅在脑、心脏、睾丸等组织中表达[5]。这3种JNK基因都能编码46 kD和54 kD 2种蛋白产物[6],它们通过不同的剪接及不同的外显子形成了10种不同的JNK剪接变体,这10种不同的剪接变体亚型均含有“Thr-Pro-Tyr (TPY)”这一特征性模块结构[7]。
1.2JNK的上游激活物和下游分子 JNK通路作为 MAPK信号通路之一也符合多级蛋白激酶的级联反应,其中包括3种关键的激酶:MAPK、MAPK的激酶(MAPKK)和MAPK激酶的激酶(MAPKKK)。MAPKKK对MAPKK的丝氨酸、苏氨酸双位点磷酸化而将其活化;进而MAPKK对MAPK进行丝氨酸、苏氨酸双位点磷酸化活化[8]。JNK的上游激酶是MKK4和MKK7。目前发现的MAPKKK至少有20种,其中至少有14种能够激活MKK4/MKK7-JNK/MAPK通路[3],主要包括MAPK/ERK激酶的激酶(MEKK1、2、3、4)、凋亡信号调节激酶(apoptosis signal-regulating kinases, ASK)、混合连接激酶(mixed lineage kinase, MLKs)和TGF-β激活的蛋白激酶(TGF-β-activated protein kinases, TAK)等。JNK最初被发现是一种特异性磷酸化核内转录因子c-Jun的激酶,并因此被命名为c-Jun氨基末端激酶,随后发现其它一些核内转录因子如Ets-like protein 1 (Elk-1)、激活转录因子2 (activating transcription factor 2,ATF2)、DPC4、激活T细胞核因子(nuclear factor of activated T cells,NFAT4)以及ets-2等也是其下游底物,但一直对JNK的胞浆底物知之甚少。近年来一些研究显示胞浆中的某些成分(如细胞骨架蛋白)可能也是其作用底物。此外,He等[9]研究还发现角蛋白8及角蛋白18分子上均含有c-Jun、ATF-2等分子上决定JNK作用特异性和效率的特定锚着点,免疫共沉淀实验也表明JNK能够与角蛋白8/18直接结合,因此角蛋白8/18是一个新的JNK胞浆靶分子。此类JNK胞浆底物的发现具有重要的病理生理意义,它表明JNK信号通路的激活不仅具有调节核内基因表达的作用,还可能通过影响胞浆底物分子的结构与功能而直接、迅速地发挥其生物学效应。
1.3JNK信号通路的激活 JNK信号通路可被应激刺激(如紫外线、热休克、高渗、缺血再灌注等)、细胞因子(TNF-α、IL-1)、表皮生长因子(epidermal growth factor,EGF)及某些G蛋白偶联受体激活。细胞外刺激可通过Ras依赖或非Ras依赖的2条途径激活JNK;小分子G蛋白Ras超家族的成员之一Rho可能也是JNK激活的上游信号[10]。Rho蛋白Rac可能是与p21激活的丝/苏氨酸激酶(p21-activating kinase,PAK)结合,使其自身磷酸化而被激活,活化的PAK进一步使JNK激活。激活的JNK经过核转位,可激活核内转录因子如c-Jun、Jun-B、Elk-1、DPC4等,再调节转录因子的靶基因如及早基因、后期效应基因和热休克基因等的表达,促进有关蛋白的合成和通道的改变,完成对细胞外刺激的反应。
2 JNK信号通路在脑缺血再灌注损伤中的作用
2.1JNK与神经细胞凋亡的关系及相关机制 在大鼠嗜铬细胞瘤PC-12的培养过程中,去除神经生长因子(nerve growth factor, NGF),JNK和p38持续激活,ERKs的活性被抑制,PC-12细胞发生凋亡。而用反义转染特异地抑制JNK和p38的激活,可阻止细胞凋亡的发生,从而在神经元中首次发现了JNK的促凋亡作用[11]。另外敲除jnk3基因的小鼠能抵抗兴奋毒性谷氨酸受体激动剂红藻氨酸(kainic acid)诱导的癫痫发作反应和海马神经元兴奋毒性凋亡,同时伴有c-Jun磷酸化和转录激活蛋白(activator protein-1,AP-1)转录活性的明显减低,也说明JNK信号通路参与了细胞凋亡。
近期,诸多动物模型的研究也证实了JNK信号通路参与了脑缺血再灌注后的神经细胞凋亡,并对JNK通路介导细胞凋亡的相关机制进行了探讨。脑缺血再灌注后神经元凋亡是一个极其复杂的过程,细胞凋亡的内源性路径(又称线粒体凋亡途径)和外源性路径(又称死亡受体途径)均参与了脑缺血后神经元的凋亡过程。JNK信号通路通过调控线粒体途径和死亡受体途径在脑缺血再灌注损伤引起的细胞凋亡中起重要作用[12],见图1。(1)线粒体途径: 脑缺血再灌注期间应激反应、缺血缺氧、自由基、兴奋性氨基酸以及钙超载等多种刺激因素可激活JNK通路的关键激酶,即MAPK/ERK激酶类的MKK4、MKK7和MAPK/ERK激酶的激酶类的MEKK1、2、3、4。最终导致JNK三肽区的酪氨酸与苏氨酸双磷酸化,从而使其活化并转移到细胞核[13]。激活的JNK通过刺激其下游底物改变线粒体通透性转换孔(permeability transition pore,PTP)的通透性,促使细胞色素C(cytochrome C, Cyt C)释放入胞浆,Cyt C由线粒体释放出后,与胞浆的凋亡蛋白酶激活因子1(apoptotic protease-activating factor-1, Apaf-1)以及caspase-9前体(pro-caspase-9)结合,在ATP存在条件下形成“凋亡体”复合物(Cyt C+Apaf-1+pro-caspase-9),并由此激活caspase-9[14],活性caspase-9裂解并激活caspase-3,caspase-3激活后一方面直接作为蛋白酶直接降解底物,另一方面激活其它的caspase蛋白酶类,如caspase-6、caspase-7等,共同参与底物的降解,它们是凋亡的直接执行者。细胞凋亡的特征性形态学变化,如染色体凝聚和DNA片段化等,均与caspase-3的降解作用直接相关[15]。Okuno等[16]利用大鼠大脑中动脉闭塞(middle cerebral artery occulsion,MCAO)模型,检测到脑缺血后60 min MCA区JNK活性及磷酸化的JNK增加;通过TUNEL 染色及凋亡相关DNA 片段分析,发现JNK特异性抑制剂SP600125可阻断细胞凋亡因子Bax从胞浆转入线粒体,并进一步探讨,推测JNK是通过刺激其可能的下游底物BimL,从而将信号转到Bax,Bax可引起线粒体通透性改变,释放Cyt C,释放的Cyt C和胞浆蛋白Apaf-1结合,引起Apaf-1寡聚,激活caspase-9,进一步激活caspase-3,最终导致细胞凋亡。(2)死亡受体途径:外源性凋亡路径与细胞表面死亡受体激活有关,也称为死亡受体路径。细胞表面死亡受体属于TNF受体家族,包括TNF受体-1(tumor necrosis factor receptor-1,TNFR-1)、Fas受体和p75神经营养素受体(p75 neurotrophin receptor,p75NTR)。JNK通过磷酸化c-Jun和ATF-2激活转录因子AP-1(AP-1是Jun-Jun、Jun-Fos或Jun-ATF的二聚体)[17],从而进一步促进多种促凋亡蛋白的表达,如p53、Bax、FasL、TNF等。例如,Fas配体与Fas受体结合,这一结合触发了胞内Fas相关性受体蛋白死亡结构域(Fas -associated death domain protein,FADD)的募集。FADD的N末端包含有死亡效应区域,能与caspase-8前体的死亡效应区域结合,从而形成“FasL Fas FADD procaspase-8”复合结构,这一复合结构被认为是死亡诱导信号复合物,能催化caspase-8前体反式激活,导致自身裂解,形成并释放活性caspase-8[18]。活性caspase-8从复合物中释放出来进入胞浆,其既可以直接裂解激活下游的caspase-3,也可间接方式通过线粒体依赖性机制激活caspase-3,最终导致凋亡。
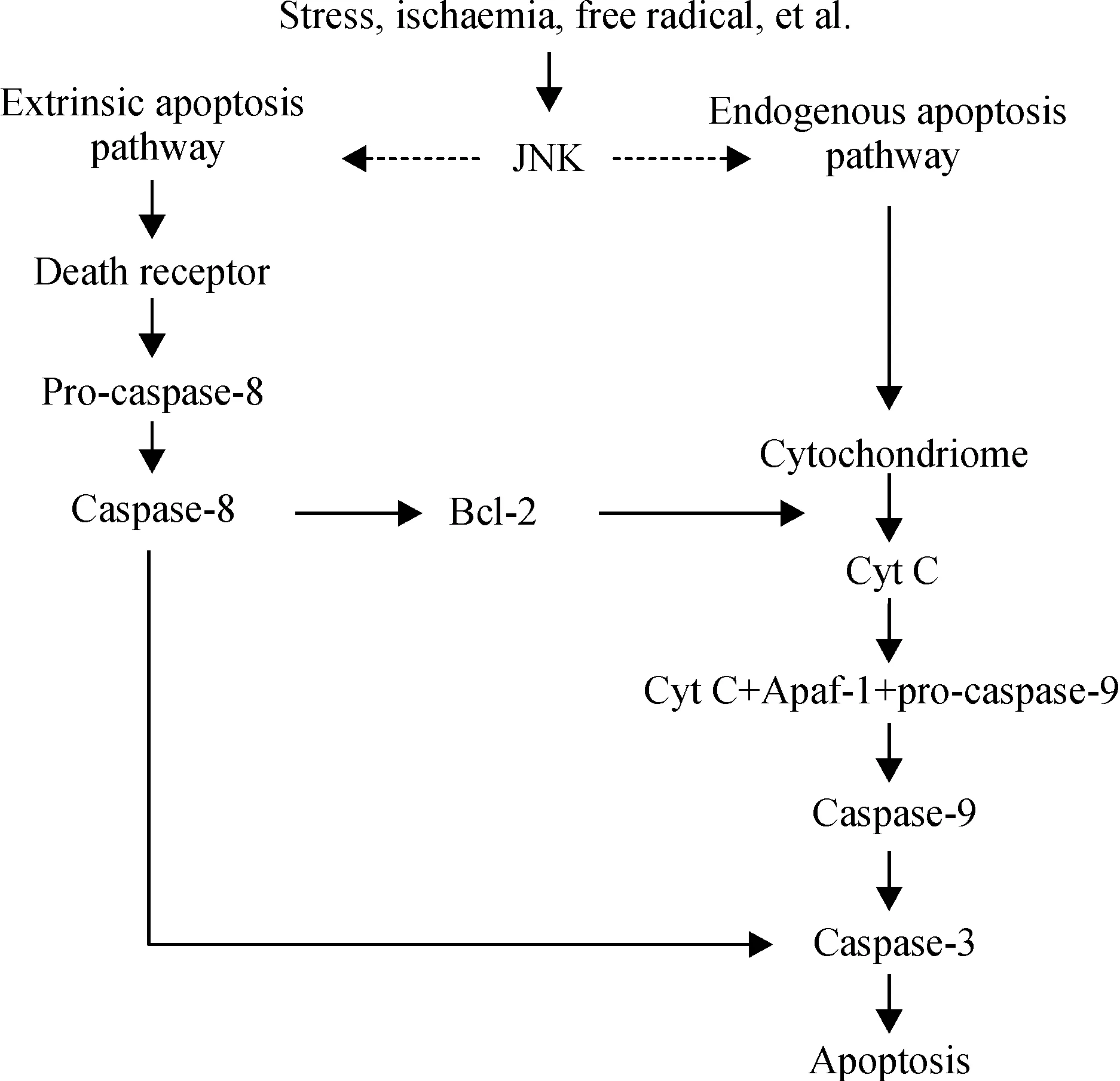
Figure 1. Mechanism of JNK-mediated neuronal apoptosis in brain ischemia reperfusion injury.Different extracellular stimuli can activate the JNK signalling pathway.The activated JNK mediates neuronal apoptosis in cerebral ischemia/reperfusion-induced brain injury through controlling both the death receptor pathway and the mitochondrial-dependent pathway.
图1JNK介导脑缺血再灌注后细胞凋亡机制
目前JNK在脑缺血再灌注过程中是否参与损伤DNA的修复功能越来越受到人们的关注。最近研究发现[19]建立大鼠全脑缺血再灌注模型后,脑缺血区p-JNK表达上调,DNA修复蛋白XRCC1和Ku70 表达下调, JNK抑制剂SP600125可减少p-JNK的表达,并使XRCC1和Ku70表达上调,减轻了全脑缺血再灌注损伤,DNA的修复功能得到改善,提示JNK可使全脑缺血再灌注大鼠海马神经元DNA修复功能受损,导致细胞凋亡,其机制可能与下调DNA修复蛋白XRCC1和Ku70的表达有关。全脑缺血再灌注时,大量的DNA受到损伤使细胞进入DNA合成期(S期),损伤的DNA开始进行修复,一旦修复失败则导致神经元凋亡。XRCC1 是一种DNA修复蛋白,在碱基切除修复中起整体支架作用,对氧化剂导致的DNA单链断裂和碱基损伤修复起重要作用[20]Ku70是DNA依赖蛋白激酶的催化亚单位,能够启动DNA双链的修复过程。研究表明,XRCC1和Ku70表达下调先于DNA断裂的发生。全脑缺血再灌注大鼠大量DNA断裂与细胞凋亡有关,XRCC1和Ku70表达下调是DNA断裂无法修复的机制之一。然而,JNK下调XRCC1和Ku70表达的具体分子机制仍有待进一步探讨。
2.2JNK与非神经细胞凋亡的关系 在脑缺血再灌注过程中,非神经元性细胞和神经元都处于缺血缺氧的环境中,因而理论上非神经元性细胞和神经元一样也可发生缺血再灌注损伤,包括凋亡和坏死。脑组织中非神经元性细胞包括构成血管的细胞(如血管内皮细胞)、浸润的炎性细胞、神经胶质细胞等。目前大部分的研究并未将缺血后受累脑组织区域可能存在的非神经元性细胞的凋亡从神经元凋亡中区分开来。事实上,已经有越来越多的研究明确了脑缺血后非神经元性细胞凋亡的存在。Lennmyr等[21]在大鼠MCAO模型中采用免疫组化方法发现缺血后活化的JNK未在神经元中表达,仅在损伤侧的动脉血管和胶质细胞中出现,提示JNK可能参与了脑缺血再灌注后的非神经源性细胞凋亡。另有研究报道[22]大鼠大脑中动脉闭塞后星形细胞和小胶质细胞caspase-3和其它多种caspase蛋白水平都上调了。JNK信号通路介导的非神经元性细胞凋亡的研究资料目前仍然较少,其机制是否与神经元细胞凋亡机制一致尚无足够证据,其在脑缺血再灌注后神经系统损伤及预后中的重要性应当逐渐受到重视。
3 总结与展望
大量研究表明JNK信号通路参与了脑缺血再灌注后神经细胞的凋亡,抑制JNK通路可保护神经元免受损伤。但是Yun等[23]报道,JNK通路在抗凋亡过程中起到了重要的作用,其机制与激活蛋白酶活化受体-1(protease-activated receptor-1,PAR-1)从而使神经细胞免受毒素的损伤有关。且最新研究表明[24]脑缺血再灌注后JNK/c-Jun/AP-1通路可引起14-3-3-γ表达上调,而14-3-3 -γ表达上调可抑制脑缺血再灌注引起的神经细胞凋亡,说明JNK信号通路可间接起到神经细胞保护作用。另有研究表明JNK在脑缺血再灌注损伤过程中具有双向作用,缺血早期JNK的激活促进细胞生存,而晚期JNK的激活则导致神经细胞的凋亡。然而诸多实验却仍表明脑缺血再灌注后JNK/c-Jun/AP-1通路的激活与细胞凋亡有关。目前对JNK通路在脑缺血再灌注损伤中到底是起到促凋亡还是抗凋亡作用还存在争议,但毋庸置疑,JNK通路在各种原因引起的脑缺血再灌注损伤机制中起着重要的作用。因此,JNK通路的组成及调节机制为相关疾病的治疗提供了潜在的治疗靶点。
[1] Kim EK, Choi EJ. Pathological roles of MAPK signaling pathways in human diseases[J]. Biochim Biophys Acta, 2010, 1802(4): 396-405.
[2] Kuan CY, Whitmarsh AJ, Yang DD, et al. A critical role of neural specific JNK3 for ischemia apoptosis[J]. Proc Natl Acad Sci USA, 2003, 100(25): 15184-15189.
[3] Johnson GL, Nakamura K. The c-jun kinase / stress-activated pathway: regulation function and role in hunman disease[J]. Biochim Biophys Acta, 2007, 1773(8): 1341-1348.
[4] Bogoyevitch MA. The isform-specific functions of the c-Jun N- terminal kinases (JNKs): differences revealed by gene targeting[J]. Bioessays, 2006, 28(9): 923-934.
[5] Ye DQ, Gao WJ, Yan FX, et al. Astregalus injection inhibits c-Jun N terminal kinase mRNA expression following oxygen-glucose deprivation and reintroduction in rat hippocampal neurons[J]. Neural Regen Res, 2009,4(11):879-884.
[6] Praveen KR, Farzana R, Jack B, et al. Role of the JNK signal transduction pathway in inflammatory bowel disease[J]. World J Gastroenterol, 2008, 14(2): 200-202.
[7] 王 宁,薛荣亮,c-Jun氨基末端激酶(JNKs)与脑缺血性损伤[J].国际麻醉学与复苏杂志,2007, 28(2): 166-169.
[8] 张雅丽,高维娟. c-Jun氨基末端激酶与caspase在细胞凋亡中的作用及相互关系[J].中国病理生理杂志, 2009,25(3): 607-609、613.
[9] He T, Stepulak A, Holmström TH, et al. The intermediate filament protein keratin 8 is a novel cytoplasmic substate for c-Jun N-terminal kinase[J]. J Biol Chem, 2002, 277(13): 10767-10774.
[10]Minden A, Lin A, Claret FX, et al. Selective activation of the JNK signaling cascade and c-Jun transcriptional activity by the small GTPases Rac and Cdc-42Hs[J]. Cell, 1995, 81(7): 1147-1157.
[11]Xia Z, Dickens M, Raingeaud JI, et al. Opposing effects of ERK and JNK-P38 MAP kinases on apoptosis[J]. Science, 1995, 270(5240): 1326-1331.
[12]Elmore S. Apoptosis: a review of programmed cell death[J]. Toxicol Pathol, 2007, 35(4): 495-516.
[13]Verna L, Ganda C, Stemerman MB.Invivolow-density lipoprotein exposure induces intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 correlated with activator protein-1 expression[J]. Arterioscler Thromb Vasl Bid, 2006, 26 (6): 1344-1349.
[14]Love S. Apoptosis and brian ischaemia[J]. Prog Neuropsychopharmacol Biol Psychiatry,2003, 27(2):267-282.
[15]Poter AG, Janicke RU. Emerging roles of caspase-3 in apoptosis[J]. Cell Death Differ, 1999, 6(2): 99-104.
[16]Okuno S, Saito A,Hayashi T, et al. The c-Jun N-terminal protein kinase signaling pathway mediates Bax activation and subsequent neuronal apoptosis through interaction with Bim after transient focal cerebral ischemia[J]. J Neurosci, 2004, 24(36): 7879-7887.
[17]李 勇, 邓小龙, 邵胜敏, 等.c-Jun氨基末端激酶在慢性低O2高CO2大鼠海马损伤中的作用[J].中国病理生理杂志, 2009, 25(5): 914-918.
[18]吉康祥,李 捷,邱彩霞,等.脑缺血后细胞凋亡机制的研究现状[J].中国卒中杂志,2010, 5(1): 66-72.
[19]Wang N, Rong LX, Feng ZY, et al. Neuronal effects of SP600125 pretreatment in a rat model of cerebral ischemia/referfusion injury:inhibited down-regulation f DNA repair protein[J]. Neural Regen Res, 2009, 4(12):1055-1061.
[20]Horton JK, Watson M, Stefanick DF, et al. XRCC1 and DNA polymerase β in cellular protection against cytotoxic DNA single-strand breaks[J]. Cell Res, 2008, 18(1): 48-63.
[21]Lennmyr F, Karlsson S, Gerwins P, et al. Activation of mitogen-activated protein kinases in experimental cerebral ischemia[J]. Acta Neurol Scand, 2002, 106(6): 333-340.
[22]Krupinski J, Lopez E, Marti E, et al. Expression of caspases and their substrates in the rat model of focal cerebral ischemia[J]. Neurobiol Dis, 2000, 7(4):332-342.
[23]Yun H, Kim HS, Lee S, et al. AMP kinase signaling determines whether c-Jun N-terminal kinase promotes survival or apoptosis during glucose deprivation[J]. Carcinogenesis, 2009, 30(3): 529-537.
[24]Dong Y, Liu HD, Zhao R, et al. Ischemia activaties JNK/c-Jun/AP-1 pathway to up-regulate 14-3-3γ in astrocyte[J]. J Neurochem, 2009,109(Suppl 1): 182-188.
Roleofc-JunN-terminalkinaseinbrainischemiareperfusioninjury
LIU Sha-sha, GAO Wei-juan
(DepartmentofPathophysiology,ChengdeMedicalCollege,Chengde067000,China.E-mail:gwj6088@163.com)
c-Jun N-terminal kinase (JNK), a member of the mitogen-activated protein kinase family, is activated in response to a number of extracellular stimuli, including inflammatory cytokines, UV irradiation and ischaemia. A large amount of evidence supports the key role for JNK signaling in stress-induced apoptosis. Recent studies suggest that JNK signaling pathway is involved in neuron death by controlling both the death receptor pathway and the mitochondrial-dependent pathway after transient ischemia. The role of the JNK signaling pathway in brain ischemia reperfusion injury is overviewed in this article.
JNK通路; 信号转导; 脑缺血再灌注; 细胞凋亡
JNK pathway; Signal transduction; Brain ischemia reperfusion; Apoptosis
R363
A
1000-4718(2011)03-0607-04
2010-06-09
2010-10-16
教育部新世纪优秀人才支持计划资助项目(No.NCET-06-0258);河北省自然科学基金重点资助项目(No.C2006000865)
△通讯作者 Tel:0311-85110168;E-mail:gwj6088@163.com
10.3969/j.issn.1000-4718.2011.03.038

