聚苯乙烯树脂催化羟醛缩合研究进展
王结祥,王 强,李云华,陈秉辉
(厦门大学化学化工学院,醇醚酯化工清洁生产国家工程实验室,福建 厦门 361005)
进展与述评
聚苯乙烯树脂催化羟醛缩合研究进展
王结祥,王 强,李云华,陈秉辉
(厦门大学化学化工学院,醇醚酯化工清洁生产国家工程实验室,福建 厦门 361005)
近年来,聚苯乙烯树脂作为重要固体碱催化剂得到了广泛应用和发展。本文在对聚苯乙烯树脂催化羟醛缩合反应研究进展进行较为全面综述的基础上,重点讨论了聚苯乙烯树脂本身性质及其修饰对羟醛缩合反应的影响,并由此展望了未来聚苯乙烯树脂可能的研究方向。
聚苯乙烯;羟醛缩合;聚合物负载
自1935年Adams和Holmes研究合成第一批离子交换树脂——聚酚醛系强酸性阳离子交换树脂和聚苯胺醛系弱碱性阴离子树脂以来,离子交换树脂在离子交换、色层分离和催化方面得到广泛应用。特别是1967年以来,大孔径、大比表面积、高稳定性树脂的出现,使得离子交换树脂不但可用于低分子化合物催化反应,也能用于催化制备高分子[1]。20世纪70年代初,功能性聚苯乙烯相转移催化剂的应用开启了高分子催化有机反应的大门[2-4]。这些催化方面的应用主要得益于交联聚苯乙烯本身相对较高的力学稳定性和化学稳定性以及芳环上相对容易的官能团化[5]。
另一方面,作为绿色化学理念倡导下备受关注的羟醛缩合,在合成精细化工有机中间体中作用尤为突出。特别是2000年,List等[6]以脯氨酸催化羟醛缩合,被视为是有机催化复兴的开始。他指出了有机催化比金属催化优越之处在于无需苛刻的惰性气氛和无水环境,而是在室温溶剂体系下反应;实现了非金属催化小分子缩合反应,减少环境污染等。随后的十年来,聚苯乙烯负载氨基酸[7-11]成为研究最多的羟醛缩合催化剂,它主要以脯氨酸以及少数亮氨酸、组氨酸通过酸碱双功能基团,有效地实现催化剂与底物结合和催化部位的协同作用,将缩合、脱水两步合二为一,大大缩短了反应工序。该反应类似于醛缩酶催化,但却比生物催化更稳定,应用范围更广。而且,聚苯乙烯固载氨基酸水在环境下催化羟醛缩合收率相当于甚至高于其对应的氨基酸单体[12-13]。
1 聚苯乙烯树脂催化羟醛缩合特点
(1)聚苯乙烯树脂因其本身不溶、不熔性质,应用于非均相催化,可简化分离工序,再生重复利用方便,而且较为廉价。应用反应精馏进行羟醛缩合时所用的催化剂大部分为离子交换树脂[14],这反映了树脂的工业应用可行性。然而,树脂受其耐热性、机械强度的影响,在工业上的应用也受到限制。如阳离子交换树脂在200 ℃以上使用时,在短时间内即分解。羟型强碱树脂甚至在100 ℃使用时,短时间内即分解。这是有机离子交换树脂最大的弱点。当然,另一方面,羟醛缩合液相反应温度一般都低于 80 ℃[15-18],这为树脂在该类型反应的应用提供了可能,符合低温、低压、少分离的绿色理念。
(2)胺、二胺盐被广泛地认为是羟醛缩合的有效催化剂[16,19-26],而且在树脂型固体酸碱催化剂的工业应用上,碱催化只占约 8%[21],对碱催化剂的研究更具意义。
(3)催化剂从开始的简单金属、金属氧化物催化到后来的合金负载型、核壳型的无机催化,再到树脂型高分子有机催化及有机无机螯合催化。这种趋势不仅体现了人类在探寻如何摆脱对金属催化的依赖,也在于高分子有机催化本身优势,如形貌、活性位的可控性对催化立体选择性的影响;对溶剂、温度敏感的溶解可调性使其不仅具有均相催化那样的高活性,同时兼具非均相催化的易分离性;不同活性基团的修饰及不同高分子间的共混[27]使其博采众家之长于一身。
基于以上3点及聚苯乙烯、羟醛缩合两方面的典型代表性,本文综述聚苯乙烯树脂在羟醛缩合反应中的应用。
Melvin等[16]认为胺盐弱碱树脂的催化性能类似于氮杂环已烷,而季胺盐强碱树脂则类似于氢氧化物。Alexandratos等[28]用OH型强碱树脂催化醛和硝基甲烷化物生成硝基醇化物这一过程来描述强碱催化缩合机理(图1)。OH-夺取硝基甲烷上的氢,致使亲核基团攻击醛基,OH-得以再生。这种机理被广泛应用于aldol和Knoevenagel缩合。当然,不仅OH-,CN-也能催化苯甲醛生成安息香胶。
Saito等[19]则通过DFT计算弱碱脯氨酸催化丙酮缩合的反应机理。首先是B酸与羰基配位,使氨基自发地进攻羰基形成重要的烯胺中间体。水分子的形成不仅关系着反应的进行,也包含了催化剂的再生问题(图2)。

图1 强碱OH型树脂催化羟醛缩合机理
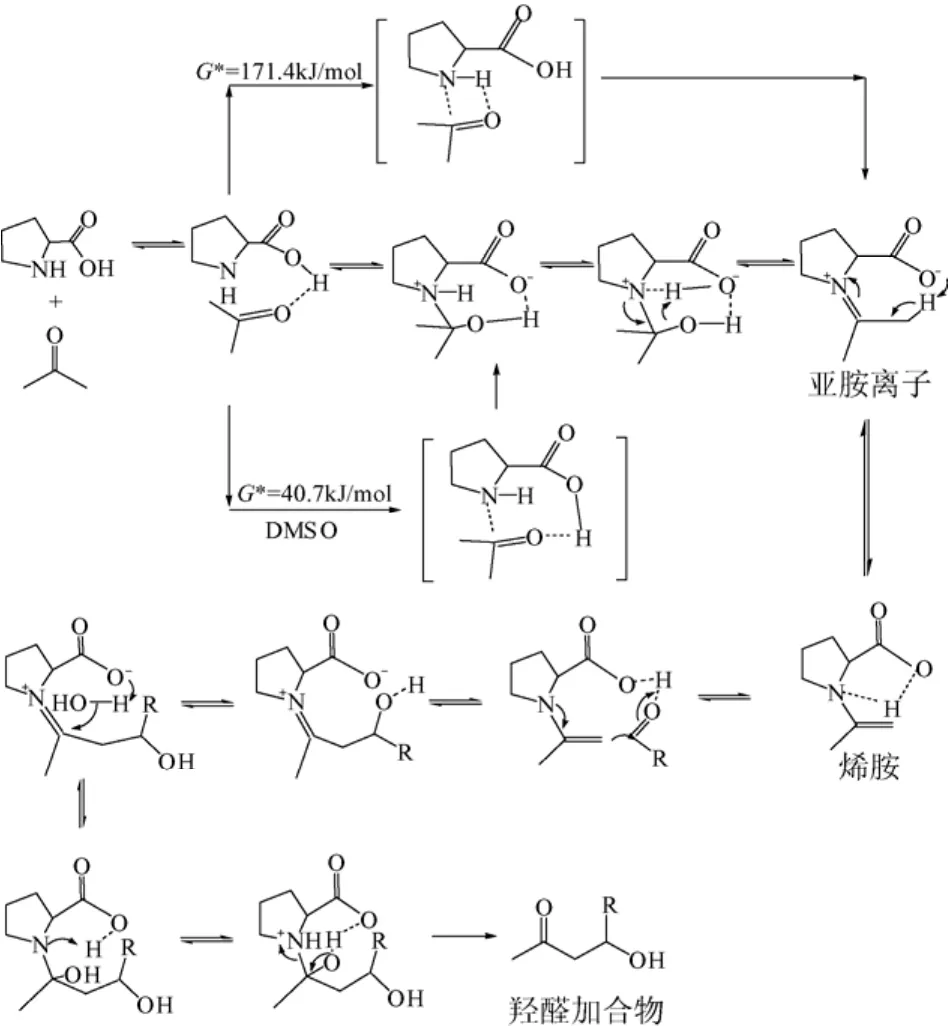
图2 弱碱胺盐催化羟醛缩合机理
2 树脂基本性质对羟醛缩合的影响
影响树脂催化性能的因素很多。Aragon等[29]指出,对于一个给定的树脂,其最重要的参数在于树脂的功能基、使用温度、溶剂的亲和性及孔径大小。
2.1 功能基团
2.1.1 碱强度对催化选择性影响
羟醛缩合产物主要有醇醛化合物和多羟基化合物两类。单独从催化剂碱性考虑而言,弱碱条件有利于醇醛化合物的生成,诸如 Ba(OH)2、叔胺、阴离子树脂[6]。其中最有应用前景的是弱碱性阴离子树脂。欧植泽等[30]以三丁胺胺化强碱性树脂催化合成苯丁烯酮,收率可达98%。胡微等[31]选择强碱性苯乙烯系季铵型树脂催化丙酮与甲醛缩合脱水制甲基乙烯酮,收率达56%。石秀敏等[32]研制筛选出适合于催化蒸馏法制二丙酮醇的大孔型强碱性苯乙烯阴离子树脂。强碱树脂在这些反应中明显优于弱碱,原因可能在于弱碱性氨基树脂拥有诸如间苯二胺这样的结构,只有在氨基质子化的情况下才能进行阴离子交换,这就限制其只能在酸性溶液中使用[28]。而强碱性树脂中季胺基共价键由于存在着氮原子的正电荷,使得不需质子化就能在中性和碱性介质中进行离子交换。
2.1.2 官能团对热稳定性的影响
根据季胺碱的霍夫曼降解规律,其热解产物的结构应该如图3所示。
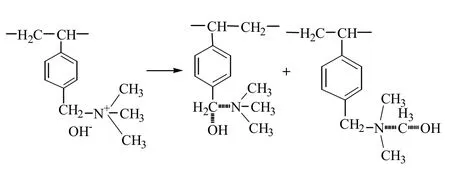
图3 季胺盐树脂热降解
强碱树脂热降解主要通过胺基脱落。范云鸽等[33]指出,化学结构上,各种阴离子型树脂的热稳定性顺序为:(≡NR)Cl>(≡NR)2SO4>(≡N)2CO3> (≡NR)3BO3> (≡N)3SiO3>(≡NR)OH(Ⅰ型)>(≡NR)OH(Ⅱ型)。
提高耐热性的途径有3 条:①改变与季铵氮原子相连的烃基;②改变苯环的电子效应(引入吸电子取代基或供电子取代基),使与苯环相连的亚甲基和氮原子之间的C—N键断裂的活化能升高,而使其稳定;③将苯环与季铵基间的亚甲基变为长链烃基。
肖国林等[34]研究表明,位阻较大的季铵表现出较高的热稳定性;硝化、溴化后的树脂热稳定性有一定改善;但同时苯环上引入吸电子取代基不利于提高碱基在高温下的稳定性。
陈群等[35-36]合成含长碳链间隔臂结构的强碱性树脂,在100℃去离子水中保持720 h交换量仅下降11.83%。王璠等[37]研究了带有醚键结构树脂的合成,相对于常规强碱树脂,它的使用温度可提高20℃左右。另一方面,也可借鉴徐秉声等[38]通过特殊共聚物纯化,引入吸电子基团、磺化、活性基团稳定化等过程增强阳离子树脂耐温性的办法,提高阴离子树脂的热稳定性。
2.2 树脂结构
树脂结构主要包括交联度、孔径、溶剂的影响。
2.2.1 交联度
交联度不仅影响树脂的溶解度,而且影响树脂的力学稳定性、交换容量、含水量和溶胀性能、形态转变时的膨胀度、选择性、化学及抗氧化性能。
树脂的磨损主要由树脂基团的亲水性能引起的溶胀及外力产生的应力引起。对交联度为 6%的强碱性阴离子树脂,由氯型转变为羟型时溶胀压变化为100个大气压(1大气压=101325 Pa)。Rana等[39]通过实验指出交联度和溶剂对溶胀的影响(图4)。对于交联0.3%二乙烯苯(DVB)的树脂,其在氯仿中溶胀可达本身体积的9倍。这种近乎结构破裂的溶胀却大大体现了聚苯乙烯作为载体的优势所在,使活性基团更多地暴露于反应液中,提高活性。
2.2.2 孔径
一般认为孔径影响反应扩散性,进而影响催化活性,体现为大孔树脂在催化反应中比普通凝胶树脂更好。但这并非绝对的。树脂催化反应的进行受扩散控制,但这种控制并不存在于气相反应中,对小分子催化的影响也较小。Serra-Holm等[40]在50~70 ℃应用凝胶型树脂催化缩合甲醛和丁醛反应有高的选择性,其动力学显示催化行为和物理性质在其所研究的树脂中并没有明显的联系。
大孔树脂的另一特性在于对酸碱及氧化作用稳定。当然,它的不足在于基团负载容量小,一般只达到3 mmol/g,这使得催化剂投量大。
2.3 溶剂的影响
Kun等[41]指出,许多催化交联吸附或离子交换都要求溶剂化成液相,以利于离子化及与树脂活性组分相接触。而这种溶剂化程度取决于溶液的极性及官能团吸附于树脂骨架的能力。溶剂的影响主要有两部分:一是对树脂溶胀性的影响[39];二是对反应体系的影响。所选择的溶剂,最好对树脂有较高的溶胀性及有较多量的反应物分配在树脂相内, 这可使反应较易于进行。
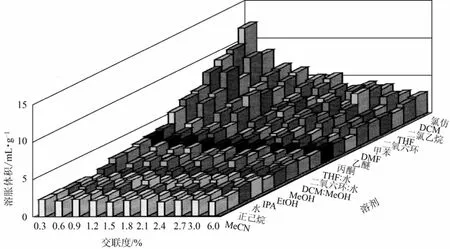
图4 PS-(0.3%~0.6%)DVB及不同溶剂对溶胀体积的影响
常见羟醛缩合溶剂有水[8,17,42-44]、三氯甲烷[45]、二甲亚砜[46]、N,N-二甲基甲酰胺[6]等。近十年来,由于绿色理念的影响,对水的研究较多。
Gruttadauria等[45]在单纯考虑几类不同溶剂的影响时发现,溶剂对产率的影响与树脂溶胀度成正比关系,即CHCl3> CH2Cl2> C6H5CH3> THF >Et2O。该研究同时表明虽然在室温下有不错产率,但最好的结果却出现在-5~-10 ℃。另外,Gruttadauria等[47]又指出溶剂诸如二甲亚砜、二甲基甲酰胺、三氯甲烷及二氧六环对反应并没有促进作用,质子溶剂(如甲醇、乙醇、异丙醇)反而会降低反应转化率。水之所以能促进反应进行,在于催化剂由于与水的氢键作用形成环状结构,它将亲水基团集聚在外层,而迫使疏水的芳香醛进入催化剂内层,故而可促进反应并提高立体选择性(图 5)。这类似于水环境下醛缩酶催化形成烯胺中间体的过程。Liu等[48-49]合成了一类新型两性的线性聚苯乙烯负载脯氨酸,同样发现水的存在有利于反应活性和立体选择性的提高。
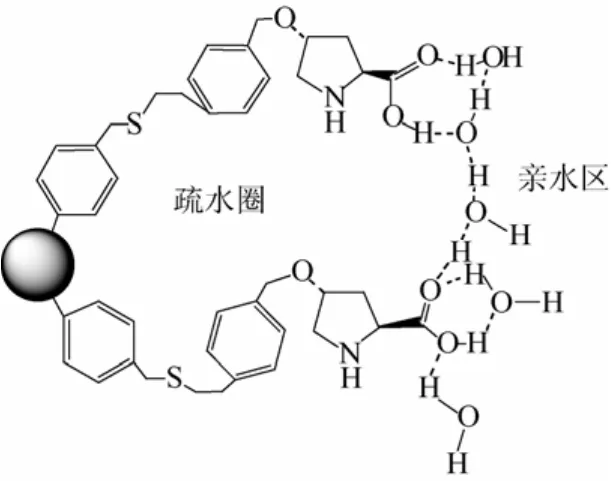
图5 水环境下聚苯乙烯负载脯氨酸结构
本文作者研究过丙酮甲醛的反应,发现丙酮本身就是良溶剂,水的加入使产率下降,同时,在反应体系中加入表面活性剂有助于产率的提高,Gemini表面活性剂的加入甚至使产率可达65%以上。Hayashi等[50]将表面活性剂嫁接在脯氨酸上,不仅实现了高收率,也减少了表面活性剂单独加入给后续分离带来的困难。这些不仅在于其相转移催化作用,也在于有机相可能对亲核试剂负离子的非溶剂化起到作用,从而活化和稳定该负离子。长碳链特别是多条长链将有助于亲核试剂的存在、产率的提高,并且可能大大降低催化剂用量,这对大孔树脂基团负载量低的问题无疑是个福音。
Li等[51]延引Augé等[52]的文章,指出对于丙烯腈和苯甲醛的反应,在水溶剂中加入碘化锂或碘化钠,其疏水性可大大提高反应活性。Tanemura等[53]则是在酮和芳香醛的水溶液反应体系中加入PEG400提高产率。Gruttadauria等[54]则指出,由于疏水骨架的影响,无需额外再添加碱和表面活性剂。
另一方面,Zhang等[9]在研究不同溶剂对硝基苯甲醛与环已酮反应时指出,水溶性胶束对不对称缩合反应催化效果明显,或许也在于有助于脯氨酸酶催化疏水性。赵月昌等[55]也指出环已烷的加入虽然可带走反应产物水,但对反应体系的稀释作用使反应物环己酮自身碰撞概率降低,从而转化率下降。Rao等[17]通过DFT计算指出,水环境利于质子传递的效应影响C—C、C—N键形成、脱水及β消去过程中通过质子化与去质子化交互作用减少活化能垒。Serra-Holm等[40]则较为详细地指出水浓度影响着产物的分布。70 ℃下甲醛与丁醛摩尔比为4∶1的情况下,水含量48%时,羟醛产物产率为0.53,水含量 55%时羟醛产物产率为 0.76,65%时为0.62。
此外,Chimni等[56]指出,质子酸对羟醛缩合产物的非对映和对映选择性影响很大。一般而言,酸性有助于高立体选择性,pH值为4~5时最有利于水溶液下的非对映和对映立体选择性。
3 聚苯乙烯改性对羟醛缩合的影响
聚苯乙烯作为相转移催化剂载体应用广泛[57-58]。对聚苯乙烯改性主要有3种[59-60],
3.1 苯环上氢原子的亲电取代,
苯环上氢原子的亲电取代用于合成功能高分子、离子交换树脂以及在聚苯乙烯分子链上引入交联点或接枝点。特别是聚苯乙烯的氯甲基化,生成的苄基氯易进行亲核取代反应而能转化为许多其它的功能基(图6)。
聚苯乙烯负载脯氨酸的一般合成路线见图 7。主要通过氯甲基嫁接脯氨酸,再与具有硫醇基的聚苯乙烯结合。Gruttadauria等[54]指出,聚苯乙烯负载的脯氨酸立体选择性优于没有负载的脯氨酸,但产物ee值不好。Liu等[48-49]通过合成两性长碳链线性聚苯乙烯负载脯氨酸,实现其胶束作用。Bañón-Caballero等[61]则合成具有大体积效应的聚苯乙烯负载N-磺酰基-(Ra)-联二萘胺-D-脯氨酰胺,并使用苯甲酸作共催化剂,有效降低了丙酮的用量。
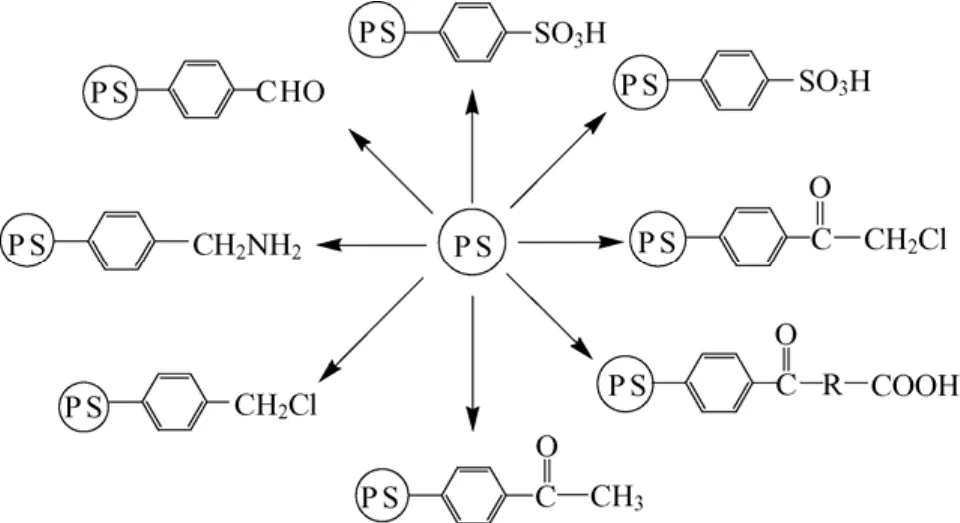
图6 聚苯乙烯苯环上官能团化
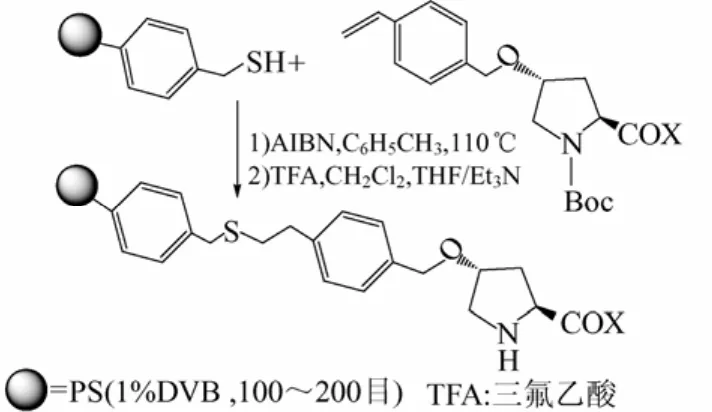
图7 聚苯乙烯负载脯氨酸合成路线
除了对碳链的修饰改性外,Masakazu等[11]、Saito等[19]、Chen等[25]通过设计不同构型的二胺活性结构,有效地接近和攻击羰基,使得二胺结构具有高催化活性。同时,具有三氟甲磺酸结构的二胺对水有一定的稳定性。
3.2 聚苯乙烯链节苄基位的脱氢共聚
聚苯乙烯链节中具有化学性质活泼的苄基位,可脱氢发生自由基共聚[62-63],如聚苯乙烯与聚乙二醇、丙烯酸及其酯类、顺酐、丙烯腈、丙烯醇等共聚合。在聚苯乙烯链节上接枝活性极性基团,极大地改善了聚苯乙烯的柔顺性、极性和水溶性。其中,可溶性高分子负载由于具有均相反应的高活性,同时又可因热敏感性、溶剂敏感性而具有不同溶解性而析出,是近年来发展的一个热门。最常见的是聚乙二醇(PEG)、线型聚苯乙烯(PS)。
Annunziata等[64]合成了 MeOPEG修饰的聚苯乙烯季铵盐。Benaglia等[65-67]将其应用于羟醛缩合,指出 PEG引入一般不影响产物的手性结构。Akagawa等[68]则合成了PEG-PS负载的多肽应用于aldol缩合。
另一方面,可溶性高分子负载研究的意义不仅在于之前提到的固载,也在于绿色化学所倡导的可循环利用理念。
Gruttadauria等[13]将有机催化的固载方式归结为图 8,并指出:共价键连接的有机催化剂回收方便,避免过滤,并可在较强极性溶剂中使用。这类非均相催化剂载体如聚苯乙烯或二氧化硅,具有高的立体选择性,但活性却一般不如均相催化剂。然而,均相催化剂需沉淀回收,这类非均相催化剂损失较大。另一方面,对于无需共价键连接的脯氨酸也受人关注,它无需修饰,但过滤却成了一大缺点,因其不能在水相中进行,必须使用两相催化。在这方面,离子液体显示了其优于常规有机溶剂的特点,然而价格昂贵且产物回收只能靠萃取。
McNamara等[69]则指出,PS除常规DVB交联外,可用二乙醇二甲基丙烯酸脂或四甘醇二丙烯酸酯等聚乙二醇类物质交联改善溶解性。Barbaro等[70]则指出离子交换树脂的优点在于良好的稳定性、高回收率及优良的作为模块的组合性。
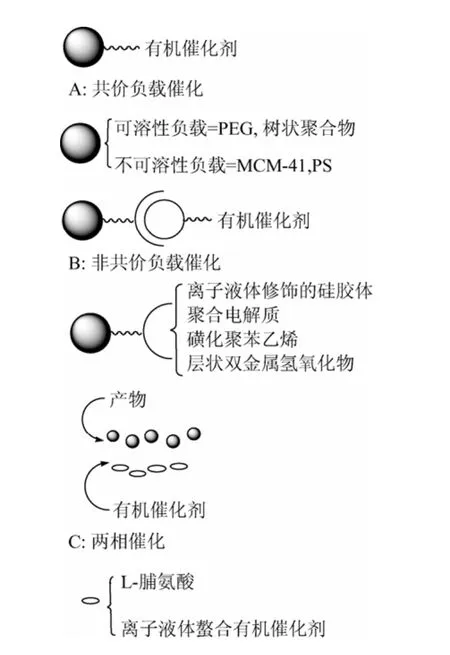
图8 有机催化剂固载的一般方法
3.3 聚苯乙烯微胶囊
不论是溶剂,还是可溶性基团改性,其出发点都在于催化剂溶解性对反应活性的影响。从形貌的角度而言,制备具有类似于核溶解而壳不溶解的微胶囊结构催化剂将是一种大胆的创新。Price等[71]制备了 4-(N,N-二甲基氨基吡啶) 修饰的线性聚苯乙烯,应用于酰化反应转化率都很高。Yoshida等[72]应用相分离和溶剂蒸发技术制备了聚苯乙烯微胶囊结构,并将其应用于微反应器。这些可能都将是未来发展的一个方向。
3.4 金属螯合在羟醛缩合中的应用
研究者一直在探索有机催化取代金属催化的可操作性,但金属负载催化不失为一种在已有基础上的创新。在水相反应中具有比较高稳定性的金属元素主要有Sn、Sc、Fe、Cu等。
Kobayashi等[73]将钪负载于聚苯乙烯上,由于聚合物链和空间效应的影响,形成疏水的反应区,无需溶剂协助,且在水中反应速率快于在其它媒介,过程简单,易回收。Itoh等[74]则将Zn螯合在氨基酸上制成双功能基团催化剂。指出反应的关键可能在于侧链上的胺基结合羰基α位上的氢,而非Schiff催化机理。他进一步提出,由Zn和酮形成的 Zn2+-烯醇中间体比由脯氨酸和酮形成的烯胺更有活性。
4 结 论
聚苯乙烯树脂催化羟醛缩合反应主要集中在负载脯氨酸及少数报道的阴离子交换树脂两方面。由于脯氨酸具有良好的活性和立体选择性,作为有机高分子催化剂近十年来备受关注。另一方面,有别于脯氨酸的L碱催化,作为最接近于液态B碱的非均相催化剂离子交换树脂,无论其碱强度、催化应用领域[75],还是制备成本、工业可行性,都优于脯氨酸,但其相对单调的结构模式限制了其可塑性,使得几十年来对聚苯乙烯阴离子交换树脂在催化应用方面一直没有特别大的起色。研究者在优化聚苯乙烯负载脯氨酸以提高其活性、选择性及苛刻环境适用性的同时,也应该强调聚苯乙烯阴离子交换树脂模块组合,以利用它们之间的耦合、协同效应,达到催化性能的最优化。
高温下气相催化一直是高聚物催化的一大禁区,特别对于聚苯乙烯树脂而言,长碳链的引入高聚物间的共混,如PS-PEG以及耐热聚酰亚胺、二氧化硅改性等,一定程度上都有助于其热稳定性的改善。聚苯乙烯自组装功能复合材料在油水分离、荧光成像、药物输运等领域应用发展如火如荼,却较少应用于催化,这将是一个亟待开发的领域。
[1]Abramsa Irving M, Millar John R.A history of the origin and development of macroporous ion-exchange resins[J].Reactive and Functional Polymers,1997,35(1):7-22.
[2]Farrall Jean M,Frechet Jean M J.Bromination and lithiation.two important steps in the functionalization of polystyrene resins[J].J. Org. Chem.,1976,41(24):3877-3882.
[3]Frechet Jean M J,Smet Marc D de,Farrall M Jean.Application of phase-transfer catalysis to the chemical modification of cross linked polystryrene resins[J].J. Org. Chem.,1979,44(11):1774-1779.
[4]Ford Warren T, Tomoi Jeanne L M. Mechanisms of polymer-supported catalysis.3. Ion exchange limitations and macroporous polystyrene supports[J].Macromolecules,1982,15(5):1246-1251.
[5]Cozzi Franco.Immobilization of organic catalysts:When,why,and how[J].Advanced Synthesis & Catalysis,2006,348(12-13):1367-1390.
[6]List Benjamin,Lerner R A,Barbas Carlos.Proline-catalyzed direct asymmetric aldol reactions[J].J. Am. Chem. Soc.,2000,122(10):2395-2396.
[7]Jung Michael E, Salehi-Rad Ramin. Total synthesis of auripyrone a using a tandem non-aldol aldol/paterson aldol process as a key step[J].Angewandte Chemie International Edition,2009,121(46):8922-8925.
[8]Markert Morris,Scheffler U,Mahrwald Rainer. Asymmetric histiine-catalyzed cross-aldol reactions of enolizable aldehydes:Access to defined configured quaternary stereogenic centers[J].J. Am. Chem. Soc.,2009,131(46):16642-16643.
[9]Zhang Hefeng,Zhao Wenshan,Zou Jun,et al.Aldol reaction catalyzed by a hydrophilic catalyst in aqueous micelle as an enzyme mimic system[J].Chirality,2009,21(5):492-496.
[10]Gruttadauria M , Giacalone F, Marculescu A M , et al. Stereoselective aldol reaction catalyzed by a highly recyclable polystyrene supported substituted prolinamide catalyst[J].Arkivoc,2009(8):5-15.
[11]Nakadai Masakazu, Saito Susumu , Yamamoto Hisashi. Diversity-based strategy for discovery of environmentally benign organocatalyst:Diamine protonic acid catalysts for asymmetric direct aldol reaction[J].Tetrahedron,2002,58(41):8167-8177.
[12]Font Daniel,Jimeno Ciril,Pericàs Miquel A.Polystyrene-supported hydroxyproline:An insoluble,recyclable organocatalyst for the asymmetric aldol reaction in water[J].Organic Letters,2006,8(20):4653-4655.
[13]Gruttadauria Michelangelo,Giacalone Francesco,Noto Renato. Supported proline and proline-derivatives as recyclable organocatalysts[J].Chemical Society Reviews,2008,37(8):1666-1688.
[14]梁泽磊,伍艳辉,刘剑,等.羟醛缩合体系反应精馏研究进展[J].化工时刊,2010,24(1):66-70.
[15]Podrebarac G G,Ng F T T,Rempel G L. A kinetic study of the aldol condensation of acetone using an anion exchange resin catalyst[J].Chemical Engineering Science,1997,52(17):2991-3002.
[16]Melvin Astle J,Joel Zaslowsky A.Reactions catalyzed by anion exchange resins:Aldol condensation[J].Industrial and Engineering Chemistry,1952,44(12):2869-2871.
[17]Rao Qin Quan ,Luo Shi Wei,Gong Liu Zhu.Water as dual functional cocatalyst:A theoretical study on the mechanism of direct aldol reaction on water catalyzed by a leucine derivative[J].Chinese Science Bulletin,2010,55(17):1742-1752.
[18]Girolamo Marco D,Marchionna Mario.Acidic and basic ion exchange resins for industrial applications[J].Journal of Molecular Catalysis A:Chemical,2001,177(1):33-40.
[19]Saito Susumu,Yamamoto Hisashi.Design of acid-base catalysis for the asymmetric direct aldol reaction[J].Acc. Chem. Res.,2004,37(8):570-579.
[20]Mestres Ramon .A green look at the aldol reaction[J].Green Chemistry,2004, 6:583-603.
[21]Tanabe Kozo,Hölderich W F.Industrial application of solid acid–base catalysts[J].Applied Catalysis:General,1999,181:399-434.
[22]Kano Taichi ,Tokuda Osamu,Takai Jun,et al.Design of a binaphthyl-based axially chiral amino acid as an organocatalyst for direct asymmetric aldol reactions[J].Chem. Asian. J.,2006,1(1-2):210-215.
[23]Kano Taichi, Takai Jun, Tokuda Osamu,et al. Design of an axially chiral amino acid with a binaphthyl backbone as an organocatalyst for a direct asymmetric aldol reaction[J].Angewandte Chemie,2005,44(20):3055-3057.
[24]Xu Xiao Ying,Wang Yan Zhao,Gong Liu Zhu. Design of organocatalysts for asymmetric direct syn-aldol reactions[J].OrganicLetters,2007,9(21):4247-4249.
[25]Chen Jia Rong, Lu Hai Hua, Li Xin Yong,et al. Readily tunable and bifunctional L-prolinamide derivatives:Design and application in the direct enantioselective aldol reactions[J].Organic Letters,2005,7(20):4543-4545.
[26]Chen Jia Rong, Li Xin Yong,Xing Xiao Ning,et al. Sterically and electronically tunable and bifunctional organocatalysts:Design and application in asymmetric aldol reaction of cyclic ketones with aldehydes[J].J. Org. Chem.,2006,71(21):8198-8202.
[27]Haraguchi Mieko,Nakagawa Tsutomu,Nose Takuhei. Miscibility of associated polymer blend solutions: 1.One-end-aminated polystyrene one-end-carboxylated poly(ethylene glycol)blends in toluene[J].Polymer,1995,36(13):2567-2572.
[28]Alexandratos S D.Ion-exchange resins:A retrospective from industrial and engineering chemistry research[J].Ind. Eng. Chem. Res.,2009,48(1):388-398.
[29]Aragon Jose M,Vegas Jesus M R,Jodra Luis G.Catalytic behavior of macroporous resins in catalytic processes with water production.Activation and inhibition effects in the kinetics of the self-condensation of cyclohexanone[J].Industrial & Engineering Chemistry Research,1993,32(11):2555-2562.
[30]欧植泽,徐满才. 三丁胺胺化强碱性阴离子交换树脂催化合成苄叉丙酮[J].离子交换与吸附,2000,16(2):167-170.
[31]胡微,劳学军,张健,等.碱性阴离子交换树脂催化合成甲基乙烯基酮[J].江苏化工,2003,31(2):47-48.
[32]石秀敏,徐静莉.碱性树脂催化剂上丙酮的醇醛缩合反应[J]. 吉林工学院学报,2001,22(3):35-37.
[33]范云鸽,肖国林.耐高温强碱阴离子交换树脂研究进展[J].离子交换与吸附,2005,21(4):376-384.
[34]肖国林,范云鸽,赫连朋丽,等. 强碱阴离子交换树脂合成及热稳定性能研究[J].离子交换与吸附,2005,21(6):514-521.
[35]陈群,刘迎春,孙奇,等.耐高温强碱性阴离子交换树脂催化剂的合成及应用[J].分子催化,2009,23(3):243-247.
[36]刘迎春,何明阳,陈群,等.含长碳链间隔臂结构的强碱性阴离子交换树脂的合成及热稳定性[J].离子交换与吸附,2009,25(6):534-541.
[37]王璠,陈金龙,陈群,等.一种带有醚键结构的阴离子交换树脂的合成[J].高分子材料科学与工程,2006,22(1):73-75,79.
[38]徐秉声,张广禄.大孔耐温强酸阳离子交换树脂催化剂的研究[J].抚顺石油化工研究院院报,1993,26(43):27-34.
[39]Rana Sunil,White Peter,Bradley Mark.Influence of resin cross linking on solid phase chemistry[J].J. Comb. Chem.,2001,3(1):9-15.
[40]Serra-Holm V, Salmi T , Multamäkia J,et al.Aldolization of butyraldehyde with formaldehyde over a commercial anion-exchange resin:Kinetics and selectivity aspects[J].Applied Catalysis A:General,2000,198(1-2):207-221.
[41]Kun K A, Kunin Robert.The pore structure of macroreticular ion exchange resin[J].Journal of Polymer Science Part C,1967(3):1457-1469.
[42]Garroa Raul,Navarroa María T,Primo Jaime.Lewis acid-containing mesoporous molecular sieves as solid efficient catalysts for solvent-free Mukaiyama-type aldol condensation[J].Journal of Catalysis,2005,233(2):342-350.
[43]Córdova Armando,Notz Wolfgang,Barbas Carlos F. Direct organocatalytic aldol reactions in buffered aqueous media[J].Chemical Communications,2002,24:3024-3025.
[44]Torii Hiromi,Nakadai Masakazu,Ishihara Kazuaki,et al.Symmetric direct aldol reaction assisted by water and a proline-derived tetrazole catalyst[J].Angew. Chem. Int. Ed.,2004,43(15):1983-1986.
[45]Gruttadauria M ,Giacalone F ,Marculescu A M ,et al.Novel prolinamide-supported polystyrene as highly stereoselective and recyclable organocatalyst for the aldol reaction[J].Advanced Synthesis & Catalysis,2008,350(9): 1397-1405.
[46]Odedra Arjan,Seeberger Peter H.5-(Pyrrolidin-2-yl)tetrazole -catalyzed aldol and mannich reactions:Acceleration and lower catalyst loading in a continuous-flow reactor[J].Angew. Chem. Int. Ed.,2009,48:2699-2702.
[47]Gruttadauria Michelangelo,Giacalone Francesco, Marculescu Adriana Mossuto,et al.Hydrophobically directed aldol reactions:Polystyrene-supportedL-proline as a recyclable catalyst for direct asymmetric aldol reactions in the presence of water[J].European Journal of Organic Chemistry,2007,28:4688-4698.
[48]Liu Yu Xia,Sun Ya Nan, Tan Hao Han,et al. Linear polystyrene anchored l-proline:New recyclable organocatalysts for the aldol reaction in the presence of water[J].Tetrahedron:Asymmetry,2007,18(22):2649-2656.
[49]Liu Yu Xia,Sun Ya Nan,Tan Hao Han,et al.Asymmetric aldol reaction catalyzed by new recyclable polystyrene-supported l-proline in the presence of water[J].Catalysis Letters,2007,120(3-4):281-287.
[50]Hayashi Yujiro,Aratake Seiji,Okano Tsubasa,et al.Combined proline-surfactant organocatalyst for the highly diastereo and enantioselective aqueous direct cross-aldol reaction of aldehydes[J].Angewandte Chemie International Edition, 2006,45(33):5527-5529.
[51]Li Chao Jun.Organic reactions in aqueous media with a focus on carbon-carbon bond formations adecade update[J].Chem.Rev.,2005,105(8):3095-3166.
[52]Augé Jacques,Lubin Nadège,Lubineau André.Acceleration in water of the Baylis-Hillman reaction[J].Tetrahedron Letters,1994,35(43):7947-7948.
[53]Tanemura Kiyoshi ,Suzuki Tsuneo,Nishida Yoko,et al.Aldol condensation in water using polyethylene glycol 400[J].Chemistry Letters,2005,34(4):576-577.
[54]Gruttadauria Michelangelo,Salvo Anna Maria Pia,Giacalone Francesco,et al.Enhanced activity and stereoselectivity of polystyrene-supported proline-based organic catalysts for direct asymmetric aldol reaction in water[J].European Journal of Organic Chemistry,2009,31:5437-5444.
[55]赵月昌,梁学正,高珊,等.固体超强酸催化下的醛酮自身缩合及其溶剂效应的研究[J].分子催化,2007,21(4):315-318.
[56]Chimni S S ,Singh Sarbjit,Kumar Akshay.The pH of the reaction controls the stereoselectivity of organocatalyzed direct aldol reactions in water[J].Tetrahedron:Asymmetry,2009,20(15):1722-1724.
[57]Benaglia Maurizio,Puglisi Alessandra,Cozzi Franco. Polymersupported organic catalysts[J].Chemical Reviews,2003,103(9):3401-3430.
[58]Clapham Bruce,Reger Thomas S,Janda Kim D. Polymer supported catalysis in synthetic organic chemistry[J].Tetrahedron,2001,57(22):4637-4662.
[59]郑刚,王汝敏. 废旧聚苯乙烯的化学改性进展[J].中国塑料,2009,23(12):6-9.
[60]王为强,张秋禹,刘燕燕,等.单分散大粒径交联聚苯乙烯微球的制备及功能化改性的研究进展[J].化工进展,2009,28(1):93-99
[61]Bañón-Caballero A,Guillena G,Nájera C.Solvent-free direct enantioselective aldol reaction using polystyrene-supportedN-sulfonyl-(Ra)-binam-D-prolinamide as a catalyst[J].Green Chemistry,2010,12(9):1599-1606.
[62]李伯耿,余波.间规聚苯乙烯改性的研究进展[J].化工进展,2003,22(6):559-563.
[63]冯长根,李鑫,曾庆轩,等.聚丙烯/聚苯乙烯共混物形态研究进展[J].化工进展,2004,23(11):1179-1183.
[64]Annunziata R,Benaglia Maurizio, Cinquini Mauro,et al. A poly(ethylene glycol)-supported quaternary ammonium salt:An efficient,recoverabl,and recyclable phase-transfer catalyst[J]. Organic Letters,2000,2(12):1737-1739.
[65]Benaglia Maurizio,Cinquini Mauro,Cozzi Franco,et al.Poly(ethylene glycol)-supported proline:A versatile catalyst for the enantioselective aldol and iminoaldol reactions[J].Adv. Synth. Catal.,2002,344(5):533-542.
[66]Benaglia M.Recoverable,soluble polymer-supported organic catalysts[J].Chemistry and Materials Science,2008,2007(2):299-319.
[67]Benaglia Maurizio, Celentano Giuseppe, Cozzi Franco. Enantioselective aldol condensations catalyzed by poly(ethylene glycol)-supported proline[J].Adv. Synth. Catal.,2001,343(2):171-173.
[68]Akagawa K,Sakamoto S,Kudo K.Resin-supported acid- and base-catalyzed one-pot sequential reaction including an enantioselective step[J].Tetrahedron Letters,2007,48(6):985-987.
[69]McNamara Catherine A,Dixon Mark J,Bradley Mark.Recoverable catalysts and reagents using recyclable polystyrene-based supports[J].Chem. Rev.,2002,102(10):3275-3300.
[70]Barbaro P,Liguori Francesca. Ion exchange resins:Catalyst recovery and recycle[J].Chem. Rev.,2009,109(2):515-529.
[71]Price Kristin E,Mason Brian P,Bogdan Andrew R,et al.Microencapsulated linear polymers:“Soluble” heterogeneous catalysts[J].J. Am. Chem. Soc.,2006,128(32):10376-10377.
[72]Yoshida M,Mardriyati E,Enokuchi D,et al.Structural control of core-shell polystyrene microcapsule immobilized microbial cells and their application to polymeric microbioreactors[J].Journal of Applied Polymer Science,2003,89(7):1966-1975.
[73]Nagayama Satoshi, Kobayashi Shū. A novel polymer-supported scandium catalyst which shows high activity in water[J].Angew. Chem. Int. Ed.,2000,39(3):567-569.
[74]Itoh Susumu, Kitamura Masanori,Yamada Yasuyuki,et al. Chiral catalysts dually functionalized with amino acid and Zn2+complex components for enantioselective direct aldol reactions inspired by natural aldolases:Design,synthesis,complexation properties,catalytic activities,and mechanistic study[J].Chemistry-A European Journal,2009,15(40):10570-10584.
[75]蔡红,周斌.离子交换树脂在有机催化反应中的应用进展[J].化工进展,2007,26(3):386-391.
Advance in polystyrene resins for catalytic aldol condensation
WANG Jiexiang,WANG Qiang,LI Yunhua,CHEN Binghui
(School of Chemistry and Chemical Engineering,National Engineering Laboratory for Green Chemical Production of Alcohols-Ethers-Esters,Xiamen University,Xiamen 361005,Fujian,China)
Polystyrene resins have been paid attentions as a type of solid basic catalyst and significant progress has been made in its industrial application. The use of polystyrene resins to catalyze aldol condensation is reviewed. The effects of inherent properties and the modification of polystyrene resins on aldol reactions are summarized. The potential and research for polystyrene resins as catalysts are discussed.
polystyrene;aldol condensation; polymer-supported
TQ 325
A
1000–6613(2011)07–1521–08
2011-01-02;修改稿日期:2011-01-24。
王结祥(1985-),男,博士研究生。联系人:陈秉辉,教授,主要从事催化与反应工程研究。E-mail chenbh@xmu.edu.cn。

