青顶拟多孔菌对单一和复合多环芳烃的降解特性
杜丽娜,高大文,2*(.东北林业大学林学院环境科学专业,黑龙江 哈尔滨 50040;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 50090)
青顶拟多孔菌对单一和复合多环芳烃的降解特性
杜丽娜1,高大文1,2*(1.东北林业大学林学院环境科学专业,黑龙江 哈尔滨 150040;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
利用中国东北林区普遍存在白腐菌——青顶拟多孔菌,降解单一和复合多环芳烃,分别测定了菲、蒽、芘于11,22,33d的累积降解率.结果显示,对于单一多环芳烃,该菌种降解能力由强到弱依次为菲>蒽>芘,33d累积降解率依次为96.56%、94.76%和57.53%;对复合多环芳烃降解中,菲和芘的累积降解率分别为99.46%和61.09%.在复合多环芳烃的降解研究中发现,少量蒽的加入,刺激了菌种对菲和芘的降解,使菲和芘的降解率分别提高了2.9%和3.56%.由此提示,在研究降解高环、难降解多环芳烃时,可利用低环多环芳烃对菌种的刺激作用,在体系内形成高、低环多环芳烃的共代谢,以达到更加高效降解多环芳烃的目的.
青顶拟多孔菌;单一多环芳烃;复合多环芳烃;降解;共代谢
多环芳烃(PAHs)广泛存在于土壤、水体和大气中,具有致畸、致癌、致突变的作用.1979年,美国国家环境保护局(EPA)将16种PAHs定为优先检测污染物.中国政府也将7种PAHs列入“中国环境优先污染物黑名单”[1-3].
PAHs的治理方法有物理方法、化学方法[4-6]和生物修复[7-9]等.其中,微生物修复具有低成本、高效益、无二次污染的特点,且作用潜力巨大.白腐真菌(White rot fungi)是一类能引起木质白色腐烂的丝状真菌的总称,该菌种类繁多,可利用自身分泌的木质素降解酶系及独特的作用方式,对许多难降解有机物进行降解,如工业废水[10]、农药[11]和一些环境持久性有机污染物[12-13].本研究采用东北林区普遍存在的白腐菌——青顶拟多孔菌,考察了该菌对单一和复合 PAHs的降解情况,探讨不同形式 PAHs的降解机理,并且在此基础上初步探索菌种对 PAHs的共代谢情况,为治理PAHs提供新思路.
1 材料与方法
1.1 供试菌种
菌种选用东北林区特有的白腐真菌——青顶拟多孔菌(Polyporellus picipes),购自中国科学院微生物研究所.
1.2 培养基
固体培养基:称取去皮马铃薯 200g,切成小块,加适量(完全浸没马铃薯)蒸馏水,煮 20~30min,用 9层纱布过滤出马铃薯浸出液,加入葡萄糖20g, K2HPO4·3H2O 3.0g, MgSO4·7H2O 1.5g,琼脂20g,蒸馏水定容至1L.
液体培养基:称取麸皮35g,加适量(完全浸没麸皮)蒸馏水,煮 20~30min,用 9层纱布过滤出麸皮浸出液,加入蛋白胨4g, K2HPO4·3H2O 1g, KCl 0.5g, MgSO4·7H2O 0.5g, FeSO4·7H2O 0.01g,采用HAc/NaAc缓冲液调节pH4.0.
1.3 主要试剂与仪器
蒽(Ant,纯度 90%)、菲(Phe,97%)、芘(Pyr,纯度>98%),环己烷和丙酮均为分析纯.称取一定量蒽、菲、芘溶于丙酮,配制成500mg/L 标准溶液,工作液采用逐级稀释的方法配制.
安捷伦 6890N型气相色谱仪(美国 Agilent公司)、SPX-150B型生化恒温培养箱(天津市泰斯特仪器有限公司)、SW-CJ-1D型单人净化工作台(苏州净化设备有限公司)、752型紫外-可见光度计(上海菁华科技仪器有限公司)、H1650高速离心机(长沙湘仪离心机仪器有限公司)、MSX-280型手提式压力蒸汽消毒器(北京市永光日月医疗仪器厂)、202-OAB型电热恒温干燥箱(天津市泰斯特仪器有限公司)等.
1.4 菌种的活化培养
将青顶拟多孔菌从斜面上接种于含固体培养基的平板上,28℃静置培养,至菌丝布满平板.
1.5 PAHs的降解
向 150mL三角瓶中分别加入不同浓度的蒽、菲、芘的丙酮溶液,放置通风橱中过夜,待丙酮挥发完毕后取出,各加入50mL液体培养基,分别配制成 30mg/L蒽、菲、芘 3组单一溶液和5mg/L蒽+30mg/L菲、5mg/L蒽+30mg/L芘两组复合溶液.灭菌后,每个样品分别接种3片直径为10mm的菌片,每组样品做9个平行,另设置不加菌空白样品.在28℃、160r/min条件下培养33d,每组样每隔11d取3个平行样测定降解率.
1.6 PAHs的提取
液相采用环已烷萃取,量取与待萃取的菌液等体积的环己烷于分液漏斗中,剧烈振荡,静置,待溶液分层后,将上层有机相倒入蒸馏瓶,下层水相倒入另一分液漏斗中,重复操作2次后,弃去水相.为将 PAHs提取完全,对三角瓶里的菌片同时进行提取,即向装有剩余菌片的三角瓶内加入20mL体积比为 1:1的环已烷和丙酮混合液,超声提取20min,重复操作2次后,弃去菌片.将每次液相与菌片萃取获得上层有机相合并入蒸馏瓶,在 45℃下,旋转蒸发,浓缩至 1.5mL左右,收集于气相色谱小瓶,待测.
1.7 PAHs的测定
采用气相色谱法[14].测定条件:进样量 1μL,气化室温度 260℃,分流比 50:1.分离柱:Agilent 19091J-413HP-5 5% Phenyl Methyl Siloxane(30.0m×320μm×0.25μm).程序升温:初温 200℃,中温260℃,升温速率5/min℃,于260℃,保留3min.检测器:FID检测器,温度280℃.
1.8 漆酶活力的测定
将菌种接入液体培养基,定期移取1mL培养液于离心管中,9000r/min离心10min,上清液即为粗酶液.
定义每 1min转化 1µmol2,2-连氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)所需的酶量为 1个活力单位.反应体系为:0.2mol/L醋酸-醋酸钠缓冲溶液(pH5.0), 5mmol/LABTS溶液以及一定量酶液,用分光光度计检测在波长420nm处0~3min内吸光度值的变化[15].
1.9 生物量的测定
生物量的测定采用菌体干重法[16].取已烘至恒重的定量滤纸1张,在天平上称重(a),取整瓶培养菌液过滤,收集菌片,105℃烘至恒重(b),扣除菌片琼脂的干重(c).菌丝的干重=b-a-c
2 结果与讨论
2.1 青顶拟多孔菌对单一PAHs的降解
由于不同PAHs结构和毒性不同,使得菌种对其降解的难易程度不同.在28℃、160r/min条件下,检测青顶拟多孔菌对蒽、菲、芘 3组单一液体培养基的11,22,33d降解情况,结果如图1所示.对比 PAHs的降解率,青顶拟多孔菌对菲的降解作用最强,其次是蒽,最后是毒性较强的芘,33d对PAHs的降解率分别为蒽94.76%、菲96.56%、芘57.53%.该菌对PAHs的降解能力与文献报道的 Pleurotus ostreatus[17]和 Bjerkandera sp.BOS55[18]等菌种的降解能力相近,处于较优水平.
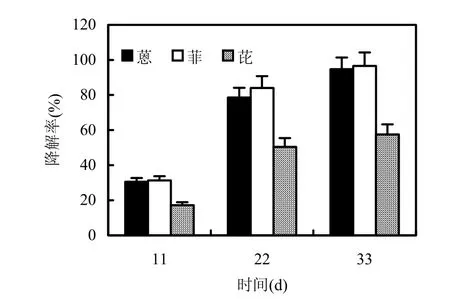
图1 单一蒽、菲、芘降解率比较Fig.1 The comparison of degradation rate of anthracene,phenanthrene and pyrene
2.2 蒽、菲、芘的降解特性
对比等浓度蒽、菲、芘的降解情况,可以看出,该菌对其降解的从易到难顺序为:菲、蒽、芘.此结果与聂麦茜[19]研究的一种短杆菌一致.菲和蒽为三环 PAHs,而芘为四环 PAHs,一般来讲,低环PAHs中,苯环个数多的毒性较大[20],不易被菌种利用.所以芘的毒性要高于菲和蒽,较难降解.但也有研究结果显示[21],在一定条件下,3种PAHs的降解难易度为菲>芘>蒽.
在培养的不同阶段,微生物对作用底物的降解能力不同.对一种PAHs而言,比较3个阶段的降解率的累积增幅,即净累积降解率,可以看出培养中期(11~22d)最大,蒽48.05%、菲52.74%、芘33.26%;其次是培养初期(0~11d),蒽 30.53%、菲31.26%、芘17.17%;增幅最小的是培养的最后阶段(22~33d),蒽 16.18%、菲 12.56%、芘 7.20%.虽然该菌种对不同 PAHs的降解率大小不同,但是对3种PAHs在3个阶段中的作用趋势相同,此结果与菌体分泌漆酶和生长趋势有关,测定31d在液体培养基中培养菌体产漆酶酶活和生物量,如图2所示.菌体从培养初期开始,生物量迅速增大,而酶活则开在0~7d增幅较小,从第7d开始,酶活迅速上升;生物量增大到第15d达到最大值,最大生物量为 214.50mg/L,之后呈下降趋势,酶活在7~21d左右,均呈上升趋势,并在21d达到峰值,为139280.7U/L,之后便迅速下降.整体来讲,培养中期(11~22d)正处于酶活高峰期阶段,故作用情况最好,降解率最高.
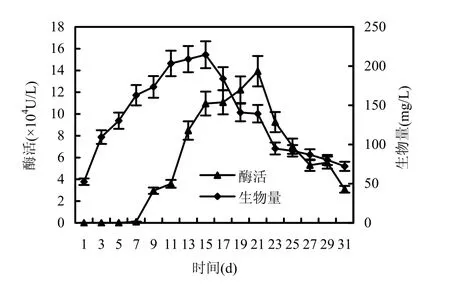
图2 青顶拟多孔菌漆酶酶活与生长曲线Fig.2 The activity of Polyporellus picipes and its growth curve
关于漆酶降解作用的机理,侯红漫等[22]在其相关的研究中指出: 漆酶是单电子氧化还原酶,它催化底物氧化反应机理主要是底物自由基的生成和漆酶分子中4个Cu2+的协同作用.具体为底物结合酶活性中心的 I型 Cu2+位点,通过Cys-His途径将其传递给三核位点;该位点再把电子传递给结合到活性中心的第二底物氧分子,并还原成水.在整体的反应过程中,需要连续的单电子氧化作用,以满足漆酶的充分还原.还原态的酶分子通过四电子转移传递给分子氧,在此过程中,氧还原可能分为两步:首先,有2个电子转移产生过氧化氢中间体;该中间体在另外 2单电子作用下被还原成水.
2.3 青顶拟多孔菌对蒽+菲、蒽+芘复合 PAHs的降解
在28℃、160r/min条件下,检测青顶拟多孔菌在液体培养基中对蒽+菲、蒽+芘复合 PAHs降解情况,结果如图3和图4所示.
青顶拟多孔菌对蒽、菲的单一降解效果很接近,菲稍高,降解率相差不到 6%.其他研究显示[23-25],单一蒽与菲相比较,蒽毒性较小,更容易被微生物利用降解.故选择用蒽作为刺激物,来研究复合 PAHs的降解作用.蒽作为刺激物的浓度选择为 5mg/L,是因为在复合 PAHs研究中,主要研究的降解对象是菲和芘,想要利用蒽对菌种的刺激作用,以达到增大菲和芘的降解率的目的.蒽是充当刺激物而不是被降解物的角色,故加入的量比菲和芘少.
青顶拟多孔菌对5mg/L蒽+30mg/L菲复合PAHs的降解率分别是:11d降解蒽 63.54%、菲42.00%;22d降解蒽94.11%、菲91.91%;33d降解蒽 99.47%、菲 99.46%.可见,初始阶段(0~11d)和培养中期(11~22d)菌种降解对菲的作用明显,降解率累积增幅较大,分别为42%和49.91%;在22d之后,降解作用趋于平缓,降解率累积增幅较小,仅为7.55%.

该菌对5mg/L蒽+30mg/L芘复合PAHs的降解率分别是:11d降解蒽53.94%、芘21.73%;22d降解蒽93.50%、芘56.54%;33d降解蒽98.91%、芘 61.09%(图 4).可见,在初始阶段(0~11d)和中期(11~22d),菌种对芘的降解作用较为明显,11d芘降解率累积增值较大,分别为 21.73%和 34.81%;而培养后期(22~33d)时,作用较小,11d累积降解率增幅仅为4.55%.
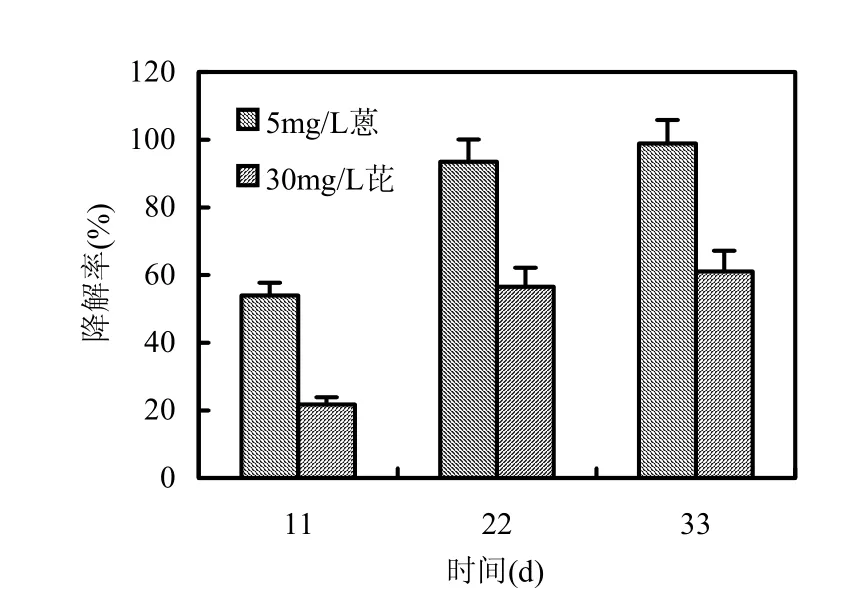
图4 5mg/L蒽+30mg/L芘的降解率Fig.4 The degradation rate under 5mg/L anthracene and 30mg/L pyrene
2.4 复合PAHs降解机理
在单一和复合基质条件下, 菌种对同一种类、同一浓度的PAHs作用力不同.从图5、图6可见,菌种对单一菲和芘的降解能力均较含有5mg/L蒽的培养液中菲和芘的降解能力弱,尤其在降解初期,如降解11d时,单一条件下菲的累积降解率小于添加5mg/L蒽的PAHs复合基质中菲的累积降解率 10.74%.随着降解时间的延长,复合和单一 PAHs的降解差别逐渐缩小,这可能是由于单一PAHs经青顶拟多孔菌降解后产生了易被该菌利用的物质,从而通过共代谢作用加速了单一 PAHs的降解,由此可以得出,在有易被青顶拟多孔菌降解的 PAHs存在时,一些难降解的PAHs在短时间内也可得到较高的降解率(见图5中降解11d数据).综上,在复合PAHs的降解研究中,蒽的投加不但没有减弱菌种对菲和芘的降解能力,反而在短时间内促进了2种PAHs的降解,增大了菌种对其的降解率,虽然蒽的加入能够增大菌种对菲和芘的降解能力,但是青顶拟多孔菌对芘的降解率仍然远小于菲,这是由于 PAHs结果不同,菌种的作用方式不同.对于低环的菲,菌种可以直接代谢,较容易利用;对于大分子量、高环的芘,菌种利用形式较复杂,需要借助于外加碳源,采用共代谢的方式才能够对其进行代谢降解[26].

图5 不同条件菲降解率的对比Fig.5 The phenanthrene degradation rate in different conditions
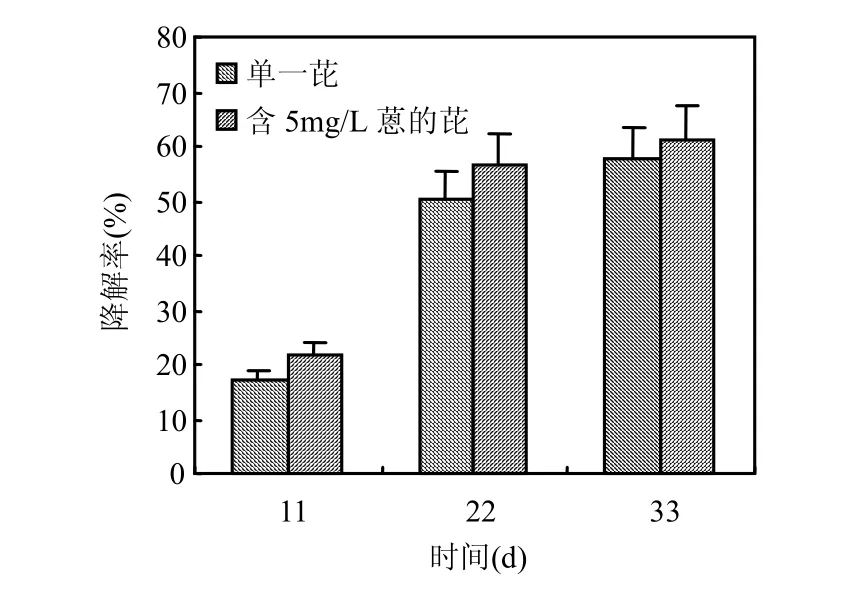
图6 不同条件下芘降解率的对比Fig.6 The pyrene degradation rate in different conditions
另外,高分子 PAHs一般是通过共代谢方式被微生物降解的[27-28].本研究发现,青顶拟多孔菌能够很好地将PAHs与外加的营养物质结合进行共代谢,有效利用营养底物,发挥自身峰值高、周期长(整个酶活周期超过30d)的产酶优势,通过分泌大量的漆酶完成对 PAHs的高效降解.对于单一 PAHs而言,菌种利用营养底物提供的碳源和能源对PAHs进行共代谢降解,该降解率与PAHs的结构和性质密切相关[29-30];对于复合 PAHs的研究则发现,体系内除了存在营养底物与 PAHs之间的共代谢之外,还存在着另外一种重要的共代谢形式,即PAHs之间的共代谢,不同种类PAHs之间存在着共代谢关系已被巩宗强等[31]的研究所证实,并且此类共代谢研究在其他难降解物质中也有发现[32]. PAHs之间的共代谢作用形式在体系中发挥着不可替代的作用,对比图 5和图 6可知,复合基质中菲和芘的降解率都高于单一的菲和芘,也就证明蒽在体系中起到促进菲和芘降解的作用,即在 PAHs降解体系中,适当投加一种较容易降解的PAHs会刺激菌种更好地利用难降解PAHs.而且菌种对复合PAHs的降解并不是分开的,而是一同进行的,只是对于相对容易利用的物质发挥的作用更加明显.
3 结论
3.1 青顶拟多孔菌对 30mg/L等单一浓度蒽、菲、芘的33d累积降解率分别为94.76%、96.56%和57.53%.菌种对蒽和菲的降解能力均较强且能力接近,对芘的降解能力稍弱.不同种 PAHs被降解能力受PAHs的结构和性质影响,在低环PAHs中,环数越高,毒性越大,越难被降解;同种 PAHs不同时期的降解率大小则受菌种的产酶时期影响,该菌漆酶酶活较高,本研究中降解中期完全处于产酶高峰期,故净降解率最大.
3.2 青顶拟多孔菌对蒽+菲和蒽+芘两种复合PAHs中菲和芘的 33d降解率分别为 99.46%和61.09%.与单一情况下相比,降解率均有所增大.对于提高的降解率而言,蒽的作用不可忽视.少量蒽的加入,在体系中形成了一种有利于菌种更好的发挥降解能力的新代谢形式,即不同分子量PAHs之间的共代谢,菌种在这种代谢形势下,受到蒽的刺激,进一步增强了对菲和芘降解能力,从而增大了降解率.
3.3 青顶拟多孔菌能够有效地利用营养底物与PAHs、PAHs与PAHs两种共代谢形式,充分发挥对 PAHs的降解能力.在共代谢形式下,作为刺激物的低环 PAHs的适量加入,会诱导菌种发挥更大的降解潜力,在自身得到较好的降解的情况下,更加促进另一种难降解 PAHs的降解代谢,增大难降解多环芳烃的降解率.
[1] Zasadowski A, Wysocki A. Some toxicological aspects of polycyclic aromatic hydrocarbons (PAHs) effects [J]. Rocz.Panstw. Zakl. Hig., 2002,53(1):33-45.
[2] 陈燕燕,尹 颖,王晓蓉,等.湖表层沉积物中PAHs和PCBs的分布及风险评价 [J]. 中国环境科学, 2009,29(2):118-124.
[3] 李彭辉,王 艳,李玉华,等.泰山云雾水中多环芳烃的特征与来源分析 [J]. 中国环境科学, 2010,30(6):742-746.
[4] Pope C J, Peters W A, Howard J B. Thermodynamic driving forces for PAH isomerization and growth during thermal treatment of polluted soils [J]. Journal of Hazardous Materials,2000,79(1/2):189-208.
[5] Bertilsson S, Widenfalk A. Photochemical degradation of PAHs in freshwaters and their impact on bacterial growth-influence of water chemistry [J]. Hydrobiologia, 2002,469:23-32.
[6] Guieysse B, Viklund G. Sequential UV-biological degradation of polycyclic aromatic hydrocarbons in two-phases partitioning bioreactors [J]. Chemosphere, 2005,59:369-376.
[7] 王聪颖,王 芳,王 涛,等.生物强化和生物刺激对土壤中PAHs降解的影响 [J]. 中国环境科学, 2010,30(1):121-127.
[8] 李全霞,范丙全,龚明波,等.降解芘的分支杆菌M11的分离鉴定和降解特性 [J]. 环境科学, 2008,29(3):763-768.
[9] Binet P, Portal J M, Leyval C. Dissipation of 3-6-ring Polycyclic aromatic hydrocarbons in the rhizosphere of ryegrass [J]. Soil Biology and Biochemistry, 2000,32:2011-2017.
[10] Faraco V, Pezzella C, Miele A, et al. Bio-remediation of colored industrial wastewaters by the white-rot fungi Phanerochaete chrysosporium and Pleurotus ostreatus and their enzymes [J].Biodegradation, 2008,20(2):209-220.
[11] 黄 俊,余 刚,成 捷,等.白腐真菌生物降解五氯苯酚的动力学研究 [J]. 农业环境科学学报, 2004,23(1):167-169.
[12] Sasek V, Cajthaml T, Bhatt M. Use of fungal technology in soil remediation: A case study [J]. Water, Air, and Soil Pollution,2003,3:5-14.
[13] Andersson B E, Henrysson T. Accumulation and degradation of dead-end metabolites during treatment of soil contaminated with polycyclic aromatic hydrocarbons with five strains of white-rot fungi [J]. Appl. Microbial. Biotechnol., 1996,46:647-652.
[14] 张宏波,林爱军,刘 爽,等.芘高效降解菌的分离鉴定及其降解特性研究 [J]. 环境科学, 2010,31(1):243-248.
[15] Bourbonnais R, Paice M G. Oxidation of non-phenolic substrates.an expanded role for laccase in lignin biodegradation [J]. FEBS Lett, 1990,267(1):99-102.
[16] 张连慧,刘卫晓,葛克山,等.变色栓菌产锰过氧化物酶的条件优化 [J]. 微生物学通报, 2005,32(5):98-102.
[17] Pozdnyakova N N, Rodakiewicz-Nowak J, Turkovskaya O V, et al. Oxidative degradation of polyaromatic hydrocarbons catalyzed by blue laccase from Pleurotus ostreetus D1in the presence of synthetic mediators [J]. Enzyme and Microbial Technology,2006,39:1242-1249.
[18] Valentin L, Lu-Chau T A, Lopez C, et al. Biodegradation of dibenzothiophene, fluoranthene, pyrene and chrysene in a soil slurry reactor by the white-rot fungus Bjerkandera sp. BOS55 [J].Process Biochemistry, 2007,42:641-648.
[19] 聂麦茜,张志杰,雷 萍.优势短杆菌对多环芳烃的降解性能 [J].环境科学, 2001,22(6):83-85.
[20] Bossi S S, Neff J M. Toxicity of polynuclear aromatic hydrocarbons to the marine polychacte Neanthes arenaceodentata[J]. Mar. Pollut. Bull., 1978,9:220-223.
[21] Chang B V, Shiung L C, Yuan S Y. Anaerobic biodegradation of polycyclic aromatic hydrocarbon in soil [J]. Chemosphere,2002,48(7):717-724.
[22] 侯红漫,周集体,陈 丽.白腐菌漆酶特性及异生芳香化合物的降解 [J]. 林产化学与工业, 2003,23(1):89-94.
[23] 张金丽,郑天凌.利用发光菌评价多环芳烃及其降解产物的生物毒性 [J]. 集美大学学报(自然科学版), 2004,9(4):294-299.
[24] Majcherczyk A, Johannes C, Hiittermann A. Oxidation of polycvclic aromatic hydrocarbons by laccase of Trametes versicolo [J]. Enzyme and Microbial Technology, 1998,22:335-341.
[25] Pickard M A, Roman R, Tinoco R, et al. Polycyclic aromatic hydrocarbon metabolism by white rot fungi and oxidation by Coriolopsis gallica UAMH 8260laccase [J]. Appl. Environ.Microbiol., 1999,65:3805-3809.
[26] 董春娟,吕炳南,陈志强,等.处理生物难降解物质的有效方式—共代谢 [J]. 化工环保, 2003,23(2):82-85.
[27] Horvath R S. Microbial Co-Metabolism and the Degradation of Organic Compounds in Nature [J]. Bacteriological Reviews, 1972,36(2):146-155.
[28] Perry J J. Microbial Cooxidations Involving Hydrocarbons [J].Microbiological Reviews, 1979,43(1):59-72.
[29] Juhasz A L, Naidu R. Bioremediation of high molecular weight polycyclic aromatic hydrocarbons: A review of the microbial degradation of benzo [a] pyrene [J]. International Biodeterioration and Biodegradation, 2000,45:57-88.
[30] 陈春云,岳 珂,陈振明,等.微生物降解多环芳烃的研究进展[J]. 微生物学杂志, 2007,27(6):100-103.
[31] 巩宗强,李培军,王 新,等.芘在土壤中的共代谢降解研究 [J].应用生态学报, 2001,12(3):447-450.
[32] Kim M H, Hao O J. Cometabolic degradatien of chlorophenols by acinetobacter species [J]. Water Research, 1999,33(2):562-574.
致谢:本实验采用的菌种来自中科院微生物研究所,在此表示感谢.
Degradation characteristics of single and mixed PAHs by Polyporellus picipes.
DU Li-na1, GAO Da-wen1,2*(1.School of Forestry, Northeast Forestry University, Harbin 150040, China;2.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2011,31(2):277~282
Polyporellus picipes, which existed commonly in forest area of northeast China, was used to degrade single and mixed polycyclic aromatic hydrocarbons (PAHs). The accumulated degradations of phenanthrene, anthracene and pyrene were measured in 11, 22and 33d respectively. The degradation of single PAHs were phenanthrene > anthracene> pyrene,and the accumulated degradation efficiencies of 33days were 96.56%, 94.76% and 57.53%, respectively. The accumulated degradation efficiencies of phenanthrene and pyrene in the presence of anthracene were 99.46% and 61.09%. In mixed PAHs degradation, adding a bit of anthracene would stimulate Polyporellus picipes to degrade phenanthrene and pyrene,and make the degradation efficiencies of them raise 2.9% and 3.56%. In conclusion, to improve the degradation of high molecular weight (HMW) or refractory PAHs, the low molecular weight (LMW) PAHs could be used as the co-metabolism substrates for HMW PAHs degradation.
Polyporellus picipes;single PAHs;mixed PAHs;degradation;co-metabolism
X172
A
1000-6923(2011)02-0277-06
2010-05-19
全国优秀博士学位论文作者专项研究基金(200544);教育部博士点基金(20100062110002);黑龙江省杰出青年研究基金(JC200909)
* 责任作者, 教授, gaodw@nefu.edu.cn
杜丽娜(1984-),女,黑龙江省黑河市人,东北林业大学林学院环境科学专业硕士研究生.主要研究方向为环境生物技术.发表论文1篇.

