miR-126对小鼠乳腺上皮细胞增殖及泌乳功能的影响
崔巍,王春梅,李庆章,冯丽,丁巍
(东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
miR-126对小鼠乳腺上皮细胞增殖及泌乳功能的影响
崔巍,王春梅,李庆章,冯丽,丁巍
(东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
应用脂质体转染技术,改变miR-126在小鼠乳腺上皮细胞中的表达量,采用qRT-PCR、HPLC、Western印迹等技术检测miR-126对小鼠乳腺上皮细胞的影响。结果显示,miR-126沉寂后,细胞增殖能力提高,β-酪蛋白表达增加,乳糖质量浓度增加,孕酮受体(PGR)表达增强。研究表明,miR-126可能通过抑制靶蛋白PGR表达,进而抑制乳腺上皮细胞增殖和泌乳量变化。
微小RNA;miR-126;孕酮受体(PGR);基因沉寂
0 引言
一类通过翻译抑制调控基因表达的非编码RNA的发现,开启了哺乳动物细胞一种新的基因调控途径。包括人类的发育和衰老、神经疾病和癌症的治疗[1]。有研究证明miR-126与抑制乳腺癌细胞的增殖[2]及转移[3]有关。应用微阵列已分析出miR-126在小鼠乳腺生长发育不同时期表达差异,可能参与乳腺发育的调控[4]。利用miRBase方法预测分析,小鼠孕酮受体(progestrone receptor,PGR)mRNA存在与miR-126结合位点。为进一步阐释miR-126作用机制,本文拟从不同发育时期乳腺组织中鉴定miR-126差异性,对miR-126沉寂,在细胞水平检测PGR变化及对小鼠乳腺细胞发育及泌乳功能的影响。
1 材料和方法
1.1 材料
雌性BALB/C小白鼠。X-tremeGene SiRNA Transfection Reagent;miR-126-3p inhibitor,Negative Control(N.C),Hairpin-itTM microRNA qPCR Quantitation Kit,Trizol,Opti-MEM I medium,PGR多克隆抗体,GAPDH多克隆抗体,细胞角蛋白18抗体,SYBR○RPremix Ex TaqTMⅡ,辣根酶标记IgG,FITC二抗,ECL超敏发光液,CASY-ton缓冲液。
1.2 小鼠乳腺不同发育时期miR-126表达谱
针对小鼠不同发育时期乳腺组织,具体时间点进行取材,采用荧光定量的方法对小鼠乳腺发育、泌乳及退化中miR-126进行相对定量分析,同时验证基因芯片的结果。miR-126 RTprimer和PCR扩增引物均由上海吉玛公司合成。取不同时间点小鼠乳腺组织,提取总RNA,逆转录条件:16℃(30 min),42℃(30 min),85℃(10 min)。应用ABI 7500PCR仪,PCR条件:95℃(3 min),95℃(12 s),62℃(30 s),40个循环。以5 s为内参。
1.3 小鼠乳腺上皮细胞培养与鉴定
取妊娠中期雌鼠乳腺组织,用胰蛋白酶37℃消化,再用I型胶原酶37℃继续消化,所得乳腺上皮细胞沉淀接种培养瓶中,于CO2培养箱中培养。细胞角蛋白18免疫荧光染色,在激光共聚焦显微镜下观察细胞角蛋白18的特异性表达[5]。
1.4 小鼠乳腺上皮细胞的瞬时转染
取对数生长期的小鼠乳腺上皮细胞,用培养基将其浓度调整为1.0×104细胞/mL,接种于培养板中,当细胞生长密度达到80%左右时,用miR-126 inhibitor和Negative Control分别转染小鼠乳腺上皮细胞,具体操作参见X-tremeGENE siRNA Transfection Reagent说明书。实验分组如下:转染组:miR-126 inhibitor+X-tremeGENE siRNA Transfection Reagent;阴性对照组:Negative Control+X-tremeGENE siRNA Transfection Reagent;空白组。
1.5 小鼠乳腺上皮细胞活性测定
用X-tremeGENE siRNA Transfection Reagent进行转染,实验同1.4转染和阴性对照组,每组设3个平行,转染48 h后,消化收集各组细胞,CASY-ton缓冲液1︰100稀释后用CASY细胞分析仪检测活细胞数和细胞活力。
1.6 检测转然后细胞内miR-126相对变化
实验同1.4,分转染组和阴性对照组,每组3个平行,48 h后收获细胞,提取细胞中总RNA,应用qRTPCR技术检测miR-126的表达变化。
1.7 Westernblotting检测PGR蛋白
实验同1.4分,分3组,转染48 h后,分别收集以上各组小鼠乳腺上皮细胞,用2×SDS上样缓冲液提取细胞总蛋白,进行8%SDS-PAGE凝胶电泳并转膜,一抗为兔抗鼠PGR多克隆抗体,二抗为HRP标记的山羊抗兔IgG,ECL化学发光系统显示蛋白质表达,以GAPDH为内参,进行光密度分析。
Western blotting检测β-酪蛋白变化,实验同1.7。
1.8 HPLC检测乳糖质量浓度
实验分2组:转染组和阴性对照组,每组设3个平行,收集48 h的样品;色谱柱,十八烷基硅烷键合硅胶,F4.6 mm×150 mm;柱温,室温;紫外检测波长,195 nm;流动相,5%乙腈,经过0.22 μm滤膜过滤,超声脱气;流速,恒流0.6 mL/min;进样体积,10 μL。在同等条件下进行乳糖标准品的测定。
1.9 数据处理
荧光定量PCR的结果以Ct值显示,采用ΔΔCT法分析,计算相对定量结果(2-ΔΔCT)。采用SPSS13.0软件对相关实验数据进行t-检验分析,BandScand4.3软件对Western blotting图谱进行灰度扫描。
2 结果
2.1 不同发育时期小鼠乳腺组织miR-126表达谱
分别取青春4、5、7周,妊娠5、13、18日,泌乳3、7、13日、退化期2、5、10日乳腺组织,提取总RNA,甲醛变性电泳检测鉴定各时间点RNA质量,以逆转录cDNA为模板PCR,分别扩增miR-126和内参5 s,得出表达结果。miR-126在泌乳期相对变化较低(P<0.01),其次是妊娠期(P<0.01),青春7周相对变化最高(P<0.01,图1)。

图1 qRT-PCR检测小鼠乳腺中miR-126的表达
图1中,依次为青春4周、5周、7周;妊娠5日、13日、18日;泌乳3日、7日、13日;退化2日、5日、10日。
2.2 抑制剂对内源miR-126表达影响
miR-126 inhibitor转染48 h后,经qRT-PCR检测,比较转染组、阴性对照组中miR-126的表达变化,结果显示miR-126在转染组表达量较阴性对照组显著降低(P<0.01,图2)。
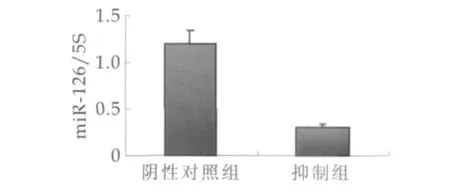
图2 qRT-PCR检测转染后miR-126表达
由图2可以看出,miR-126 inhibitor作用后内源性miR-126表达量显著减少,P<0.01。
2.3 转染后对细胞活力的影响
miR-126 inhibitor转染48 h后,CASY细胞分析仪分析小鼠乳腺上皮细胞活性,转染组小鼠乳腺上皮细胞活性高于阴性对照组(P<0.05,如表1),且差异显著,说明miR-126可抑制小鼠乳腺上皮细胞活性。

表1 miR-126 inhibitor作用后小鼠乳腺上皮细胞活性变化
2.4 转染后PGR蛋白表达变化
Western blotting技术检测转染组、阴性对照组和空白对照组小鼠腺上皮细胞中PGR蛋白表达的变化情况。结果显示在miR-126 inhibitor的作用下,小鼠乳腺上皮细胞中PGR蛋白的表达高于阴性对照组和空白对照组(P<0.05,图3),说明miR-126可抑制小鼠乳腺细胞中PGR蛋白的表达。
图3(a)中,1为空白对照组;2为阴性对照组;3为抑制组;用miR-126 inhibitor和negative control分别转染小鼠乳腺上皮细胞;转染48 h后,应用Western blotting检测PGR蛋白的表达。图3(b)中,灰度扫描分析PGR的表达;通过3个平行实验获得实验数据;结果显示抑制组显著高于阴性对照组和空白对照组(means±SE,P<0.05)。
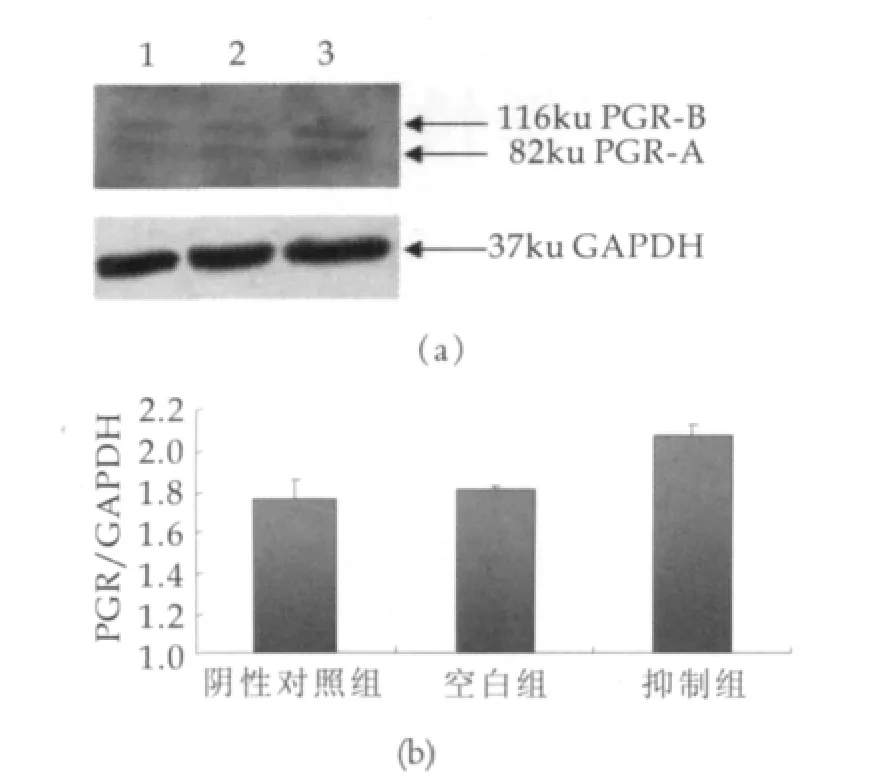
图转染后蛋白表达变化
2.5 转染后β-酪蛋白表达变化
Western blotting技术检测转染组、阴性对照组和空白对照组小鼠腺上皮细胞中β-酪蛋白表达的变化情况。结果显示在miR-126 inhibitor的作用下,小鼠乳上皮细胞中β-酪蛋白的表达显著高于阴性对照组和空白对照组(P<0.01,如图4),说明miR-126可抑制小鼠乳腺细胞中β-酪蛋白的表达。

图4 转染后β-酪蛋白的变化
图4(a)中,1为抑制组;2为空白组;3为阴性对照组;用miR-126 inhibitor和negative control分别转染小鼠乳腺上皮细胞;转染48 h后,应用Western blotting检测β-酪蛋白的表达。图4(b)中,灰度扫描分析β-酪蛋白的表达;通过3个平行实验获得实验数据;结果显示抑制组显著高于阴性对照组和空白对照组(means±SE,P<0.01)。
2.6 转染后乳糖质量浓度变化
根据乳糖标准曲线分析,并比较阴性对照组,结果显示,miR-126 inhibitor转染后乳糖质量浓度增加(P<0.05,如图5),说明miR-126可抑制小鼠乳腺上皮细胞乳糖的分泌。
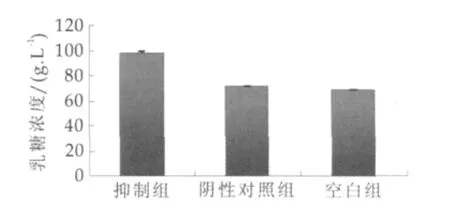
图5 转染后乳腺上皮细胞乳糖分泌变化
3 讨论
内含子miRNA代表着一种新的研究领域,在细胞系、斑马鱼、小鼠皮肤中内含子miRNA诱导的基因沉默证明,这种内含子介导的基因调控系统在真核生物中是高度保守的[1]。目前对miRNA功能研究主要集中在基因的调控和细胞发育及分化上。越来越多的证据显示,miRNA的失调与癌症相关[6-8]。研究发现,miR-126可以通过抑制肿块的生长,从而抑制高侵袭性乳腺癌细胞CN34的转移[3]。有试验表明,miR-126是通过抑制细胞从G0/G1期进入S期,从而抑制了细胞的增殖[9]。在乳腺发育及泌乳的研究中发现,孕酮受体(PGR)基因仅在乳腺上皮组织中表达[10],其表达调控也属于组织特异性激素调控[11]。PGR都存在A、B两种亚型,由同一基因编码,在没有怀孕和已经怀孕的成年小鼠乳腺中,PGR-A蛋白的表达水平超过PGR-B[12]。
本实验应用生物信息学、微阵列分析及荧光定量实验分析得出,miR-126结合靶基因PGR mRNA并进行调控,同时对小鼠乳腺上皮细胞的增殖和泌乳有着一定的抑制作用,并在翻译水平上影响靶蛋白,这为进一步研究miRNA在乳腺发育及泌乳功能方面的作用提供了一定的实验依据。
[1] YING S Y.miRNA实验指南[M].郑晓飞译.北京:化学工业出版社,2008.
[2] IORIO M V,FERRACIN M,LIU C G,et al.MicroRNA Gene Expression Deregulation in Human Breast Cancer[J].Cancer Res.,2005,65:7065-7070.
[3] TAVAZOIE S F,ALARCON C,OSKARSSON T,et al.Endogenous Human microRNAs that Suppress Breast Cancer Metastasis[J].Nature,2008,451:147-152.
[4] WANG C M,LI Q Z.Identification of Differentially Expressed microRNAs during the Development of Chinese Murine Mammary Gland[J].J Genet Genomics,2007,34(11):966-973.
[5] 王春梅,李庆章,李晔.miR-138对小鼠乳腺上皮细胞的作用及其调控的靶序列[J].生物化学与生物物理进展,2008,35(7):834-838.
[6] CALIN G A,DUMIRTU C D,SHIMIZU M,et al.Frequent Deletions and down-Regulation of MicorRNA Genes miR15 and miRl6 at l3q14 in Chronic LymPhoeytic Leukemia.Proc Natl Acda Sci.USA,2002,99(24):15524-15529.
[7]MICHAEL M Z,O’CONNOR S M,HOLST PELLEKAAN N G,et al.Reduced Accumulation Specific microRNAs in Coloectal Neoplasia[J].Cancer Res.,2003:882-891.
[8] TAKAMIZAWA J,KONISHI H,YANAAGISAWA K,et al.Reduced Expression of the let-7 microRNAs in Human Lung Cancers in Association with Shortened Postoperative Survival[J].Cancer Res.,2004,64,3753-3756.
[9] ZHANG J,DU Y Y,LIN Y F,et al.The Cell Growth Suppressor,miR-126,Targets IRS-1[J].Biochem Biophys Res.Commun,2008,377:136-140.
[10] 张宝云.孕酮受体基因的研究进展[J].遗传,2008,30(12):1536-1544.
[11] IWAI T,FUJII S,NANBU Y,et al.Effect of Human Chorionic Gonadotropin on then Expression of Progesterone Receptor and Estrogen Receptor in Rabbit Ovarian Granulosa Cells and the Uterus[J].Endocrinology,1991,129(4):1840-1848.
[12] FANTL V,EDWARDS PA,STEEL J H,et al.Impaired Mammary Gland Development in cyl-1 mice during Pregnancy and Lactation is Epithelial Cell Autonomous[J].Dev Biol,1999,212(1):1-11.
Impact of miR-126 on proliferation and lactation of Mouse mammary epithelial cells
CUI Wei,WANG Chun-mei,LI Qing-zhang,FENG Li,DING Wei
(Key Laboratory of Dairy Science of Education Ministry,Northeast Agricultural University,Harbin 150030,China)
In this study,liposome transfection techniqueswere used to change the expression of miR-126 in mouse mammary epithelial cells.The effect of miR-126 on mouse mammary epithelial cells was analyzed by qRT-PCR,HPLC,Western blotting.The results showed that,after miR-126 silence cell proliferation ability enhanced,beta casein expression increased,lactose content increased,progesterone receptor(PGR)expression enhanced.The results suggest that miR-126 probably inhibit mammary epithelial cells and lactation by suppressing expression of PGR.
microRNA;miR-126;progestrone receptor;gene silencing
Q936
A
1001-2230(2011)03-0017-03
2010-12-13
国家自然科学基金(No.31072103)。
崔巍(1985-),女,硕士研究生,研究方向为乳腺发育与泌乳功能调控。
李庆章

